Группа нейродегенеративных заболеваний
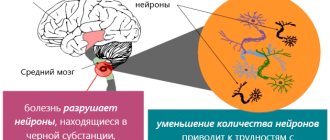
Данная группа болезней характеризуется поражением центральной нервной системы. Определенное количество нейронов погибает, а это приводит к неврологическим патологиям. Нейродегенеративные заболевания могут иметь разные причины возникновения и разные клинические проявления. Характерно, что все болезни данной категории неизлечимы.
Вся терапия, которая применяется, является симптоматической. То есть она облегчает проявление болезни, но никак не способствует регенерации поврежденных участков. Наиболее эффективной была бы трансплантация нервной ткани, однако метод имеет как технические, так и моральные препятствия. К подобным болезням можно отнести заболевание Альцгеймера, Паркинсона, Фара.
https://www.youtube.com/watch?v=https:accounts.google.comServiceLogin
Группа подобных заболеваний характеризуется проявлениями поражений ЦНС. Некоторое количество нейронов гибнет, что ведет к развитию неврологических патологий. Нейродегенеративные заболевания могут возникать по разнообразным причинам, а также имеют различные клинические проявления. Характерной особенностью всех заболеваний из данной группы является их неизлечимость. Все осуществляемые терапевтические действия носят симптоматический характер.
То есть терапия направлена на облегчение симптомов болезни, но никаким образом не способна повлиять на регенерацию участков, которые повреждены. Самым эффективным способом лечения могла бы стать трансплантация тканей, но такой метод имеет несколько ограничений, в первую очередь технических и моральных.
Самыми известными заболеваниями данной группы являются болезнь Альцгеймера, Паркинсона, синдром Фара. Зачастую ранняя диагностика этих заболеваний затруднена. В процессе диагностики врачи в основном учитывают жалобы пациентов и наблюдают за их поведением. Самым современным и эффективным методом диагностики заболеваний этой группы является томография, как компьютерная, так и магниторезонансная.
Присущая болезни симптоматика
Самыми первыми признаками заболевания выступают:
хроническая усталость, быстрая утомляемость даже при сниженных физических нагрузках;- нарушение координации при движениях, изменение походки (шаркающие движения ногами), неуклюжесть;
- речевая дисфункция;
- появление неконтролируемых спастических движений, ночная мышечная активность;
- в детском возрасте наблюдается спазмирование пальцев рук, столбирование мышц тела, придающее неестественные позы;
- во взрослом возрасте часто происходит онемение лицевых участков, замедление сенсорного восприятия и ответной реакции на внешние раздражители, сковываются движения всех частей тела;
- наблюдается не проходящая дрожь в конечностях.
Часто проявляются симптомы паркинсонизма:
- широкие, размашистые движения, несоизмеримые с предполагаемыми действиями;
- слабость в руках и ногах, неконтролируемые рефлексы в сухожильном аппарате;
- потеря контроля за функциями выделения, моченедержание;
- в детском возрасте возможно проявление эпилептического синдрома.
Нарушение когнитивных функций:
- упадок способности к запоминанию;
- замедленность мыслительного процесса;
- отсутствие способности задерживать внимание на одном процессе;
- невозможность анализировать происходящее, упадок интеллекта.
Прогрессирующее развитие описанной симптоматики приводит к развитию олигофрении в детском возрасте и к деменции в зрелый период, однако имеют место случаи, когда заболевание не приводит к снижению интеллекта у детей и подростков.
Наследование синдрома Фара
Так как данная болезнь – явление довольно редкое, то специалистам сложно предоставить правильную клиническую картину синдрома. Симптомы могут проявляться, если возраст пациента превышает 40 лет. У более молодых людей болезнь Фара симптомы может иметь смазанные и нечеткие. У пациентов нарушается координация движения, паркинсонизм.
Также о развитии заболевания могут свидетельствовать такие признаки, как тремор, дистония, быстрые и беспорядочные движения конечностей (хорея), непроизвольные сокращения кистей, стоп. Так как болезнь поражает участки головного мозга, то снижается работоспособность, умственные возможности. Страдает также и память человека.
Часто нарушается и речь. К другим неврологическим признакам можно отнести болевые ощущения, расстройства психики. Различают ювенильную форму заболевания, которая проявляется у детей, подростков. Основные симптомы при этом таковы: дистония, хорея, припадки эпилепсии. Сенильная форма характерна для лиц среднего и более пожилого возраста. В этом случае наблюдается паркинсонизм, нарушения речи, другие проблемы в работе нервной системы. Также может возникнуть недержание мочи.
Причины, из-за которых возможно развитие болезни, точно не установлены. Однако известно, что огромное влияние на ее возникновение имеют нарушения работы щитовидной, паращитовидной желез. При этом происходят сбои в обменных процессах кальция, фосфора. Подобные нейродегенеративные заболевания могут возникнуть и при нарушениях кислотно-щелочного баланса в организме.
Описание и причины заболевания
Патология характеризуется симметричным отложением кальциевых элементов в структурах головного мозга – в подкорковой области, мозговой оболочке и мозжечковой зоне. Заболевание включает только случаи первичной кальцификации, минеральные скапливания на фоне иных патологий (вторичные случаи) в клиническую картину болезни не входят. Впервые наиболее полное описание аномального процесса было создано в 30-х годах прошлого века немецким доктором К.Т. Фаром.
Заболевание относится к категории редко встречающихся, так как фиксируется только один случай на миллион жителей планеты. Мужская половина человечества подвержена указанным нарушениям в два раза чаще, чем женская. Проявиться феномен может в любом возрасте, однако самой частой возрастной категорией является период от 30 до 60 лет. Так как болезнь протекает практически бессимптомно, а явные признаки очень схожи с иными неврологическими заболеваниями, при жизни пациента выявляется только около 2% патологических случаев.
Внешние и внутренние факторы развития болезни пока установить не удалось. Большинство ученых – медиков склонно считать, что имеет место врожденная, генетическая этиология, так как часто прослеживается наследственный фактор в одной и той же семье. Существуют исследования, доказывающие теорию о мутациях в генетическом коде с поражением 14, 2 и 8 хромосомы, изучение данного вопроса ведется до сих пор. В противовес данной теории выступают случаи, когда заболевание проявлялось у людей, не имевших в старшем поколении больных данным феноменом родственников. Первое проявление симптоматики происходит уже на стадии критического заполнения мозговых волокон кальциевыми вкраплениями, что не позволяет исследовать течение болезни при жизни человека.
При патологоанатомических исследованиях выявляется симметричное присутствие кальцинатов в тканях лобных долей, мозжечковой зоне. Больше всего скоплений присутствует в подкорковой области, реже отложения замечаются на сосудистых каналах (по большей части на артериальных стенках). По внешнему виду отложения напоминают микроскопические нитевидные каналы с вкраплениями металлических элементов различного характера.
В медицинской литературе встречается две формы патологии, подразделяющиеся по возрастному признаку и присущим симптомам. Первая форма представлена так называемой ювенальной формой, так как первичные проявления возникают в детском или младшем подростковом возрасте. Замечается незначительный спад интеллектуальных и когнитивных способностей, замедлением функциональности мышечного аппарата. Частым «сопровождающим» указанной формы аномалии выступает параллельная олигофрения. С течением времени симптоматика перерастает в признаки болезни Паркинсона.
Вторая форма характеризуется как синильная – проявляет себя в среднем или пожилом возрасте. Основными симптомами выступают признаки паркинсонизма с явными нарушениями упадка интеллектуальных способностей. Со временем происходит прогрессирование глубокой деменции.
Методы диагностики
До возникновения компьютерной томографии больным проводились рентгенологические исследования головного мозга. Благодаря появлению современных методов исследования, специалисты получили более информативные картинки с пораженной зоны. Однако стоит отметить, что большей чувствительностью при данной клинической картине обладает компьютерная, а не магнитно-резонансная томография.
При анализе большинства снимков пораженные участки ограничиваются бледным шаром. Имеют они небольшие размеры. Чаще всего терпят изменения базальные ганглии, таламус, мозжечок. Уровень кальцинации примерно одинаковый что у молодых, что у пожилых людей. Также не обнаружены различия между группами, у которых болезнь Фара протекает бессимптомно, и тех, где синдром сопровождается ярко выраженными признаками.
При проведении патологоанатомического исследования в головном мозге наблюдают следующую картину: сосуды имеют белесоватый вид (некоторые ветвистые участки). При прикасании ножа они издают звук, похожий на хруст. Для гистологического анализа проводится забор материала: срезы коры головного мозга, базальных ганглиев, мозжечка.
Именно в области последних кальцификация встречается чаще всего. На образцах присутствуют соли кальция. Также чаще всего они выявляются на артериях (мелких, средних), капиллярах. Реже (единичные случаи) болезнь Фара поражает вены. По всей длине сосудов, а также в прилегающих тканях обнаруживаются конгломераты кальция маленьких размеров. Также в тканях выделяют присутствие следов мышьяка, алюминия, кобальта, мукополисахаридов.
В зависимости от того, имеет ли болезнь Фара симптомы, постановка диагноза может несколько утрудняться. Нередко ее диагностируют случайно, проводя томографию для подтверждения совсем другого заболевания. Прежде всего, специалист исключает нарушение обмена кальция, других пороков развития. Затем назначается компьютерная томография (или же рентгенологические исследования).
Врачи отмечают, что одной из проблем в постановке правильного диагноза является гипопаратиреоз. Это заболевание, которое возникает при дефиците паратгормона. Вследствие этого уровень кальция в крови снижается, а уровень фосфора растет. Если при компьютерной томографии наблюдается кальцинация стриопаллидозубчатых структур, то того, чтобы отличить гипопаратиреоз от такого состояния, как болезнь Фара, необходимы дополнительные анализы.
Профилактика гипопаратиреоза
Чтобы предупредить возникновение гипопаратиреоза во время хирургических операций на щитовидной железе, следует применять щадящие оперативные методики в отношении к паращитовидным железам. Пациентам с рецидивирующим токсическим зобом во избежание развития гипопаратиреоза рекомендуется проводить лучевую терапию радиоактивным йодом вместо хирургической операции. Важна профилактика послеоперационных осложнений (спаек, инфильтратов), которые способны нарушить кровоснабжение околощитовидных желез, а также раннее обнаружение у послеоперационных пациентов симптомов повышенной нервно-мышечной возбудимости и своевременное принятие мер.
Для предупреждения судорожного синдрома (тетании) и развития острого гипокальциемического криза при гипопаратиреозе необходимо исключить провоцирующие факторы, профилактировать интоксикации и инфекции.
Пациенты с гипопаратиреозом обязаны соблюдать молочно-растительную диету, обогащеннуюкальцием и обедненную фосфором, без мясных продуктов, вызывающихразвитие тетании, а такженаходиться на диспансерном учете для осуществленияконтроля за содержанием кальция и фосфора в костях и крови.
Последствия
Каковы при болезни Фара последствия?
Все перечисленные признаки реализуются только в том случае, если имеется полное доминирование, и для появления признака будет достаточно всего лишь одного гена доминантного характера.
https://www.youtube.com/watch?v=ytaboutru
На основании перечисленных особенностей типа наследования, по которому осуществляется передача синдрома Фара, можно сказать о том, что наличие больного гена у будущего папы может стать причиной проявления заболевания и у ребенка. Для того чтобы определить вероятность, с которой ваш ребенок может унаследовать болезнь Фара, стоит обратиться к специалисту по генетике, который проведет все необходимые исследования и расчёты и даст достаточно точный результат.
Клиника и симптомы
Определение наличия заболевания Фара затруднено неясной клинической картиной. Протекает болезнь зачастую бессимптомно. Даже если у человека установлено развитие синдрома, то зачастую он его не ощущает. Патологическое накопление кальция в области мозга проявляется следующими симптомами:
- нарушение двигательной функции;
- ухудшение умственной деятельности, вплоть до слабоумия;
- спастические параличи;
- головная боль;
- нарушения в движении глазного яблока;
- дизартрия;
- судорожный синдром.
При проявлении синдром Фара с признаками паркинсонизма, его симптомами могут быть:
- тремор;
- постоянное пребывание мышц в напряженном состоянии;
- шаркающая походка;
- неподвижное лицо, напоминающее маску;
- непроизвольное сжимание пальцев, имитирующее скатывание пилюль.
Такие симптомы характерны для поздней стадии заболевания. Кроме неврологических и психических симптомов болезни, возможны, хотя и гораздо реже, признаки аномалии черепа, глаукомы, пигментного ретинита, патологии эндокринной системы (гипопаратиреоз).
Формы нарушения — их симптоматика
Общим для любой нейродегенеративной болезни является медленно прогрессирующая гибель нервных клеток, но проявляться она может в разных формах и разновидностях.
Наиболее распространенным является проявление паракинсонизма, повышенной мышечной ригидности. Нарушение функции паращитовидной железы, первичное или после операции, изменяет выработку паратгормона, что в свою очередь повышает уровень фосфора в крови и снижает уровень кальция.
Проявляться такие нарушения могут в виде тремора, дистонии, дискинезии, непроизвольных судорог лица, конечностей или туловища.
Следующими по распространенности можно назвать нарушения основных функций мозга, которые проявляются ослаблением памяти, чрезмерно сильной реакцией на различные события в жизни человека.
Связь болезни с нарушением нормального обмена кальция, приводит к неврологическим проявлениям, сопровождающимся мышечными спазмами. Проявляется заболевание также в психиатрических расстройствах, изменении подходки, сильных болевых ощущениях.
Нередко синдром Фара диагностируется на фоне таких заболеваний как токсоплазмоз, поражение паразитом свиного цепня, эхинококкоза. Реже диагностируют заболевание, выраженное туберозным склерозом Бурневилля.
Привилегированный орган
Мозг — это орган, примечательный во многих отношениях [1]. Бесконечная сложность устройства, его функциональные возможности и связь нашей жизни с его состоянием приковывают к мозгу внимание исследователей. Взаимоотношения мозга с иммунной системой нашего организма тоже носят особенный характер: мозг является иммуннопривилегированным органом. Иммунные реакции, которые легко развиваются в остальных тканях (клетках печени, мышцах, жировой клетчатке), в мозге возникают редко. Вместе с мозгом в таких особых отношениях с иммунной системой оказались щитовидная железа, яички и некоторые ткани глаза, в частности, роговица.
В сознании врачей второй половины ХХ века мозг представлял собой структуру, полностью изолированную от иммунных процессов остального организма. В начале прошлого века японские ученые проводили опыты по имплантации клеток саркомы (злокачественной опухоли мышечной ткани) в различные органы мышей [2]. Оказалось, что при помещении клеток саркомы в ткани мозга опухоль активно развивается, а в случае их имплантации под кожу грызунов или в мышечную ткань опухоль не развивалась. Исследователи предположили, что «центр» (мозг) изолирован от иммунных процессов, которые успешно побороли саркому «на периферии» (другие ткани). Дальнейшие исследования только подтверждали этот вывод. Мозг в представлениях ученых стал «чистой зоной», в которой не развивается иммунный ответ. В 1950-х годах возник термин «иммунологическая привилегия», введенный британскими учеными по фамилии Биллингэм и Босуэлл [3].
Преодолевая барьеры
Длительное время считалось, что основой иммунной привилегии головного мозга является наличие гемато-энцефалического барьера (ГЭБ). ГЭБ — это комплекс клеточных и внеклеточных структур, которые отделяют кровь, текущую в капиллярах, от нейронов паренхимы мозга. Клетки стенок сосудов, базальная мембрана, на которой они лежат, астроциты участвуют в формировании ГЭБ. Иммунная привилегированность частей центральной нервной системы хорошо согласовывалась с распространенностью ГЭБ внутри нее. Паренхима головного мозга надежно защищена ГЭБ, и в ней редко возникают воспалительный процессы (энцефалиты). Хориоидные сплетения, продуцирующие спинномозговую жидкость, и оболочки головного мозга не имеют такого прикрытия, и их воспаление (хориоидит, менингит) встречается гораздо чаще (рис. 1).
Рисунок 1. Строение центральной нервной системы. К частям, которые хорошо защищены ГЭБ, относятся серое и белое вещества. Другие компоненты не имеют такой защиты.
[2]
Есть случаи, в которых даже ГЭБ не спасает нервную систему, и в мозге возникают процессы воспаления. Однако важно ответить для себя на вопрос: протекают ли они так же, как во всем остальном организме? Может быть, мозг имеет особый способ иммунного реагирования, и иммунная привилегия имеет дополнительные объяснения? В лабораторных условиях иммунный ответ в тканях можно вызвать при помощи введения бактериального липополисахарида (ЛПС). Это структурный компонент клеточной стенки грамотрицательных бактерий, запускающий каскад иммунных реакций в нашем организме. При изучении реакции разных тканей организма на введение ЛПС выяснилось, что иммунный ответ в коже и хориодиных сплетениях ЦНС возникают на одну и ту же дозу ЛПС [4]. Это логично, ведь ни в одном, ни в другом случае нет специальной защиты в виде ГЭБ. В то же время, чтобы вызвать иммунную реакцию в паренхиме мозга, схожую с той, что происходит в коже, необходима доза в 100 раз больше, чем «кожная». При этом происходит компартментализация иммунного ответа — поражается преимущественно белое вещество (отростки нейронов), а не серое (их тела). Этот опыт указывает на еще одно объяснение иммунной привилегии — слабость собственного, «внутреннего» иммунного ответа нашего мозга. Паренхима мозга оказывается крайне пассивной в отношении бактериального вторжения: мозг как будто не хочет замечать чужеродные компоненты внутри себя. Дальше мы попробуем разобраться, в чем причина этой иммунной «невнимательности».
Слабое звено
Если мы говорим о слабости местного иммунного ответа, то необходимо разобраться, что «сломано» в нем. Это может быть нарушенное распознавание при нормальной способности иммунных клеток атаковать антигены (слабость афферентного звена). Другой вариант: нормальное распознавание антигена при нарушенной способности к его атаке (слабость эфферентного звена). Как показали исследования, эфферентная часть в мозге сохранена и работает нормально [2]. Тогда усилия сосредоточили на поиске нарушений в афферентном звене. Со временем стало ясно, что дело в распознавании антигена и дальнейшей работе с ним (рис. 2).
Рисунок 2. Иммунный ответ проходит в несколько этапов. Формирование реакции на антиген происходит двумя путями: в местные лимфоузлы информация об антигене доставляется в «жидком» (сами антигены) и «твердом» виде (ранее активированные клеточные элементы иммунной системы) . При иммунной реакции вне мозга работают оба пути. При реакции иммунной системы мозга на антиген до местных (шейных) лимфоузлов клеточные элементы не добираются. Это один из главных компонентов слабого иммунного ответа в мозге.
[2]
Подробнее об этих процессах можно прочитать в статье «Иммунитет: борьба с чужими и… своими» [5].
У мозга возникают сложности при доставке активированных клеток иммунитета в шейные лимфатические узлы. За работу с антигенами в головном мозге отвечают дендритные клетки. В других органах они распознают антиген, а затем предоставляют информацию о нем T- и B-лимфоцитам в лимфоузлах. При воспалении в мозге такого процесса не происходит: дендритные клетки не мигрируют в лимфоузлы и не представляют антиген. Иммунный ответ становится локальным, и дендритные клетки регулируют его в паренхиме головного мозга. Если в других органах клеточные элементы иммунитета после презентации антигена устремляются в место проникновения бактерий [6], то при развитии воспаления в паренхиме мозга этого не происходит. Мозгу приходится рассчитывать на самого себя. Подобная локальность иммунного ответа наблюдается в паренхиме, но не в хориодиных сплетениях и оболочках мозга.
Иммигранты в мозге
Если продолжить описание особого иммунного статуса мозга в нашем организме, то необходимо сказать несколько слов о микроглии. Микроглия — это основной тип клеток, отвечающих за врожденный иммунный ответ в мозге (рис. 3) [7]. Микроглия обладает фагоцитарной активностью, способна распознавать микроорганизмы и способствует развитию воспалительных реакций в паренхиме мозга, то есть ведет себя не как нейрон, а настоящая иммунная клетка [8]. Это объясняется тем, что микроглия в нашем мозге имеет гемопоэтическое происхождение [9]. Предшественники микроглии во внутриутробном периоде — это «братья» всех остальных иммунных клеток, которые оказались в центральной нервной системе. Они не утратили свои иммунные функции и начали осуществлять их местно. Получается, что клетки микроглии можно назвать эмигрантами иммунной системы.
Лечение
В большинстве случаев терапия заболевания направлена на прекращение прогрессирования утраты зрения. В малом числе случаев (при вторичном поражении, например, рассеянном склерозе, опухолях головного мозга и т.д.) можно частично или полностью восстановить утраченное зрение. Именно поэтому важнейшее значение при вторичном механизме развития уделяется лечению основного заболевания.
Для лечения используют медикаментозные средства, физиопроцедуры, лечебную гимнастику для глаз. Среди медикаментозных препаратов для лечения используются ангиопротекторы, стимуляторы репарации, метаболические и нейропротективные средства, также используются местные средства (например, капли эмоксипин). Лечебная гимнастика являются вспомогательным методом, однако в некоторых случаях может приводить к хорошим результатам. В некоторых случаях показаны различные методики лазерохирургии.
Кальциноз в период беременности
Отложение кальция во время вынашивания ребенка чаще всего диагностируется в конце третьего триместра гестационного периода. С медицинской точки зрения такой процесс допустим и связан с видоизменением плаценты.
Если кальцификация диагностируется на более ранних сроках, это может привести к преждевременному созреванию плаценты. Как правило, кальциноз у беременных связан с употреблением большого количества продуктов, богатых кальцием, инфекционными процессами и метаболическими нарушениями.
Избыток макроэлемента в организме беременной женщины также опасен, как и его недостаток. Может стать причиной травм ребенка и матери в период родоразрешения.