Паркинсонизм – это синдром, который характеризуется сочетанием гипокинезии с 1 как минимумом симптомом: тремором покоя, ригидностью и постуральной неустойчивостью. Наиболее частой формой синдрома паркинсонизма является идиопатический паркинсонизм, или болезнь Паркинсона. Неврологи различают также вторичный паркинсонизм, развитие которого связано с воздействием определённого этиологического фактора. Синдром паркинсонизма может быть одним из основных или дополнительных проявлений других дегенеративных заболеваний с поражением экстрапирамидной системы.
Неврологи Юсуповской больницы проводят дифференциальную диагностику болезни Паркинсона и синдромов паркинсонизма, используя инновационные методы исследований. Обследование пациентов проводится на новейшей, высокотехнологичной аппаратуре. Дифференциальная диагностика болезни Паркинсона и синдрома паркинсонизма достаточно сложна. Первичная болезнь Паркинсона может скрываться даже под диагнозом «остеохондроз позвоночника с корешковым синдромом», и, наоборот, эссенциальный тремор трактуют как болезнь Паркинсона.
Диагностика и лечение ранней стадии болезни Паркинсона
О.С. Левин1,2, А.В. Росинская3
1Российская медицинская академия последипломного образования; 2Центр экстрапирамидных заболеваний (Москва); 3Кабинет экстрапирамидных расстройств Приморской краевой клинической больницы №1 (Владивосток)
Болезнь Паркинсона (БП) – прогрессирующее нейродегенеративное заболевание, характеризующееся сочетанием гипокинезии с мышечной ригидностью и/или тремором покоя, а также с позднее развивающейся постуральной неустойчивостью и широким спектром немоторных нарушений, включая вегетативные, психические, диссомнические и сенсорные симптомы. В качестве основного звена патогенеза БП рассматривается формирование нейротоксических агрегатов небольшого пресинаптического белка альфа-синуклеина (основного компонента телец Леви) сопровождающееся гибелью пигментированных нейронов вентролатеральных отделов компактной части черной субстанции. Однако в последние годы установлено, что с поражением черной субстанции коррелируют лишь основные двигательные симптомы паркинсонизма, в то же время дегенеративный процесс при БП вовлекает и другие группы нейронов в различных зонах головного мозга, а также и в периферической нервной системе, что лежит в основе многочисленных немоторных проявлений болезни [1, 3].
Виды вторичного, симптоматического паркинсонизма
Различают следующие виды вторичного, симптоматического паркинсонизма:
- лекарственный. Его могут спровоцировать нейролептики, препараты лития, препараты раувольфии, ингибиторы обратного захвата серотонина, α -метилдофа, антагонисты кальция;
- токсический. Развивается в результате токсического действия органического соединения МФТП, марганца, окиси углерода, сероуглерода, цианидов, метанола, фосфорорганических соединений, нефтепродуктов;
- при объемных процессах головного мозга (злокачественная и доброкачественная опухоль, сифилитическая гумма, туберкулома в области базальных ганглиев или чёрной субстанции);
- сосудистый. Развивается при инфарктах в области базальных ганглиев, таламусе, лобных долей или среднего мозга, а также диффузном ишемическом поражении белого вещества (болезни Бинсвангера);
- постгипоксический, причиной которого является двусторонний некроз базальных ганглиев, весьма чувствительных к ишемии и гипоксии, вследствие отсутствия коллатерального кровотока;
- энцефалитический (при нейроборрелиозе, СПИДе, прогрессирующих последствиях летаргического энцефалита Экономо);
- травматический (энцефалопатия боксёров, последствия тяжёлых черепномозговых травм);
- при гидроцефалии (при обструктивной или нормотензивной внутренней или смешанной гидроцефалии).
Паркинсонизм встречается в рамках следующих дегенеративных заболеваний с поражением экстрапирамидной системы (атипичный паркинсонизм, «паркинсонизм-плюс»), это наиболее тяжёлая группа болезней, протекающая злокачественней болезни Паркинсона:
- мультисистесной атрофии, включающей в себя три разновидности: стриатонигральная дегенерация, оливопонтоцеребеллярная дегенерация, синдром Шрая-Дайджер;
- множественные системные атрофии;
- прогрессирующий надъядерный паралич (болезнь Стила-Ричардсона-Ольшевского);
- кортикобазальная дегенерация;
- болезнь диффузных телец Леви;
- болезнь Альцгеймера;
- паркинсонизм-БАС-деменция;
- болезнь Крейтцфельда-Якоба и др.;
В отдельную группу можно выделить паркинсонизм при болезнях накопления вследствие генетически-детерминированных дисметаболических расстройств:
- болезнь Фара (в мозгу накапливается кальций);
- болезнь Вильсона (накапливается медь).
Эпидемиология
По данным сплошного популяционного исследования, распространенность БП в России составляет 139 случаев на 100 000 населения, заболеваемость БП – 16 случаев на 100 000 населения в год. С увеличением возраста риск БП увеличивается, и выявляемость БП среди лиц старше 65 лет составляет уже около 1%. Большинство случаев заболевания возникают в возрасте 60–70 лет. Однако в 15% случаев БП дебютирует в возрасте до 45 лет.
Исходя из имеющихся данных и половозрастной структуры населения России, можно примерно оценить общую численность больных с БП в нашей стране в 210 тысяч, при этом ежегодно заболевание возникает примерно у 20 тысяч пациентов. Ориентировочные расчеты показывают, что, как минимум, четверть пациентов (то есть более 50 тысяч) оказываются вне сферы медицинской помощи, причем в большинстве своем это пациенты с ранней стадией заболевания [3].
Паркинсонизм с ранним началом
Паркинсонизм с ранним началом. На протяжении почти двух веков, прошедших с описания идиопатического паркинсонизма, данная проблема всегда оставалась в фокусе активного интереса со стороны специалистов из самых разных областей нейронаук. Это обусловлено высокой распространенностью заболевания, а также теснейшей взаимосвязью между успехами фундаментальных медико-биологических дисциплин (от патонейроморфологии до биохимии и молекулярной генетики) и прогрессом в разработке новых методов диагностики и лечения паркинсонизма, понимании тонких механизмов его развития. В настоящее время все случаи паркинсонизма могут быть подразделены на:
- первичный (идиопатический) паркинсонизм. К нему относятся болезнь Паркинсона и особая генетически обусловленная форма раннего паркинсонизма — так называемый ювенильный паркинсонизм;
- вторичный паркинсонизм. Данный синдром развивается в качестве одного из клинических проявлений (осложнений) ряда самостоятельных заболеваний и поражений ЦНС. Наиболее известными вариантами вторичного паркинсонизма являются сосудистый, токсический (в том числе лекарственный), посттравматический и др.;
- паркинсонизм при мультисистемных нейродегенеративных заболеваниях (так называемый паркинсонизм «плюс»). Среди заболеваний, закономерно проявляющихся синдромами паркинсонизма «плюс», следует в первую очередь назвать прогрессирующий надъядерный паралич, множественную системную атрофию, деменцию с тельцами Леви, кортико-базальную дегенерацию;
- паркинсонизм при наследственных заболеваниях ЦНС. Это весьма обширная группа самых разных по генезу заболеваний, которая включает гепатолентикулярную дегенерацию, болезнь Галлервордена-Шпатца, дофачувствительную дистонию, ригидную форму болезни Гентингтона, ряд форм липидозов, митохондриальных энцефалопатий и т.д.
Свыше 70% всех случаев синдрома паркинсонизма в популяции приходится на долю первичного паркинсонизма и, в первую очередь, болезни Паркинсона. Заболевание встречается повсеместно, его частота варьирует от 150 до 300 на 100000 населения, резко увеличиваясь с возрастом. В возрастной группе старше 60 лет данное заболевание встречается у 1-2% лиц, что делает болезнь Паркинсона вторым по распространенности нейродегенеративным заболеванием после болезни Альцгеймера.
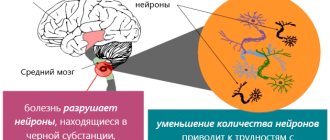
В последние годы установлено, что при постепенном, многолетнем развитии болезни Паркинсона наиболее ранние и тонкие изменения (тельца и невриты Леви) обнаруживаются в проекционных нейронах каудальных ядер мозгового ствола, и лишь затем процесс закономерно распространяется на вышележащие отделы мозга. Тем не менее основные симптомы заболевания (тремор покоя, брадикинезия, мышечная ригидность, постуральные нарушения и др.) являются результатом гибели крупных дофамин-продуцирующих нейронов в компактной части черной субстанции среднего мозга, нарушения нигростриарных и других связей и недостаточности дофаминергической трансмиссии в базальных ганглиях. Благодаря механизмам нейропластичности симптоматика появляется лишь в случае гибели >70% пигментных клеток черной субстанции, что соответствует снижению уровня дофамина на 80-85%. В норме в результате процессов естественного старения организма начиная с 5-го десятилетия жизни гибнет от 4,7 до 6% клеток черной субстанции в каждое десятилетие, что и определяет возрастзависимый характер болезни Паркинсона.
В то же время в ряде случаев паркинсонизм может развиваться и в молодом возрасте. Этому аспекту проблемы всегда уделялось гораздо меньше внимания и, более того, сложившаяся многолетняя практика почти гарантированно исключала постановку диагноза «болезнь Паркинсона» при манифестация симптомов до 40 лет. Сегодня наши подходы и сама клиническая практика кардинально изменились, так что появление различных форм первичного паркинсонизма у молодых лиц стало повседневной реальностью врача-невролога.
Интересно, что для ранних случаев паркинсонизма характерны определенные особенности чувствительности к тем или иным группам противопаркинсонических препаратов, свидетельствующие о существовании отличий в патогенезе данных форм по сравнению с «классической» болезнью Паркинсона.
Ранним паркинсонизмом (паркинсонизмом с ранним началом) принято называть случаи первичного паркинсонизма, развившегося в возрасте до 45 лет. В рамках этой возрастной группы нередко выделяется самостоятельная подгруппа лиц с юношеским (ювенильным) паркинсонизмом, у которых первичный паркинсонизм манифестировал в первые два десятилетия жизни (по некоторым авторам — до 25 лет). Подавляющая часть случаев юношеского паркинсонизма связана с рецессивными мутациями недавно открытых генов паркина, DJ.1 и PINK1, продукты которых контролируют процессинг нейрональных белков и особенности окислительного метаболизма нигральных нейронов; эти случаи обозначаются как аутосомно-рецессивный ювенильный паркинсонизм.
Наконец, в молодом возрасте могут манифестировать разнообразные паркинсоновские синдромы, обусловленные некоторыми специфическими токсинами, системными метаболическими расстройствами и другими причинами. Среди токсических паркинсоновских синдромов отметим марганцевый паркинсонизм, ставший в последние годы серьезной проблемой в связи с употреблением лицами преимущественно молодого возраста суррогатных марганецсодержащих наркотических соединений, а также паркинсонизм при употреблении синтетических героинов.
Таким образом, ранний паркинсонизм является чрезвычайно гетерогенным. Далее в настоящем обзоре речь пойдет о первичном паркинсонизме у лиц молодого возраста.
Несколько последних десятилетий охарактеризовались определенной тенденцией к «омоложению» паркинсонизма. Среди причин этого указывают:
- реализацию эффекта ряда генетических факторов;
- растущую подверженность населения развитых стран неблагоприятным эколого-средовым воздействиям;
- улучшение диагностики болезни в ее начальных стадиях, связанное с общим технологическим прогрессом в клинической медицине.
Все эти факторы заслуживают детального рассмотрения.
Возможность развития «истинной» болезни Паркинсона в молодом возрасте подтверждается обнаружением на секции типичной «Леви-патологии» (в том числе с использованием иммуногистохимической окраски на a-синуклеин) в соответствующих отделах головного мозга у лиц, у которых симптоматика асимметричного леводопачувствительного паркинсонизма впервые появилась на 4-5-м десятилетии жизни. Эти случаи ранней болезни Паркинсона могут носить как спорадический, так и семейный характер. Раннее начало болезни Паркинсона принято связывать, в первую очередь, с генетическими факторами, многие из которых раскрыты и достаточно хорошо изучены благодаря интенсивному прогрессу последних лет в области молекулярной генетики. Показана ассоциация болезни Паркинсона с рядом полиморфизмов в генах детоксикации ксенобиотиков, системы антиоксидантной защиты клетки, транспорта и метаболизма дофамина, липидного обмена, митохондриального цикла. Гены предрасположенности к болезни Паркинсона представлены ниже:
Гены систем клеточной детоксикации и антиоксидантной защиты
- параоксоназа-1
- убиквитин-С-концевая гидролаза L1
- цитохром Р450 (CYP2D6)
- N-ацетилтрансфераза-2
- семейство ферментов глутатин-трансферазы гемоксигеназа-1
- ферменты a-кетоглутарат-дегидрогеназного комплекса
- супероксид-дисмутаза
Гены транспорта и метаболизма дофамина
- моноаминоксидазы А и B
- катехол-О-метилтрансфераза
- тирозингидроксилаза
- транспортеры дофамина
- дофаминовые рецепторы D2, D3, D4 и D5
Митохондриальный геном
- тРНКГлу
- митохондриальная ДНК (отдельные полиморфизмы)
- комплекс I электронной дыхательной цепи
Другие гены
- NO-синтазы (nNOS, iNOS)
- аполипопротеин Е
- нейротрофические факторы
Носительство неблагоприятных аллельных вариантов данных генов достоверно повышает риск заболевания, т.е. формирует генетическую предрасположенность к болезни Паркинсона, которую можно оценить количественно — например, путем стандартного расчета соотношения шансов (показатель OR). Нами и другими исследователями установлено, что выявленные ассоциации (как и семейная кластеризация болезни) значительно выше в группе паркинсонизма молодого возраста. Более того, комбинация нескольких неблагоприятных полиморфизмов усиливает предрасположенность к болезни Паркинсона и ведет к более ранней манифестации симптомов (аддитивный эффект «генов риска»). Таким образом, соотношение генетических и средовых факторов в развития болезни Паркинсона неодинаково в различных возрастных группах больных: в молодой группе пациентов наиболее значим удельный вес генетической составляющей, тогда как у пожилых пациентов роль генетики становится менее четкой, и на первый план выходят средовые и иные факторы.
Говоря о генетическом грузе, нельзя забывать и о накоплении мутаций митохондриальной ДНК, скорость которого в современных условиях может быть более высокой, а последствия в виде нарушения энергообеспечения нейронов — более драматичными и ранними. Отметим в этой связи, что более чем у половины лиц с болезнью Паркинсона отмечается снижение активности комплекса I митохондрий в различных тканях, в том числе в мозге.
Известным модификатором возраста начала болезни Паркинсона и ряда других нейродегенеративных заболеваний является генетический полиморфизм аполипопротеина Е (ароЕ) — белка, имеющего отношение к репарации клеточных мембран и мобилизации «строительного» холестерина. Как в нашей работе, так и в ряде работ зарубежных авторов было установлено, что наличие аллеля ароЕ-e4 способствует более раннему началу болезни Паркинсона.
В наибольшей степени этот эффект проявляется при гомозиготности по данному варианту ароЕ (генотип e4/e4): в таких случаях, согласно нашим наблюдениям, возраст начала болезни составил 35-37 лет.
По разным данным, от 5 до 10% всех случаев болезни Паркинсона имеют не мультифакторную, а моногенную природу, представляя собой заболевания с аутосомно.доминантным наследованием. Они обусловлены передачей в поколениях патогенетически значимых мутаций в генах a-синуклеина, UCH.L1, LRRK2 и некоторых других. Последний, совсем недавно открытый ген (LRRK2) имеет особое значение, поскольку он может обусловливать до 1% всех случаев болезни Паркинсона в популяции — в том числе (поскольку пенетрантность гена не превышает 70%) при отсутствии четкого семейного анамнеза.
Можно заключить, что в общем ряду случаев «обычной» спорадической болезни Паркинсона нередко «маскируются» те или иные наследственные формы, что подчеркивает гетерогенность данной патологии. Для наследственных случаев болезни Паркинсона характерно относительно раннее появление симптомов: так, в серии на ших случаев заболевание у носителей мутации в гене LRRK2 могло проявиться уже в 39 лет, описаны и более ранние варианты LRRK2.формы болезни Паркинсона.
В ряду факторов, способствующих развитию болезни Паркинсона, большое значение придается подверженности населения развитых стран мира неблагоприятным эколого.средовым воздействиям и, в первую очередь, потенциальным нейротоксинам. Наиболее вероятными кандидатами на роль экзогенных «каузативных» токсинов при болезни Паркинсона являются некоторые пестициды: показано, что в условиях in vitro пестициды способны провоцировать конформационные изменения молекулы a-синуклеина (это ключевой этап патогенеза болезни Паркинсона) и ускорять формирование патологических включений в нейронах. Хроническое системное воздействие пестицидов воспроизводит в эксперименте клинические характеристики болезни Паркинсона. Эпидемиологические исследования подтверждают эти заключения. Так, распространенность болезни Паркинсона в сельских популяциях среди фермеров оказалась почти в 1,4 раза выше по сравнению с городским населением, а риск болезни Паркинсона у работников плантаций — в 1,5-2 раза выше общепопуляционного, что может служить подтверждением роли в развитии заболевания пестицидов и других агентов, контакт с которыми по определению выше у работников, занятых в сельском хозяйстве. Предполагается, что агрессивное агрохимическое производство и соответствующая экологическая обстановка, характерные для ряда регионов мира, могут явиться серьезным фактором, способствующим общему росту заболеваемости болезнью Паркинсона и, при особенно неблагоприятном развитии событий, накоплению более ранних случаев болезни в определенных субпопуляциях. Вероятность манифестации раннего паркинсонизма в такой ситуации особенно возрастает у лиц — носителей неблагоприятных аллельных вариантов «предрасполагающих» генов, отвечающих в организме за процессы клеточной детоксикации (см. выше). Интересно, что ассоциации болезни Паркинсона с аллельными вариантами генов.детоксикантов (CYP2D6, GSTP1 и др.) особенно значимы именно в в группе лиц, имевших контакт с пестицидами. Этот пример наглядно иллюстрирует взаимодействие генетических и средовых факторов в развитии болезни Паркинсона.
Определенная роль в увеличении доли молодых пациентов с болезнью Паркинсона принадлежит совершенствованию методов диагностики и улучшению распознавания наиболее ранних случаев болезни (и даже «предболезни»). Отметим, во-первых, внедрение в практику понятия группа риска, к которой принадлежат, в частности, ближайшие родственники пациентов, имеющие в несколько раз более высокую вероятность развития болезни Паркинсона по сравнению с общей популяцией. Именно в этой группе лиц, хорошо осведомленных об имеющейся семейной отягощенности, становится возможным тщательный мониторинг, ориентированный на выявление максимально ранних нарушений в двигательной сфере. Во-вторых, определенное значение имела разработка новейших методов нейровизуализации (КТ и МРТ, ОФЭКТ, ПЭТ), позволяющих осуществлять более точный дифференциальный диагноз и объективизировать тонкие нарушения дофаминового обмена в базальных ганглиях. Наконец, нельзя не отметить роль разработанных международным сообществом унифицированных критериев клинической диагностики болезни Паркинсона, позволивших усовершенствовать и стандартизировать подходы к раннему выявлению и постановке диагноза данного заболевания.
На приведенном ранее рисунке в левой части спектра представлено особое генетически детерминированное заболевание — аутосомно-рецессивный ювенильный паркинсонизм (АР.ЮП), который обусловливает значительную часть случаев «молодого» паркинсонизма и характеризуется рядом своеобразных клинико-морфологических проявлений. Данное заболевание встречается практически во всех изученных популяциях мира.
Основное значение в развитии АР-ЮП имеет ген, локализованный на хромосоме 6q и кодирующий новый белок с убиквитин-лигазной функцией — паркин. Показано, что паркин является важнейшим звеном системы клеточной защиты и, в частности, непосредственно участвует в деградации a-синуклеина — классического белкового маркера болезни Паркинсона в составе характерных интранейрональных включений (телец Леви).
Морфологическая картина АР.ЮП характеризуется гибелью нейронов и глиозом в компактной части черной субстанции и голубоватом пятне, отличаясь от «классической» болезни Паркинсона отсутствием телец Леви в дегенерирующих нейронах.
Дебют симптомов АР-ЮП чаще всего приходится на 2-3.е десятилетие жизни, первым проявлением заболевания может быть постепенно развивающийся синдром паркинсонизма либо дистония стоп. Для синдрома паркинсонизма в развернутой стадии АР.ЮП типично сочетание брадикинезии, мышечной ригидности, постуральных нарушений с пирамидными симптомами, а также нередкое отсутствие стадии гемипаркинсонизма.
Особенностью тремора при АР-ЮП является его статокинетический характер, который может сочетаться с типичным паркинсоновским тремором покоя. Проявления дистонии при АР-ЮП, появившись у ряда пациентов в дебюте болезни, могут сохраняться на протяжении многих лет. Важной особенностью болезни, имеющей существенное дифференциально-диагностическое значение, является весьма раннее появление разнообразных и нередко сложных по своей структуре леводопа-индуцированных дискинезий, которые могут возникнуть уже при приеме чрезвычайно низких доз препарата (30-70 мг леводопы). Еще одной отличительной чертой АР-ЮП, отмечаемой у большинства больных, является наличие флуктуаций в выраженности симптомов паркинсонизма и дистонии на протяжении дня: наилучшее состояние отмечается утром или после дневного сна, а к вечеру тяжесть клинических проявлений нарастает. Это сближает клинику АР-ЮП с проявлениями дофачувствительной торсионной дистонии.
Гомозиготные мутации гена паркина при первичном паркинсонизме с началом болезни до 20 лет выявляются более чем в 70% семейных и в 15% спорадических случаев. Заметно реже при АР-ЮП выявляются гомозиготные мутации в генах PINK1 и DJ-1. Изредка у гомозиготных носителей мутаций гена паркина описывается начало болезни в более позднем возрасте (вплоть до 6-го десятилетия жизни!), и такие случаи могут быть неотличимы от «классической» болезни Паркинсона [30]. Это демонстрирует определенную условность термина «ювенильный паркинсонизм» применительно к паркин-ассоциированным формам патологии (для обозначения этих синдромов более адекватным представляется получающий всё большее признание термин «паркинопатии»).
Совсем недавно появились основания предполагать, что гетерозиготное носительство мутации в гене паркине иногда достаточно для развития доминантной формы паркинсонизма — наиболее вероятно, в результате падения ниже критического «порога» лигазной активности белкового продукта гена (механизм гаплонедостаточности). Прижизненное ПЭТ-исследование показало отчетливое снижение захвата флюородопы в стриатуме у лиц, имеющих мутантный и нормальный аллель паркина, что является четким нейровизуализационным свидетельством дофаминергической дисфункции у гетерозигот.
С учетом этих данных нами был проведен поиск структурных перестроек в гене паркине у 107 пациентов с ранним паркинсонизмом (возраст начала до 45 лет). При этом мутации паркина были выявлены у 13,1% больных (14 пациентов), в том числе в 12 случаях из 14 — гетерозиготные делеции и дупликации. Аналогичные данные получены и другими исследователями.
Таким образом, гаплонедостаточность по паркину действительно может определять гибель дофаминовых нейронов и служить значимым фактором риска первичного паркинсонизма в молодом возрасте. Подчеркнем, что заболевание у гетерозиготных носителей паркин.мутаций отличается от АР-ЮП по своим генетическим и клиническим характеристикам, являясь самостоятельным и пока еще мало изученным вариантом паркин-ассоциированного паркинсонизма.
Раннее начало первичного паркинсонизма предъявляет повышенные требования к рационализации назначаемой терапии, поскольку такая терапия должна быть ориентирована на длительную перспективу, в идеале — на десятилетия вперед.
Большинство исследователей предпочитает начинать лечение раннего паркинсонизма с агонистов дофаминовых рецепторов (АДР). Целесообразность их использования в данной группе пациентов обусловлена лучшей переносимостью АДР у молодых по сравнению с пожилыми больными, а также необходимостью принимать во внимание возможность быстрого появления выраженных дискинезий у молодых пациентов в случае назначение леводопы (это наиболее типично для различных вариантов ювенильного паркинсонизма). Кроме того, именно для пациентов молодого возраста в начальной стадии болезни важен оказываемый препаратами из группы АДР нейропротекторный эффект (подтвержденный в эксперименте и в некоторых клиниконейровизуализационных исследованиях), что позволяет в определенной степени пролонгировать течение болезни. АДР-опосредованную нейропротекцию связывают с уменьшением синаптического кругооборота дофамина, стимуляцией D1-рецепторов, синтезом белков с антиоксидантными свойствами, стимуляцией аутотрофической активности нейронов, уменьшением секреции эксайтотоксина глутамата.
При необходимости у пациентов молодого возраста АДР можно комбинировать с ингибиторами МАО-В, а также амантадинами (мидантан, ПК-Мерц и др.). Последняя группа препаратов достаточно перспективна для лечения именно молодых случаев паркинсонизма, поскольку имеющиеся данные свидетельствуют о наличии у них свойств антагонистов NMDA-рецепторов глутамата; таким образом, амантадины способны реализовывать свое предполагаемое нейропротекторное действие на уровне «эксайтотоксического каскада».
В молодой возрастной группе для борьбы с тремором (весьма резистентным к терапии симптомом болезни Паркинсона) более свободно могут быть назначены центральные холинолитики, обычно не рекомендуемые у пожилых лиц в связи с большим числом общесоматических противопоказаний, опасностью нарастания когнитивных нарушений и риском развития психотических состояний на фоне атрофии мозга. Следует помнить, что у молодых больных центральные холинолитики назначаются в минимально возможной дозировке, а общая продолжительность непрерывного лечения данными препаратами не должна превышать 3-5 лет.
На определенном этапе болезни при нарастании двигательных нарушений возникает необходимость приема препаратов леводопы. Согласно современным представлениям, «опасность» леводопы с точки зрения ее неблагоприятного влияния на течение болезни Паркинсона остается недоказанной, а несвоевременное (чрезмерно отсроченное) назначение леводопы может нивелировать имеющийся терапевтический потенциал заместительной терапии и, тем самым, оказать негативное влияние на прогноз болезни и качество жизни. Избегая необоснованной «леводопофобии», следует помнить, что у молодых пациентов требуется особенно тщательное «титрование» разовых и суточных доз леводопы, минимизирующее проявления нередко весьма мучительных для больного дискинезий.
Контроль двигательных осложнений леводопа-терапии предполагает назначение разнообразных патогенетических и симптоматических корректоров (АДР, ингибиторы КОМТ и новый комбинированный препарат леводопы Сталево — см. далее, бензодиазепины и др.).
Согласно нашему опыту, не менее чем у половины пациентов с ювенильным паркинсонизмом применение леводопасодержащих препаратов было невозможным без их сочетания с АДР. С учетом ожидаемой продолжительности жизни и необходимости максимального отсрочивания двигательных флуктуаций, у молодых больных стратегически обоснованным представляется начало терапии леводопой с ее пролонгированных форм.
В последние годы появился ряд новых направлений лечения паркинсонизма, связанных как с функциональной нейрохирургией (высокочастотная электростимуляция базальных ганглиев), так и с оригинальными методами трансдермальной доставки противопаркинсонических средств и технологиями малоинвазивной хирургии. Заслуживает внимания так называемая концепция постоянной дофаминергической стимуляции, которая может быть реализована, в частности, посредством дозируемого введения леводопы через постоянную дуоденальную помпу; это позволяет эффективно купировать тяжелые двигательные флуктуации у пациентов в развернутой стадии болезни. Еще один подход, позволяющий пролонгировать и «физиологизировать» эффект леводопы, изящно реализован в новой и чрезвычайно перспективной лекарственной форме, представляющей собой комбинацию леводопы, карбидопы и энтакапона (препарат Сталево). Имеющийся к настоящему времени опыт показывает высокую эффективность Сталево в уменьшении выраженности двигательных флуктуаций и снижении риска развития дискинезий как в клинике, так и в эксперименте, что связывают с улучшенной фармакокинетикой леводопы (одновременное ингибирование периферической дофа-декарбоксилазы и катехол-О-метилтрансферазы). Обсуждается потенциальный протективный эффект Сталево при раннем назначении препарата.
Использование вышеуказанных и ряда других новых технологий при различных формах первичного паркинсонизма показано, в первую очередь, у молодых пациентов, имеющих меньшее число противопоказаний и неблагоприятных прогностических факторов. Это существенно расширяет имеющиеся возможности эффективной помощи людям трудоспособного возраста, страдающим ранним паркинсонизмом, что имеет не только медицинский, но и несомненный социально-экономический эффект.
Иллариошкин С.Н. Атмосфера. Нервные болезни, 3, 2006
Диагностика
Диагноз БП проводится в 2 этапа. На первом (синдромальном) этапе синдром паркинсонизма требуется отличить от других состояний, имитирующих его (таблица 1).
Таблица 1. Состояния, требующие дифференциальной диагностики с паркинсонизмом.
| При наличии тремора | В отсутствие тремора |
| Усиленный физиологический тремор Эссенциальный тремор Дистонический тремор Гепатолентикулярная дегенерации | Апатико-абулический синдром Депрессия Лобная дисбазия Плечелопаточная периартропатия Гипотиреоз Шейный остехондроз Деменция с феноменом паратонии (противодержания) Кататония |
Ключевое значение в дифференциальной диагностике имеет выявление признаков гипокинезии. Начальные симптомы гипокинезии могут характеризоваться затруднениями при письме, нажатии кнопок на пульте, чистке зубов, печатании на клавиатуре, доставании мелких предметов, например, монет из сумки или кармана, надевании тапочек и т.д. Иногда уже на ранней стадии проявляется слабость и отставание одной из ног при ходьбе с изменением привычного рисунка походки. Характерно ослабление содружественных движений рук при ходьбе (ахейрокинез), нарушение подзарядки часов («симптом ролекса»). Могут обратить внимание ослабление голоса, замедление, ослабление интонирования или нечеткость речи (особенно при быстром произнесении морфологически сложных слов). При осмотре для выявления гипокинезии пациента просят выполнить определённые движения в течение примерно 20 секунд в максимально быстром темпе и с максимальной амплитудой. При этом врачу следует обращать внимание на замедленную инициацию движения, асимметрию движений, но главное – на особую форму истощаемости движений (декремент), которые по мере повторения все более замедляются, уменьшаются по амплитуде, требуют от пациента все больших усилий. Феномен истощаемости может выявляться при всех оцениваемых движениях, но иногда отмечается только в одном из тестов. Следует учитывать, что замедленность и неловкость движений, характерные для пациентов с паркинсонизмом, на ранней стадии можно спутать с проявлениями пирамидной и мозжечковой недостаточности, а также тяжелой депрессии, однако для этих состояний не характерен декремент движений по мере их повторения. Следует учитывать, что гипокинезию бывает трудно выявить на фоне грубого тремора в конечности, однако и в этом случае важно не пропустить диагностически значимый феномен: при паркинсонизме после выполнения теста на гипокинезию пациент часто держит руку в фиксированной напряженной позе и не способен быстро расслабиться.
Ригидность мышц проявляется устойчивым (в отличие от спастичности) сопротивлением пассивным движениям в лучезапястных, локтевых, плечевых, коленных суставах, а также в шее, а субъективно – скованностью и неприятными болезненными ощущениями в конечностях. У части пациентов при проверке тонуса выявляется феномен «зубчатого колеса». Следует отличать ригидность от феномена противодержания (gegenhalten), характерного для пациентов с деменцией и поражением лобных долей. Противодержание быстро меняется в зависимости от направления и скорости пассивного движения.
Медленный (3–4 Гц) тремор покоя в одной руке или ноге – одно из частых начальных проявлений паркинсонизма. Наличие классического тремора покоя по типу «скатывания пилюль» или «счета монет» наиболее характерно для БП. Для выявления латентного тремора пациента просят совершать движения другой рукой, походить, выполнить задачу на отвлечение (например, отнимать от 100 по 7). Для выявления тремора в ноге нужно осмотреть пациента в положении сидя или лежа. Вместе с тем, в отсутствие гипокинезии тремор покоя не позволяет диагностировать ни паркинсонизм, ни БП. Следует учитывать, что, с одной стороны, в покое может наблюдаться эссенциальный и дистонический тремор, с другой стороны, при БП часто наблюдается постуральный и кинетический тремор.
Начальным проявлением БП, особенно у лиц молодого возраста, может быть дистония стопы, появляющаяся или усиливающаяся при ходьбе, значительно реже – дистония иной локализации.
Ранние немоторные нарушения. Начиная с самой ранней (продромальной) стадии заболевания пациента могут беспокоить эмоциональная угнетенность, повышенная раздражительность, быстрая утомляемость или ощущение постоянной усталости, а также такие вегетативные нарушения, как расстройства потоотделения («дефектный термостат»), например, профузное потоотделение в холодную погоду, а также склонность к запорам, учащенные и/или императивные мочеиспускания, усиленное слюнотечение в ночное время (симптом «мокрой подушки»), эректильная дисфункция. Гипоосмия часто возникает уже на премоторной стадии БП, однако редко привлекает внимание самого пациента, и для ее выявления необходимо формализованное исследование (с помощью специальных методик, например, обонятельного теста Пенсильванского университета – UPSIT). Важное диагностическое значение может иметь выявление признаков синдрома нарушения поведения во сне с быстрыми движениями глаз (тревожные сновидения, вокализации, сноговорение, движения, отражающие содержание сновидений), которые могут опережать другие проявления заболевания на многие годы. Указанные немоторные проявления могут повышать точность диагноза, основывающегося на ранних моторных симптомах болезни.
Дебютными проявлениями БП бывают также хронические болевые синдромы, чаще всего в спине и плечелопаточной области, связанные с повышенным мышечным тонусом, ограничением мобильности и постуральными нарушениями.
Уже на ранней стадии могут выявляться признаки умеренного когнитивного расстройства, в частности неустойчивость внимания и замедленность мышления, трудности поиска слов (феномен «кончика языка»).
«Красные флажки». Второй этап – этап нозологической диагностики – сводится к дифференциальной диагностике БП с другими нозологическими формами паркинсонизма. Он требует клинической оценки анамнестических данных и данных, выявляемых при неврологическом осмотре. Важное значение имеет выяснение лекарственного анамнеза. Такие препараты, как метоклопрамид, вальпроат натрия, циннаризин, амиодарон, могут быть причиной лекарственного паркинсонизма. Отмена препарата, спровоцировавшего развитие паркинсонизма, может не приводить к немедленному регрессу симптомов. Иногда после о препарата и кратковременного улучшения состояние вновь ухудшается, что указывает на скрыто развивающийся дегенеративный процесс, который был «демаскирован» побочным действием лекарственных средств.
При неврологическом осмотре могут выявляться симптомы, атипичные для БП, требующие исключения иных заболеваний, вызывающих синдром паркинсонизма. Среди них можно выделить: симметричность, быстрое прогрессирование симптоматики с ранней утратой способности к передвижению в течние 5 лет, раннее развитие постуральной неустойчивости с падениями, отсутствие стойкого положительного эффекта адекватных доз препаратов леводопы, раннее развитие вегетативной недостаточности, быстрое присоединение деменции (в течении 1-го года), ограничение подвижности глазных яблок (особенно парез взора вниз), раннее развитие тяжелых псевдобульбарных синдромов, аксиальная дистония, пирамидные и мозжечковые знаки, наличие очаговых нарушений корковых функций.
Причины
Основная причина заболевания – это отмирание нейронов в области головного мозга, которая отвечает за координированное действие мышц и мышечный тонус. Также неврологи отметили недостаток дофамина в этой области мозга, который вызывает такие симптомы, как тремор и мышечная скованность. А вот факторов риска или предпосылок довольно много. Они не обязательно напрямую приводят к развитию заболевания, но значительно повышают его вероятность.
Выявить точную причину может только врач-невролог после полноценного обследования.
Дополнительные методы исследования
В настоящий момент нет методов лабораторного или инструментального исследования, которые были бы обязательны у каждого пациента с подозрением на БП. В последние годы больным с БП часто проводят КТ или МРТ головного мозга, однако чаще всего в этом нет необходимости, и в большинстве случаев диагноз может быть установлен на основе клинических данных. Тем не менее, если клиническая картина у больного с синдромом паркинсонизма отклоняется от классического варианта, свойственного БП, в частности, отсутствует типичная реакция на дофаминергические средства, – необходимо проведение нейровизуализации.
При начале заболевания до 50 лет важно исключить гепатолентикулярную дегенерацию, о которой могут свидетельствовать роговичное кольцо Кайзера–Флейшера, низкий уровень церулоплазмина, повышение интенсивности сигнала от базальных ганглиев и мозжечка на Т2-взвешенных МРТ изображениях, повышенная экскреция меди с мочой.
Диагностическую значимость может иметь и транскраниальная сонография глубинных структур мозга, выявляющее при БП гиперэхогенные изменения в проекции черной субстанции, связанные с накоплением железа и установленные в 92% случаев клинически вероятной БП, однако его результаты можно интерпретировать лишь в клиническом контексте.
Из практически важных, но пока отсутствующих в нашей стране, методов диагностики следует упомянуть позитронно-эмиссионную томографию (ПЭТ) и однофотонную эмиссионную компьютерную томографию (ОФЭКТ), позволяющие изучить синаптическую передачу на всех уровнях, а также проводить мониторинг патологического процесса. При выявлении снижение накопления F18-флюородопы при ПЭТ и β-CIT при ОФЭКТ в полосатом теле можно говорить о вовлечении в патологический процесс пресинаптических нигростриарных терминалей (первичный паркинсонизм). Определение снижение накопления 11С-раклоприда (лиганд D2рецепторов) при ПЭТ будет указывать на уменьшение количества дофаминовых рецепторов в полосатом теле (паркинсонизм «плюс»).
Формы
Выделяют два основных типа паркинсонизма:
- Первичный
. Это болезнь Паркинсона, самостоятельное заболевание. Может быть ассоциировано с другими болезнями, но не вызвано ими. - Вторичный
. Возникает на фоне травмы, отравления, другого заболевания. Является последствием, а не причиной. Соответственно, для лечения требуется иной подход.
Выделяют несколько форм вторичного заболевания, которые классифицируют исходя из предпосылок заболевания.
- Инфекционный паркинсонизм – развивается после перенесенной инфекции. Чаще всего в роли провоцирующих заболеваний выступают энцефалиты, грипп, сифилис.
- Сосудистый – развивается в постинсультный период. Может быть вызван хроническим нарушением мозгового кровообращения.
- Токсический – последствие приема или воздействия различных токсинов. Одна из форм – лекарственная – развивается на фоне приема фармацевтических препаратов.
- Травматический – последствия травмы головы. Может возникать при регулярных травмах головы, например, у спортсменов – борцов, боксеров.
- Опухолевый – вызван опухолями головного мозга.
- Идиопатический – так называют болезни, причину которых не удалось установить достоверно. Если есть полный симптомокомплекс синдрома Паркинсона, то ставят этот диагноз, несмотря на отсутствие явной причины.
Общие принципы начала лечения
Поскольку на данный момент способность замедлять процесс дегенерации за счет нейропротективного эффекта (возможность защищать интактные клетки от повреждения) или нейрорепаративного эффекта (возможность восстанавливать активность частично поврежденных клеток) ни у одного из применяющихся средств убедительно не доказана, лечение основывается пока на симптоматическом действии. Тем не менее потенциальная возможность нейропротективного эффекта, подтверждаемая экспериментальными или клиническими данными, должна учитываться при назначении лечения.
В настоящее время широкое распространение получила концепция, подчеркивающая важность раннего назначения дофаминергической терапии – немедленно после установления диагноза – с тем, чтобы быстрее скорректировать нейрохимический дисбаланс в мозге и поддержать процессы компенсации.
Если ранее подчеркивалась необходимость возможно более длительного сохранения монотерапии, то в настоящее время преимущества такого подхода не представляются очевидными – по сравнению с ранним переходом к комбинации средств с разным механизмом действия. Вопрос о необходимости монотерапии или комбинированной терапии должен решаться индивидуально. В любом случае при выборе препаратов и их дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. В то же время следует избегать внесения в схему лечения сразу нескольких изменений (например, повышения дозы сразу нескольких средств или добавления сразу нескольких препаратов), это позволяет оценить отдельно эффективность и безопасность каждого из назначаемых средств.
Признаки и симптоматика
Как заметить болезнь Паркинсона?
Проявление болезни характеризуется стойкой утратой контролирования собственной физической активности:
- Тремор в состоянии покоя.
- Недостаточная подвижность и скованность мышц (ригидность).
- Сниженная скорость и недостаточный объём движений.
- Недостаточная способность удержания равновесия (неустойчивость).
Тремор покоя – это непроизвольные небольшие движения, которые проявляются в отсутствии двигательной активности. Наиболее распространёнными являются резкие подрагивания рук и наклонные движения головы.
Признаки, не связанные с движениями и координацией:
- Излишняя утомляемость.
- Проявления депрессии.
- Нарушения в обонянии.
- Излишнее выделение слюны.
- Повышенная потливость.
- Нарушения в метаболизме.
- Негативные изменения работы желудка и кишечника.
- Психозы и другие психологические отклонения.
- Дегенерация когнитивных функций.
Самыми заметными отклонениями в когнитивных функциях при паркинсонизме считаются:
- Проблемы с памятью.
- Заторможенность мыслительных процессов.
- Проблемы с ориентацией в пространстве.
Принципы выбора противопаркинсонического препарата
Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (таблица 2).
Таблица 2. Выбор препарата для начального лечения болезни Паркинсона.
| Препараты | Возможность использования в качестве средства первого выбора | Степень симптоматического улучшения | Нейро-протективный потенциал | Риск побочного действия | |
| Флуктуации и дискинезии | Другие побочные эффекты | ||||
| Леводопа | + | +++ | +? | ↑ | ↑ |
| Агонисты дофаминовых рецепторов | + | ++ | +? | ↓ | ↑ |
| Ингибитор МАО В | + | + | +? | ↓ | ↑ |
| Амантадин | + | + | +? | ↓ | ↑ |
| Холинолитики | — | + | — | ? | ↑ |
У лиц моложе 50 лет при легкой или умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы типа В, амантадин. При более легком двигательном дефекте может быть назначен ингибитор МАО В, при более выраженном дефекте предпочтительнее начинать с лечения с одного из агонистов дофаминовых рецепторов. Неэрголиновые агонисты (например, прамипексол, ропинирол, ротиготин или проноран) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин, каберголин). При недостаточной эффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы. Рациональна комбинация агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина, к которой следует переходить постепенно, добавляя препарат новой группы, если ранее назначенное средство не обеспечило ожидаемого эффекта.
Антихолинергические средства (например, бипериден) показаны при наличии выраженного тремора покоя либо болезненной дистонии при условии сохранности нейропсихологических функций. Их целесообразно добавлять к комбинации агониста дофаминовых рецепторов с ингибитором МАО В и/или амантадином, если она у пациента относительно молодого возраста не обеспечила подавления тремора в той степени, в которой это необходимо для поддержания его трудоспособности.
Если указанные препараты в максимально переносимых дозах и их комбинация не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат леводопы в минимальной эффективной дозе [4].
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности когнитивных функций лечение начинают с ингибитора МАО типа В (при легких симптомах паркинсонизма) или одного из агонистов дофаминовых рецепторов. В дальнейшем целесообразен постепенный переход к комбинации агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина (при условии хорошей переносимости). Больным после 60 лет антихолинергические средства, как правило, не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов. При недостаточной эффективности комбинации указанных выше препаратов добавляют препарат леводопы в минимальной эффективной дозе (200–400 мг в сутки).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и(или) возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта лечение начинают с препаратов, содержащих леводопу. Если небольшие или средние дозы леводопы (300–500 мг леводопы в сутки) не обеспечивают необходимого улучшения, к ним последовательно могут быть добавлены агонист дофаминовых рецепторов, амантадин и ингибитор МАО В.
У пожилых лиц (старше 70 лет), особенно при наличии выраженного когнитивного снижения и соматической отягощенности, лечение следует начинать с препаратов леводопы. Указанные возрастные границы относительны, и общий принцип скорее заключается в том, что чем моложе больной, тем позже следует вводить препараты леводопы. Кроме того, решающее значение играет не столько хронологический, сколько биологический возраст больных.
Что такое болезнь Паркинсона
Заболевание Паркинсона – это нейродегенеративная болезнь мозга, медленно развивающаяся в большинстве случаев. В течение многих лет симптомы этой патологии могут незаметно прогрессировать. Из-за смерти значительного количества нейронных клеток в участках базальных ганглий и деградации нервных волокон и возникает эта болезнь. Симптоматика болезни Паркинсона начинает активно проявляться при нарушениях функций 80% нейронных связей. В подобных случаях заболевание Паркинсона неизлечимо и развивается с течением времени, несмотря на всю предпринимаемую терапию.
Нейродегенеративные болезни – это группа заболеваний, которые медленно развиваются, и характерны наследственными или приобретёнными поражениями ЦНС.
Ещё одна специфическая особенность болезни Паркинсона – это резко сниженное количество дофамина. Его количество перестаёт быть достаточным для необходимого торможения нервных импульсов, истекающих от коры мозга головы. Благодаря этому нервные импульсы идут прямиком к мышечной ткани, стимулируя её напряжение. Это характерно для самых ярких проявлений болезни Паркинсона: сокращения мышц (дрожь и тремор), скованность мышечной активности, обусловленная чрезмерно высоким тонусом, проявления ненамеренных движений тела.
Применение препарата прамипексола с длительным высвобождением на ранней стадии БП
Разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их длительное высвобождение и допускающих однократный прием в течение дня, не просто делает лечение более удобным, но и, улучшая приверженность пациентов лечению, повышает долгосрочную эффективность терапии. Кроме того, при медленном высвобождении препарата в течение суток достигается более стабильная его концентрация в крови, что может обеспечить его лучшую переносимость и эффективный контроль симптомов заболевания в течение всего дня (как в дневное, так и в ночное время).
Новая лекарственная форма прамипексола с длительным (контролируемым) высвобождением, предполагающая однократный прием в течение дня, применяется в европейских странах и США с 2009 года, а в нашей стране – с 2012 года. Она представляет собой матриксную таблетку, в которой активное вещество равномерно распределено в полимерном матриксе. В желудочно-кишечном тракте матрикс впитывает жидкость и превращается в гель, который равномерно высвобождает прамипексол в течение 24 ч. Поскольку прамипексол хорошо растворяется в жидкой среде, независимо от ее pH, активное вещество высвобождается из матрикса и всасывается на протяжении всего кишечника. Скорость опорожнения желудка и моторика кишечника не оказывают существенного влияния на действие препарата. Параметры всасывания не зависят также от того, принимается препарат натощак или после еды [2].
При разработке новой лекарственной формы была учтена возможность простого, одномоментного перехода от традиционной формы препарата к новой. Условием этого является то, что равные суточные дозы препарата с немедленным высвобождением (принимаемым 3 раза в день) и длительным высвобождение (принимаемым 1 раз в день) оказывают одинаковое противопаркинсоническое действие. Различие между новой и традиционной лекарственными формами прамипексола заключается лишь в скорости высвобождения активного вещества. Период полужизни прамипексола при применении обеих форм один и тот же, но благодаря контролируемому высвобождению обеспечивается более длительное поддержание терапевтической концентрации препарата в крови [5].
Эквивалентность действия равных суточных доз препаратов прамипексола с немедленным и длительным высвобождением была подтверждена в целом ряде клинических испытаний.
Следует подчеркнуть особое удобство новой лекарственной формы прамипексола, которую достаточно принимать один раз в день, для пациентов с ранней стадией БП, продолжающих работать. Во избежание побочного действия препарат назначается путем медленного титрования – по той же схеме, что и препарат с немедленным высвобождением. Для этого таблетки прамипексола с длительным высвобождением выпускаются в нескольких дозировках: 0,375, 0,75, 1,5, 3 и 4,5 мг. Лечение начинают с дозы 0,375 мг 1 раз в день, далее при условии хорошей переносимости каждые 7 дней переходят на следующий уровень дозы до достижения оптимального эффекта, максимально до 4,5 мг/сут (таблица 3). После достижения дозы 1,5 мг/сут титрование иногда целесообразно проводить медленнее, так как развитие полного лечебного эффекта может требовать нескольких недель. Рекомендуемая доза для поддерживающей терапии (как на ранней, так и на развернутой или поздней стадиях заболевания) может колебаться от 0,375 до 4,5 мг/сут. Наиболее часто применяемая доза – 3 мг/сут.
Таблица 3. Схема титрования прамипексола с длительным высвобождением.
| Неделя | Доза |
| 1-я | 0,375 мг 1 раз в день |
| 2-я | 0,75 мг 1 раз в день |
| 3-я | 1,5 мг 1 раз в день |
| 4-я | 2,25 мг 1 раз в день |
| 5-я | 3 мг 1 раз в день |
| 6-я | 3,75 мг 1 раз в день |
| 7-я | 4,5 мг 1 раз в день |
Как лечат болезнь Паркинсона.
- На первых этапах болезни Паркинсона её лечат с применением медикаментозных средств, вводя в организм вещества, которых не хватает. Основной целью медикаментозной (химической) терапии является «чёрная субстанция». При использовании такого метода лечения, почти у всех больных заметно снижается проявления симптомов и у них появляется утерянная возможность нормально жить.
- Но бывают случаи, когда у больных не происходит улучшений, даже на протяжении длительного времени приёма препаратов и увеличения их дозировок. В таких случаях применяется операция на головном мозге, посредством которой в мозг вживляется стимулятор.
Такая операция имеет вид высокочастотных стимулирований базальных ганглиев электрическим током посредством электрода, имеющего соединение с электростимулятором:
- При использовании местного наркоза в мозг больного вводятся последовательно два электрода (по определённому заранее компьютером пути), производящих глубокую стимуляцию отделов головного мозга.
- Под анестезией вживляется в грудную область под кожу электростимулятор, соединяющийся с электродами.
Лекарственные средства, эффективность которых при БП не доказана
В клинической практике широко применяют лекарственные средства, эффективность которых при БП не доказана и которые, следовательно, не могут быть рекомендованы к применению при этом заболевании. Прежде всего, к ним относятся так называемые ноотропные, нейрометаболические и вазоактивные препараты. Возможно, некоторые из этих средств оказывают определенное лечебное действие, но прежде, чем рекомендовать конкретный препарат, следует провести адекватную оценку его эффективности. Специалисты, занимающиеся лечением БП, прекрасно знают, что определенная часть больных хорошо реагирует на плацебо, причем этот эффект оказывается нестойким. Соответственно, затраты на подобное лечение оказываются бессмысленными.
Литература
- Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. М.: МЕДпресс-информ, 1999.
- Левин О.С., Федорова Н.В., Смоленцева И.Г. Агонисты дофаминовых рецепторов в лечении болезни Паркинсона. Рус. мед. журн. 2000; 15–16: 643–646.
- Левин О.С., Федорова Н.В. Болезнь Паркинсона. М.: МЕДпресс-информ, 2011.
- Протокол ведения больных. Болезнь Паркинсона. Пробл. стандартизации в здравоохр. 2005; 3: 74–166.
- Chwieduk C.M., Curran M.P. Pramipexole extended release in Parkinson’s disease. CNS Drugs 2010; 24: 327–336.
- Grosset K.A., Bone , Grosset D.G. Suboptimal medication adherence in Parkinson’s disease. Mov. Disord. 2005; 20: 1502–1507.
- Hauser R., Salin L., Koester J. Double-blind evaluation of pramipexole extended-release (ER) in early Parkinson’s disease. Neurology 2009; 72 (11 Suppl. 3): A412–413.
- Kvernmo T., Härtter S., Bürger E. A review of the receptor-binding and pharmacokinetic properties of dopamine agonists. Clin. Therap. 2006; 28: 1065–1078.
- Mizuno Y., Yamamoto M., Kuno S. et al. Efficacy of Pramipexole Extended Release (ER) and switching from Pramipexole Immediate Release (IR) to ER in Japanese advanced Parkinson’s disease (PD) patients. In: XVIII WFN World Congress on Parkinson’s Disease and Related Disorders: Miami Beach, 2009: Poster 2.192.
- Möller J.C., Oertel W.H. Pramipexole in the treatment of Parkinson’s disease: new developments. Expert Rev. Neurother. 2005; 5: 581–586.
- Poewe W., Rascol O., Barone P. et al. Pramipexole extended-release in early Parkinson’s disease. Neurology 2011; 77: 759–766.
Использующиеся для лечения препараты:
«Амантадин» или «Мидантан». Это лекарственные вещества, которыми начинается терапия болезни Паркинсона. Этот медикаментозный препарат стимулирует выделение дофамина, способствует уменьшению его обратного захвата, блокируя глутаматные рецепторы, оказывает защиту «чёрной субстанции», а также имеет и другие положительные свойства. «Амантадин» значительно уменьшает проявления гипокинезии и ригидности (скованности и ограниченности в движениях), однако, почти не уменьшает тремор и дрожь. Эти лекарственные препараты хорошо переносятся и почти не имеют побочных эффектов.
«Ротиготин» или «Ньюпро». Это агонист группы дофаминовых рецепторов. Выпускается в виде пластыря, который накладывается на кожный покров. Такой пластырь – это трансдермальная терапевтическая система, имеющая размеры 10-40 cм², применяемая один раз за сутки. Такие медикаментозные препараты продаются исключительно по рецептам и используются для самостоятельной (без комбинирования с другими препаратами) терапии болезни Паркинсона на первых стадиях.
Применение этой формы препаратов имеет значительные преимущества: дозировка меньше, но эффективнее, а побочные действия имеют менее выраженный характер.
«Левопада». Уже давно считается одним из лучших медициских лекарств для лечения Паркинсонизма. Это соединение является химическим предвестником дофамина. Но стоит помнить, что это вещество имеет значительное количество побочных действий, таких как психологические отклонения. Назначается, как правило, в связке «карбидопой» или «бенсеразидом». Они приводят лучшему усвоению «леводопы» и достижения ей участков головного мозга и содействуют снижению проявлений побочных действий.
«Модопар». Является комбинированным лекарственным средством, содержащим в себе как «леовдопу», так и «бенсеразид». Производится в различных формах. «Мадопар ГСС» выпускается в специальных капсулах, плотность оболочки которых значительно меньше, чем у желудочного сока. Это содействует тому, что вещество медленно и равномерно поступает в организм, потому что такая капсула растворяется в желудке от 5 до 12 часов. Также выпускается «Диспергируемый Мадопар», который имеет жидкую форму, благодаря которой действует значительно быстрее. Этот вариант более приемлем для больных с ограниченной функцией глотания.
«Миралекс». Это лекарственное средство производится как таблетки, которые применяют как самостоятельное лекарство на первых стадиях болезни, так и как комбинированную с «леводопой» терапию на более позднем развитии болезни Паркинсона. «Миралекс» обладает меньшим количеством проявления побочных эффектов, чем у неселективных агонистов, но в то же время большим, чем у «амантадина». Такие побочные действия могут проявляться как тошнота, скачки давления, излишняя сонливость, изменение баланса выделяемых печенью ферментов, отёки нижних конечностей. А также возможны галлюцинации у больных, имеющих диагноз деменция.
«Ингибиторы МАО». Они значительно замедляют окисление дофамина, находящегося в «полосатом теле» отдела головного мозга, за счёт этого растёт его концентрация в синапсах. Наиболее частым применением в лечении болезни отличается «Селегилин». На первых стадиях болезни Паркинсона «Селегилин» применяется как самостоятельная терапия (без применения других комбинационных средств). Многие пациенты отмечают серьёзные улучшения при использовании этих средств. Нежелательные эффекты от применения «Селегилина» имеют редкое и слабовыраженное проявление.
Лечение «Селегилином» может отсрочить на время от 9 до 12 месяцев назначение «леподопы». На последних стадиях заболевания «Селегилин» используют как дополнение к «Леводопе», что позволяет последней увеличить свою эффективность на треть.
«Мидокалм». Этот препарат сильно снижает ненормально большой тонус тканей мышц. Это его свойство применяется при болезни Паркинсона как вспомогательное. «Мидокалм» выпускается в таблетках, для перорального применения и ампулах, для внутривенного и внутримышечного использования.
«Витамины группы В». Эта группа витаминов часто применяется для лечения заболеваний ЦНС. Чтобы L-Доф благополучно преобразовался в дофамин необходимы никотиновая кислота и витамин «В6». Также для повышения содержания дофамина в отделах мозга применяется «Тиамин» (витамин «В1»).
Лечение
Недочеты официальных терапевтических методов лечения болезни Паркинсона
К сожалению из всех вариантов лечения этого заболевания, практически нет эффективного метода лечения, а лекарственная терапия оказывает только симптоматический эффект, то есть влияя уже больше на последствия от возникшей болезни, что не может даже притормозить процессы, зато имеет ряд побочных действий, порой усугубляющих процесс. Кроме того, при длительном (годами) приеме препарата наступает к нему привыкание, в этом случае необходимо повышать дозу препарата или менять сам препарат, иначе симптомы заболевания усиливаются. Важно адекватно и точно подобрать сам препарат и правильно определить дозировку, но, к сожалению, часто терапия проходит вслепую, а для достижения лечебного результата принимается несколько медикаментов одновременно, что истощает возможности организма и снижает защитные механизмы. В результате чего утяжеляется форма и заболевание прогрессирует.
Одной из главных причин паркинсонизма, считается уменьшение (с возрастом), количества проводящих путей в ЦНС, что приводит к дисбалансу нервно-рефлектороной возбудимости, которую надо подавлять. Существующие медикаментозные препараты могут давать такое торможение, но при этом часто ухудшается общее самочувствие.
Апитерапия
Лечебные задачи при болезни Паркинсона:
- воздействие на предрасполагающие факторы;
- восполнение дофаминовой недостаточности извне;
- стимуляция собственной выработки нейромедиаторов, в частности дофамина;
- выборочное воздействие на рефлеторно-двигательные механизмы;
- посимптомное лечение;
- полноценная разносторонняя реабилитация.
Для выполнения этих задач недостаточно никакого существующего медикамента и даже группы медикаментов. Однако, изучая это заболевание более 20 лет, относящееся к группе болезней трудно поддающихся лечению существующими медикаментозными методами,мы вышли на вещество, способное охватить всё вышеперечисленное — это ЯД ПЧЁЛ, точнее состовляющие яда-АПИТОКСИНЫ и на их основе разработать программу «АПИТОКС»
Лечебно-реабилитационная апитоксинотерапия при болезни Паркинсона, в рамках программы «АПИТОКС».
Итак, для получения результатов в лечении этого заболевания, нужен комплексный и продуманный подход с грамотным определением целей:
- Создание адекватного уровня дофаминергической активности;
- Улучшение питания тканей головного мозга;
- Коррекция неврологической симптоматики и двигательной активности;
- Стабилизация психоэмоционального фона.
Для достижения этих целей важны правильно-выстроенные задачи:
- Уменьшение или остановка прогрессирования заболевания;
- Достижение положительного результата за счет повышения выработки ДОФА и катехоламинов (дофамина, адреналина, норадреналина);
- Посимптомное лечение;
- Двигательная реабилитация;
- Психо-эмоциональная реабилитация;
- Улучшение качества жизни.
Улучшение состояния и уменьшение симптомов заболевания регистрируется практически у всех пациентов,причём лучше поддающиеся апитоксинотерапии, оказались формы с мышечной ригидностью.
Положительная динамика достигалась не только в клинической картине на данный момент времени, но и в последующем, за счет того, что пчелиный яд способен воздействовать на все структурные составляющие болезни Паркинсона (причинные факторы и механизмы формирования).
Восполнение недостающего дофамина достигается за счёт непосредственного содержания данного нейромедиатора в пчелином яде.Также составляющие пчелинного яда способствуют высвобождению биогенных аминов: допамина, серотонина и др.,что нормализует концентрацию дофамина.
При атеросклеротических изменениях сосудов, в сочетании с артериальной гипертензией и дисциркуляторной энцефалопатей, компоненты пчелиного яда за счет, прежде всего, его компонента кардиопепа оказывают сосудорасширяющий эффект и способствуют накоплению простагландинов в соединительной ткани. В свою очередь- мелиттин, входящий в состав яда, обладает сильным кроворазжижающим свойством, а также растворяет тромбы. Все это способствует значительному улучшению мозгового кровообращения и артериального давления. Наряду с вышеперечисленными эффектами, «работая» через БАТ, пчелиный яд нормализует прохождение нервного импульса по нервным отросткам, а также восстанавливает трофические процессы за счет содержания 18 незаменимых аминокислот.
Получение лечебного эффекта при БП, возможно независимо от симптоматики заболевания и длительности течение заболевания. Это происходит за счет воздействия апитоксинов на все структурные составляющие и развёрнутости лечебной программы «АПИТОКС», в которой принимает участие большая группа специалистов с разной специализацией, но работающие все под единым контролем.
Признаки
Клинически значимые признаки заболевания:
- уменьшение двигательной активности — гипокинезия;
- снижение эластичности мышц — ригидность;
- тремор (дрожание);
- нарушение равновесия — постуральные расстройства.
1. Гипокинезия (брадикинезия) объединяет в себе уменьшение и замедление двигательной активности человека. Пациентами симптом этой болезни ощущается чувством слабости и повышенной утомляемостью, а со стороны заметнее всего это значительное снижение мимики, уменьшение жестикуляции в беседе. Наибольшую трудность для пациента с этой болезнью дается начальный период двигательного акта, а также скоординированные сложные движения. Ходьба у пациента маленькими шажочками, ноги при этом ставятся ровно, близко друг другу. Эта походка называется «кукольной». Характерна особенная осанка для болезни Паркинсона в виде сгорбленности, наклоном туловища и головы вперёд, руки приведены к телу, согнуты в локтевых суставах под углом 90, ноги полусогнуты. При прогрессировании этой болезни пациенты обращают внимание на усиление этого состояния к вечеру, что проявляется выраженной скованностью движений ночью, вследствие чего невозможно поменять положение тела во время сна. Утром больному проблематично подняться с кровати без посторонней вмешательства.
Снижение движений более выражено в теле, нижних и верхних коенчностях, мимических мышцах лица. Речь у них маловыразительна, монотонна.
2. Ригидность — это состояние, сопровождающееся напряжением мышц, особенно в конечностях. При обследовании человека с болезнью Паркинсона выявляется особенный для этого состояния симптом «зубчатого колеса». Он проявляется сопротивлением мышц при постороннем сгибании рук и ног. Усиление тонуса мышц спины и грудной клетки — это еще одно симптоматическое состояние больного, так называемая поза «просителя» — значительная сутулость в грудном отделе позвоночника с наклоном туловища вперед. Напряжение мышц может сопровождать интенсивной болью и иногда именно это и заставляет обратиться пациента впервые за медицинской помощью. Иногда эти болевые ощущения неправильно диагностируются и могут маскироваться под симптомы ревматизма, из-за этого иногда выставляется неверный диагноз.
3. Дрожание или тремор — необязательный признак болезни Паркинсона. Вообще мелкоразмашистая дрожь при этом состоянии особенная и отличается от дрожи при других заболеваниях. Он возникает в покое и проявляется только в одной кисти, при усилении заболевания появляется и на соседней руке и на ногах. Механизм его образования это ритмическое сокращение мышечных волокон противоположного друг другу действия с периодичностью 5 колебаний в минуту.
Специфические противоположные по действию движения первого и других пальцев кистей напоминают движения кистями при счёте монет. Это симптом называется «скатывание пилюль» или «счет монет». Редко, но прослеживается мелкоразмашистая дрожь головы вперед – назад — «да-да» или в стороны «нет-нет», подрагивание век, языка, нижней челюсти. Особенностью этого варианта дрожания является то, что он увеличивается при беспокойстве и исчезает в процессе сна и самопроизвольных движений. Это главные отличительные черты тремора при болезни Паркинсона — снижение или исчезновение его при целенаправленном движении.
Очень похож с паркинсоническим дрожанием по клинике — тремор эссенциальный, но его отличительной чертой является его постоянство даже при целенаправленных движениях.
4. Постуральная неустойчивость — это своеобразная неуклюжесть в ходьбе из-за трудностей преодоления (затруднения начать ходьбу и ее закончить). Она на сегодняшний момент является обязательным симптомом этого заболевания, как тремор, ригидность и гипокинезия. Эти рефлексы отвечают за процесс стояния, начала и окончания ходьбы. Это неосознаваемые рефлекторные движения. При болезни Паркинсона происходит дискоординация этих рефлекторных актов, вследствие чего тело человека в процессе движения опережает ноги и происходит как бы проталкивание тела вперед ног.
Именно из-за этих нарушений рефлексов «устойчивости» и объясняются нередкие падения пациетов с болезнью Паркинсона.
Симптомы
Из симптомов болезни Паркинсона следует отметить:
- Нарушение работы вегетативной нервной системы – усиленное слюноотделение, состояние повышенной жирности кожи лица и волос, перхоть волосиситой части головы, повышенное потоотделение или наоборот сухость кожи, затруднение мочеиспускания, запоры, снижение полового влечения.
- Изменение психического состояния (появляются незаетно). Вначале появляются изменения, касающиеся отельных жизненных направлений, проявляется усилением некоторых черт характера: у пациента появляется мелочность, скрупулезность, чрезмерная дотошность, трудность в переключении с одной темы разговора на другую, становится ворчливым, конфликтным. Появляются необоснованные колебания настроения, снижается интерес к жизни, появляется прилипчивость (акайрия), замедленность и ригидность мышления. Пациент замыкается в себе, стремится ограничить себя в общении с другими людьми, порой проявляется озлобленность. Болезнь Паркинсона ухудшает качество жизни, отмечается эмоционально-волевое снижение, может отвечать за возникновение депрессии. Существенно снижается память. Умственные способности с течением времени усиливаются и формируется деменция. Еще одним неблагоприятным фактором является то, что медикаментозные препараты, используемые в лечении болезни Паркинсона, провоцируют возникновение психических расстройств таких, как галлюцинации, психозы.
- Изменение процесса сна – появляются сложности с засыпанием, чувство «отсутствия сна», поверхностный сон с частыми пробуждениями. Частично причиной возникновения этих нарушений являются симптомы болезненного состояния: скованность движений не позволяет поменять положение тела в постели.
- Симптомы чувствительных изменений: гиперестезии, локльные боли, онемение отдельных зон, чувство ползания мурашек, синдром «беспокойных ног» и т.д.
Классификация, которая оценивает двигательную активность пациента и способность к самостоятельному обслуживанию предложена в 1967 году Хеном и Яром:
- 0 стадия – отклонений движений нет.
- 1 стадия – нарушение двигательной функции только с одной стороны.
- 2 стадия – нарушение двигательной функции с двухсторон, но без отклонений в постуральных рефлексах.
- 3 стадия – средней степени отклонения постуральных рефлексов, но может себя обслуживать самотоятельно.
- 4 стадия – существенные затруднения движений, но передвижение без посторонней помощи.
- 5 стадия – значительные двигательные нарушения требующие дополнительного ухода за пациентом.
Кроме того разделяют болезнь Паркинсона по времени ее возникновения:
- Ювенильная форма — дебют в возрасте 13-14 лет.
- Ранняя форма — дебют в возрасте от 20 до 40 лет.
- Форма с поздним началом — после 50 лет.
Существуют следующие формы болезни Паркинсона:
- Форма дрожательно-ригидная. Для нее основным характерным признаком является тремор. Выявляется у 37% заболевших.
- Форма акинетико-ригидная. Отличительный признак этого состояния – скованность мышц, малоподвижность. Тремор либо отсутствует, либо проявляется незначительно в волнительных ситуациях. Провляется в 33 % случаев болезни.
- Форма ригидно-дрожательная. Разновидность патологического состояния – медлительность и чрезмерное напряжение мышц. Встречается в 21% заболевших.
- Форма дрожательная. С самого начала заболевание проявляется тремором, этот симптом и остается главным. Остальные проявления болезни Паркинсона: тонус мышц не повышен, медлительность и амимичность выражены слабо. Данная форма составляет только 7% от всех форм.
- Форма акинетическая. Для состояния главный признак снижение или практически отсутствие самопроизволных движений. Этот вид встречается только у 2% заболевших.
Акинетическая форма болезни проявляется высокой степенью снижения движений со значительным снижением общей двигательной активности и жестикуляционных движений. Мимика обедняется, она становится более медленная и маловыразительная, а в тяжелых случаях лицо «застывает», становится гипомимичным. У пациентов с болезнью Паркинсона отмечается урежение мигания — синдром Мари. Медлительность прослеживается даже в речи, она становится менее эмоционально окрашенная, приглушенная. В процессе ходьбы наблюдается такое явление, как ахейрокинез — отсутствие содружественных движений рук. Походка у таких пациентов мелкими шажками с наклоном туловища вперед и как бы еще в начале ходьбы пробегая немного – явление пропульсии.
При акинетикоригидной форме болезни вместе с урежением движений выявляется значительная ригидность мышц. Вместе с повышенным мышечным напряжением (гипертонией) определяется специфический признак – «зубчатое колесо» – прерывистое сопротивление пассивному сгибанию и разгибанию рук и ног. Мышечная ригидность выявляется либо во всех группах мышц конечностей и тела, либо носит локальный характер, затрагивая отдельные конечности. Значительная ригидность мышц у человека, больного болезнью Паркинсона проявляется в «позе просителя»: корпус наклонен вперед, голова опущена вниз, подбородок приведен к грудной клетке, руки прижаты к туловищу, полусогнуты в локтях, кисти рук сжаты.
Ригидно-дрожательная форма болезни объединяет в клинической картине ригидность и дрожательный гиперкинез. Тремор характеризуется мелкоритмичностью, особенно в покое (тремор покоя), больше в руках, не обнаруживается при целенаправленных движениях. При паркинсонической дрожи характерны однообразные движения в виде приведения большого пальца кисти, как будто катания пилюль. В других случаях тремор переходит на группы мышцы шеи и головы. Но все таки базовым симптомом дрожательной формы паркинсонизма является дрожательный гиперкинез, а акинезия и ригидность мышц выражены слабее.