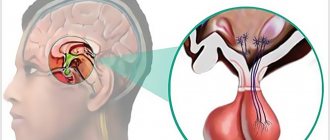
Гипоталамо-гипофизарная система определяет функциональное состояние всей эндокринной системы. Анатомическая и функциональная взаимосвязь гипоталамуса и гипофиза обеспечивает также единение нервной и эндокринной систем.
Гипоталамус (подбугорье) занимает часть промежуточного мозга. Как вегетативный центр, гипоталамус координирует функцию различных систем и органов, регулирует функцию желез внутренней секреции (гипофиза, яичников, щитовидной железы и надпочечников), обмена веществ (белкового, жирового, углеводного, минерального и водного), температурного баланса и деятельности всех систем организма (вегетососудистой, пищеварительной, выделительной, дыхательной и др.).
Эта многогранная функция гипоталамуса обеспечивается нейрогормонами, поступающими в него через портальную систему сосудов после высвобождения из окончаний гипоталамических нервных волокон.
Щитовидная железа и ее гормоны
Щитовидная железа и ее гормоны совместно с нервной и иммунной системами принимает участие в координации и регуляции работы всех органов человека (сердца, головного мозга, почек и т.д.). В согласованном «оркестре» сигналов, нервных импульсов и биологических веществ гормоны щитовидной железы выполняют голь «главной скрипки».
Причина особой важности именно гормонов щитовидной железы для организма состоит в том, что они нужны всем тканям и каждой клеточке. Проще говоря, без них невозможно существование.
Роль щитовидной железы настолько существенна, что её изучение выделено в отдельную дисциплину —тиреоидологию, а после аварии на Чернобыльской АЭС и Фукусиме она находится под пристальным вниманием.
Проблема нарушения баланса гормонов щитовидной железы известна многие века. Древнеримские врачи первыми обратили внимание на увеличение ее размеров в подростковом возрасте и при беременности. До нашей эры в Китае уже знали, как предупредить появление зоба — увеличения железы, употреблением морской капусты. Округлая и отечная шея в эпоху Возрождения была признаком женской привлекательности, что подчеркивали на своих картинах Рембрандт, Дюрер, Ван Дейк. Нервный и возбудимый нрав, как результат избытка тиреоидных гормонов были в моде в XVII веке в Испании. Спокойная и грациозная медлительность ценилась аристократами Швейцарии, но они не подозревали, что причина этого в дефиците йода, необходимого щитовидной железе.
Заболевания гипоталамо-гипофизарной системы
Симптомы, диагностика, терапия и профилактика заболеваний гипоталамо-гипофизарной системы в клинике Диадент
Широта методов диагностики, тщательно подобранное лечение. Запишитесь на прием в клинику.
беспл.консультация
Скидка 500 ₽!
При записи на лечение к специалистам Группы клиник Диадент в «горящие» окна текущего дня (не распространяется на консультации). Список «горящих» окон уточняйте у администраторов.
стоимость услуг эндокринологии
Консультация
- 1 500 р. Консультация врача эндокринолога первичная
- 1 500 р. Консультация врача эндокринолога повторная
Анализы и диагностика
- 1 500 р. Проведение теста толерантности к глюкозе
- 1 600 р. УЗИ щитовидной железы и паращитовидных желёз
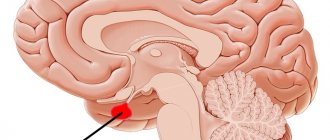
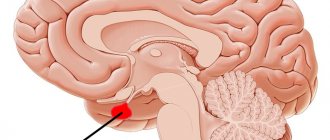
Гипоталамо-гипофизарной системой называют комплекс структур, состоящий из двух отделов и их соединения. Компонентами данной системы являются гипофиз, гипоталамус и ножка.
Гипофиз представляет собой располагающийся в области турецкого седла нижний мозговой придаток, являющийся центральным органов эндокринной системы человеческого организма.
Гипоталамус, расположенный выше гипофиза и ниже таламуса, представляет собой часть отдела промежуточного мозга, несущую ответственность за работу вегетативной функции. Ножка, или подъём, представляет собой зону, соединяющую гипоталамус с гипофизом.
Гипоталамо-гипофизарная система связывает нервную и эндокринную системы организма между собой, осуществляя регулировку синтеза гормонов, без которых невозможна корректная работа многих органов. Каждый из отделов, входящих в комплекс системы, вырабатывает особый тип гормонов, которые оказывают непосредственное влияние на деятельность органов и систем.
За что отвечают гормоны гипофиза и гипоталамуса?
Гормоны гипофиза и гипоталамуса тесно взаимодействуют между собой. Именно от их взаимодействия зависят такие функции нашего организма, как:
- чувство голода и чувство насыщения;
- чувство жажды;
- естественная терморегуляция;
- поддержание циркадного ритма сна и бодрствования;
- ощущение потребности в продолжение рода;
- проявление агрессии;
- способность испытывать различные эмоции.
Гормоны гипоталамо-гипофизарной системы
Основная функция гипофиза – выработка гормонов, участвующих в регуляции деятельности периферических эндокринных желез. Эти гормоны несут ответственность за репродуктивные функции, рост тканей, обменные процессы в организме, обеспечивают нормальное функционирование щитовидной железы.
Гипоталамус вырабатывает рилизинг-гормоны, либерины и статины, осуществляющие поддержку работы надпочечников, щитовидной и поджелудочной желез и половой системы, а также участвующих в процессах регуляции температуры тела и поддержке нормальной работы внутренних органов.
Любые нарушения в работе гипоталамо-гипофизарной системы могут обернуться крайне негативными последствиями, вплоть до летального исхода. К сожалению, довольно часто патологии этой системы развиваются скрыто, проявляясь лишь в виде сопутствующих заболеваний, который, на первый взгляд, не имеют отношения к работе эндокринной и нервной систем.
Узнайте стоимость лечения на бесплатной консультации по телефону +7 (812) 40-000-60
ваша выгода лечения у нас
- Любые способы оплаты Мы предлагаем Вам множество способов оплаты услуг клиники для физических и юридических лиц: наличным и безналичным расчётом, картой или с помощью сертификата.
- Нет очередей
Записывайтесь на прием, и он пройдет в точно назначенное время. - Полная безопасность процедур
В Диадент разработана совершенная система безопасности, которая сводит риск заболеваний (защита от ВИЧ, гепатита и других болезней) к нулю.
Диагностика и лечение заболеваний гипоталамо-гипофизарной системы
Комплексное обследование может включать в себя:
- анализ анамнеза;
- визуальный осмотр;
- МРТ;
- КТ;
- рентгенографию турецкого седла;
- пункцию спинного мозга;
- анализы крови на гормоны – гипофиза и гипоталамуса, надпочечников, щитовидной железы и половые.
Только получив точные данные о состоянии всей системы в целом и каждого из её компонентов в отдельности, врач-эндокринолог может безошибочно поставить диагноз и назначить соответствующее лечение, которое позволит нормализовать работу гипофиза, гипоталамуса и всего организма.
Для оценки функционирования системы, производится анализ крови на комплекс гормонов, участвующих в функциональной связи её элементов. При подозрении на развитие гормонально-неактивных аденом применяется анализ сыворотки крови на концентрацию хромогранинов.
Лечение заболеваний гипоталамо-гипофизарной системы строго индивидуально, напрямую зависит от поставленного диагноза и сопутствующих факторов, таких, как степень и тяжесть заболевания, наличие аллергических реакций, непереносимость определённых медикаментов, пол и возраст пациента и т.д.
При этом важно помнить, что чем раньше начато лечение, тем более низкой будет вероятность развития серьёзных осложнений, зачастую представляющих серьёзную угрозу для жизни пациента.
Узнайте стоимость лечения на бесплатной консультации по телефону +7 (812) 40-000-60
Где находится клиника Диадент
Многопрофильная клиника
г. Санкт-Петербург, Бухарестская ул. д.110, корп 1
Телефон: + 7 (812) 40-000-60
Для оценки функционирования системы, производится анализ крови на комплекс гормонов, участвующих в функциональной связи её элементов. При подозрении на развитие гормонально-неактивных аденом применяется анализ сыворотки крови на концентрацию хромогранинов.
Лечение заболеваний гипоталамо-гипофизарной системы строго индивидуально, напрямую зависит от поставленного диагноза и сопутствующих факторов, таких, как степень и тяжесть заболевания, наличие аллергических реакций, непереносимость определённых медикаментов, пол и возраст пациента и т.д. При этом важно помнить, что чем раньше начато лечение, тем более низкой будет вероятность развития серьёзных осложнений, зачастую представляющих серьёзную угрозу для жизни пациента.
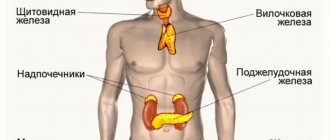
Строение щитовидной железы
Щитовидная железа расположена на передней поверхности шеи, чуть ниже адамова яблока. Впервые описал железу, как отдельный орган, древнеримский врач Гален, а название она получила намного позже в XVII веке. Имя железы происходит от греческих слов «тиреос» — щит и «идос» — вид, т.е. орган имеющий вид щита. Международное название этого органа внутренней секреции – тиреоидная железа. По форме щитовидная железа напоминает бабочку или подкову, в ней выделяют три основные части – две боковые доли и перешеек. У каждого третьего есть еще одна непостоянная долька – пирамидальная.
Размеры железы могут значительно варьировать даже у одного и того же человека в зависимости от активности ее функционирования. Пол, возраст, климат, прием лекарственных препаратов и, конечно же, характер питания во многом влияют на размеры и количество гормонов железы. Из-за плотного соединения с гортанью положение её может изменяться, она поднимается и опускается при глотании, смещается в бок при повороте головы в разные стороны, что видно невооруженным взглядом
Строение щитовидной железы довольно сложное. Под микроскопом заметно, что она состоит из множества пузырьков – фолликулов. По краям фолликулов расположены клетки – тироциты, а внутри фолликула находится густая водянистая жидкость – коллоид. Тироциты синтезируют гормоны, и они накапливаются в коллоиде, для немедленного поступления в кровь при необходимости.
В стенках фолликулов между клетками, а также между самими фолликулами имеются более крупные, светлые парафоликулярные клетки (С-клетки), вырабатывающие гормон кальцитонин, участвующий в регуляции обмена кальция и фосфора. Он тормозит выведение кальция из костей и уменьшает содержание кальция в крови.
Гормоны щитовидной железы
Основные два гормона которые вырабатывает щитовидная железа – трийодтиронин (в его составе три молекулы йода) и тетрайодтиронин или тироксин (содержит четыре молекулы йода). Сокращенно гормоны щитовидной железы обозначают как Т3 и Т4. В клетках и тканях организма Т4 постепенно превращается в Т3, который является главным биологически активным гормоном, непосредственно влияющим на обмен веществ.
Образование гормонов щитовидной железы связано со специфическим белком тиреоглобулином. Тиреоглобулин служит запасной формой тиреоидных гормонов и расположен внутри коллоида.
В приготовлении гормонов щитовидной железы необходимы два обязательных компонента — йод и незаменимая аминокислота тирозин. Для образования одной молекулы Т4 нужны четыре молекулы йода, а для Т3 — всего три. Без йода синтез гормонов прекращается полностью. Вот почему так важно предупредить недостаток йода в пище. Тирозин поступает в организм с пищей, он предшественник в образовании не только гормонов щитовидной железы, но и адреналина, меланина, дофамина.
В процессе синтеза гормонов щитовидной железы выделяют четыре стадии:
1. Поглощение йода щитовидной железой. Концентрация его в железе в 30-40 раз выше, чем в крови.
2. Активация йода, что делает возможным его связывание с молекулой аминокислоты тирозина.
3. Конденсация с образованием гормонов – тироксина и трийодтиронина и их накопление в составе тиреоглобулина в виде коллоида.
4. Выделение образованных гормонов в кровь под действием ТТГ.
Гормоны щитовидной железы очень малы по размеру и перед попаданием в кровь должны быть связаны с транспортными белками, для того чтоб не быть «вымытыми» из организма почками. Уровень свободных гормонов 0,03% от общего количества, именно они обеспечивают все эффекты гормонов щитовидной железы. В тканях тироксин (Т4) превращается в трийодтиронин (Т3) и биологическое действие гормонов на 90% осуществляется именно за счет Т3.
Механизм регуляции функции яичника в норме и при гипоталамо-гипофизарной дисфункции.
Симптом бесплодия есть проявление истощения компенсаторных возможностей тех или иных звеньев системы регуляции репродукции. В 50 — 70% случае бесплодие определяется состоянием жены, в 20 — 25% случаев — состоянием мужа. В 10 — 30% случаев встречаются смешанные формы, а в 2 — 5% случаев причина бесплодия не ясна (2). В структуре женского бесплодия эндокринные нарушения встречаются в 35 — 40% случаев, нарушения функции маточных труб — в 30 — 40% случаев, маточные факторы — в 10%, шеечные — в 7 — 10% случаев, влагалищные — в 6%, экстрагенитальные — в 1%, психические — в 1% случаев. Такие или сходные данные приводятся в большинстве руководств по гинекологии (10).
Основой репродуктивной системы женщины является ось гипоталамус — гипофиз — яичник, правильное функционирование которой обеспечивает созревание полноценной яйцеклетки, адекватную подготовку эндометрия к беременности, трубный транспорт гамет, оплодотворение, имплантацию и сохранение ранней беременности.
Высшим органом регуляции гипоталамо-гипофизарно-яичниковой оси является центральная нервная система, путем целого комплекса прямых и обратных связей обеспечивающая стабильность работы системы репродукции при изменении внутренней и внешней среды (14, 21). К настоящему времени открыто более 36 пептидов, регулирующих секрецию Гн-РГ (28). На основании того, что все основные нейроэндокринные круги прямо или косвенно связаны с иммунной системой и кроме эндокринных центров связывают участки мозга с лимфоидной тканью, в настоящее время некоторые исследователи говорят не о нейроэндокринной, а о нейро-иммунно-эндокринной системе регуляции репродукции (30, 33).
Рилизинг-фактором двух главных гонадотропинов, ЛГ и ФСГ, является Гн-РГ, декапептид, синтезированный Schally и Guillemin в 1977 году. Гн-РГ синтезируется в аркуатном ядре медиобазального гипоталамуса и поступает в систему воротного кровотока гипофиза в импульсном режиме. Для обеспечения нормальной секреции гонадотропинов достаточно поддержания стабильной частоты выброса физиологических количеств Гн-РГ. Изменение частоты выброса Гн-РГ меняет не только количество ЛГ и ФСГ, выделяемых гипофизом, но и их соотношение, в то время как даже десятикратное повышение концентрации Гн-РГ ведет только к небольшому снижению выделения ФСГ и никак не меняет секреции ЛГ.
Частота выброса Гн-РГ у человека составляет 1 выброс в 70 — 90 минут и соответствует целому ряду биоритмов (чередованию фаз сна, колебанию скорости клубочковой фильтрации и желудочной секреции, частоте приливов во время климакса и т.д., что подтверждает гипотезу Kleitmann о существовании общего ритма с периодичностью около 90 минут, имеющего связь с базальным циклом покоя — активности (20), который объясняется геофизическими причинами (22, 37). Основными факторами, регулирующими частоту выделения Гн-РГ являются опиаты и альфа-адреноблокаторы (6, 12, 13). Пульсовой генератор ритма — аркуатное ядро — не нуждается для поддержания своей нормальной работы ни в каких влияниях со стороны других отделов нервной системы (1). В физиологических условиях пульсовой генератор получает информацию о выделении гонадотропинов гипофизом по системе короткой обратной связи, так как специальные сфинктеры регулируют градиенты давлений в воротной системе кровотока, и часть крови из гипофиза поступает не в кавернозный синус, а обратно в гипоталамус, что обеспечивает очень высокую местную концентрацию гормонов гипофиза в гипоталамусе (31). Синтез и секреция ЛГ и ФСГ в гипофизе осуществляются одними и теми же клетками (7). На поверхности гонадотропов имеются рецепторы к Гн-РГ, плотность которых зависит от уровня стероидных гормонов в крови и от концентрации Гн-РГ. Соединение Гн-РГ с рецептором вызывает массивное поступление ионов кальция внутрь клетки, что через несколько минут ведет к выбросу запаса ЛГ и ФСГ в кровоток. Кроме того, Гн-РГ вызывает стимуляцию синтеза ЛГ и ФСГ и поддерживает целостность гонадотропов (40). Изменения частоты пульсового генератора меняет соотношение ЛГ и ФСГ, выделяемых гипофизом (24). Так, повышение ритма ведет к значительному повышению выброса ФСГ и к снижению выброса ЛГ. Частотная модуляция информации обеспечивает быстроту и надежность регуляции репродуктивной системы и ее устойчивость к помехам (4, 36). В лютеиновую фазу прогестерон через эндогенные опиаты урежает частоту пульсового генератора, причем данное действие определяется не концентрацией прогестерона, а длительностью его воздействия. Эстрадиол, действуя на гипоталамус и на гонадотропы (увеличение плотности рецепторов Гн-РГ), повышает амплитуду волны ЛГ /ФСГ (16, 39).
Прогестерон стимулирует образование в гипоталамусе ингибитора, устраняющего данное влияние эстрадиола (29, 35). Таким образом исключается возможность пика ЛГ в лютеиновую фазу, что могло бы нарушить созревание когорты фолликулов для следующего менструального цикла (11).
Гонадотропины являются главными регуляторами синтеза и секреции половых стероидов. Местом выработки половых стероидов в организме могут быть фолликулярный комплекс (тека интерна, тека экстерна, гранулеза и ооцит), желтое тело и строма яичника. Полноценность циклических изменений, обеспечивающих подготовку организма женщины к беременности, определяется качеством селекции и созревания доминантного фолликула. Основные закономерности фолликулогенеза были установлены рабочей группой профессора Ходжена на рубеже 1970-х и 1980-х годов (11). Ими были предложены термины рекрутирование, когорта, селекция, установление доминантности. Рекрутированием назван процесс перехода фолликулов из примордиальной стадии в антральную, так как только с этого времени процесс созревания становится зависимым от действия гонадотропинов. Процесс рекрутирования определяется внутрияичниковыми факторами и происходит постоянно, но образовать когорту — группу фолликулов, из которой выделится доминантный — смогут только те фолликулы, которые рекрутируются в последние 4 дня лютеиновой фазы предыдущего цикла (39). Число рекрутируемых фолликулов определяется скорее всего уровнем гонадотропинов в позднюю лютеиновую фазу и локальной концентрацией прогестерона в яичнике, что объясняет чередование овуляции в правом и в левом яичниках. Рост когорты фолликулов в раннюю фолликулярную фазу объясняется благоприятными условиями соотношения ЛГ и ФСГ и локальных концентраций эстрогенов и андрогенов. Действие ЛГ и ФСГ на фолликул строго специализировано: ЛГ стимулирует процесс синтеза андрогенов de novo клетками теки и практически не действует на клетки гранулезы, а ФСГ активирует ароматазную систему гранулезы, превращающую синтезированные в теке андрогены в эстрадиол (15).
Эстрогены и ФСГ тормозят атрезию преантрального фолликула и стимулируют пролиферацию клеток гранулезы, синтез рецепторов к ФСГ и индукцию рецепторов к ЛГ, начинающуюся на периферии фолликула и идущую к центру. Появление рецепторов к ЛГ в клетках гранулезы больших фолликулов является предпосылкой для синтеза прогестерона желтым телом. ЛГ через стимуляцию андрогенного синтеза ограничивает и уменьшает синтез рецепторов к ФСГ, ЛГ, эстрадиолу в клетках фолликула. Синергизм действия ЛГ и ФСГ в раннюю фолликулярную фазу вызывает значительное усиление секреции эстрогенов яичником. Это в свою очередь индуцирует повышение индекса ЛГ/ФСГ, что смещает синтез половых стероидов в фолликулах в сторону преимущественного образования андрогенов. При нормальном развитии событий к 8 дню менструального цикла заканчивается селекция доминантного фолликула, главным свойством которого является способность усиливать эстрогенную продукцию в условиях дефицита ФСГ и полностью подавлять развитие других фолликулов когорты с помощью внутрияичниковых и гипоталамо-гипофизарных связей (8, 11, 18, 42). Если по какой-либо причине доминантный фолликул гибнет, должен вновь произойти рекрутский набор, так как ни один другой фолликул данной когорты не сможет принять на себя роль доминантного. Важную роль в процессе подавления других фолликулов играет полипептидный регулятор ингибин, избирательно подавляющий секрецию ФСГ, и фолликул-регулирующий протеин, избирательно подавляющий ароматазную активность гранулезы.
На 12 — 14 день цикла доминантный фолликул отвечает почти за всю продукцию эстрадиола в больших количествах, что вызывает пик ЛГ и ФСГ, являющийся причиной овуляции.
Важное значение для нормальной работы желтого тела имеет пик ФСГ в середине цикла, обеспечивающий индукцию синтеза рецепторов к ЛГ в клетках гранулезы преовуляторного фолликула.
У здоровых женщин правильное развитие доминантного фолликула вызывает:
- адекватную продукцию эстрадиола, обеспечивающую созревание эндометрия и накопление в его эпителии рецепторов к прогестерону и созревание шеечной слизи;
- полноценную овуляцию;
- подготовку рецепторов к ЛГ в гранулезе, долженствующей превратиться в желтое тело.
Таким образом, качество лютеиновой фазы определяется прежде всего процессами, происходящими в первую фазу цикла. По классификации ВОЗ 1976 года все нарушения эндокринной функции яичников делятся на 7 больших групп:
- гипогонадотропная нормопролактинемическая недостаточность;
- нормогонадотропная нормопролактинемическая недостаточность;
- гипергонадотропная недостаточность;
- анатомическая форма аменореи;
- гиперпролактинемии;
- гиперпролактинемии;
- объемные процессы в гипоталамо-гипофизарной области, не меняющие секрецию пролактина (5).
Подавляющее большинство больных с нарушением функции яичников, обращающихся по поводу бесплодия, относятся ко 2-й группе нарушений по классификации ВОЗ — эугонадотропной гипоталамо-гипофизарной дисфункции. Клинически в данной группе можно выделить подгруппу 2а — больные со спонтанными менструальными циклами — и подгруппу 2б — больные с аменореей. Для больных подгруппы 2а характерны недостаточность лютеиновой фазы вследствие нарушения созревания доминантного фолликула, нарушения овуляции и нарушения функции желтого тела, а также ановуляторные менструальные циклы, отличающиеся тем, что доминантный фолликул созревает, но не овулирует, в период атрезии доминантного фолликула происходит лютеинизация гранулезы и теки, сопровождающиеся резко сниженной продукцией прогестерона. Базальная температура при этом или не повышается, или повышается незначительно.
Недостаточность лютеиновой фазы, ановуляция и аменорея как правило являются выражением степени эндокринных нарушений и часто выступают как стадии одной процесса (34).
Типичным выражением яичниковой недостаточности 2-го типа является повышение отношения ЛГ/ФСГ, сопровождается небольшой (в сравнении с гормон-продуцирующими опухолями) надпочечниковой и /или яичниковой гиперсекрецией андрогенов (5). Традиционно такие формы гипоталамо-гипофизарно-яичниковой дисфункции относили к синдрому поликистозных яичников. Однако данный термин оспаривается рядом авторов. С одной стороны, увеличение яичников может иметь место при синдроме Кушинга, андрено-генитальном синдроме, при гормон-продуцирующих опухолях, а иногда — у здоровых подростков. С другой стороны, у женщин с типичными проявлениями данного синдрома могут быть яичники нормальных размеров. Кроме того, при данном синдроме анатомические изменения яичников являются только следствием нарушенных гормональных взаимодействий в организме.
Поэтому предлагается называть данный вид патологии синдромом гиперандрогении с хронической ановуляцией (19). Со стороны гормональных изменений самыми характерными признаками являются значение отношения ЛГ/ФСГ больше 2 и повышение уровня андрогенов (тестостерона, андростендиона и ДГЭА-С) в периферической крови (17).
По сравнению со здоровыми женщинами, у которых главным эстрогеном в циркулирующей крови является эстрадиол, у женщин с синдромом гиперандрогении значительно повышен уровень эстрона, который может превышать концентрацию эстрадиола. Главным источником повышения уровня эстрона у таких больных является периферическая ароматизация андростендиона. Постоянная и монотонная продукция эстрона сенсибилизирует гипофиз к действию Гн-РГ, следствием чего является повышение отношения ЛГ/ФСГ, секретируемых гипофизом. В свою очередь, высокий уровень ЛГ ведет к чрезмерной стимуляции стромы яичника и теки, результатом чего является чрезмерная продукция андрогенов. В этих условиях резко нарушаются как процесс селекции доминантного фолликула, так и его полноценность, что ведет к опсоменорее, ановуляции, недостаточности лютеиновой фазы и к аменорее (9, 27).
Гипоталамо-гипофизарная дисфункция при II типе яичниковой недостаточности является чисто функциональным нарушением, при котором нарушается положительная обратная связь. Этиология синдрома гиперандрогении с хронической ановуляцией до сих пор не известна. Доказано, что важную роль в развитии синдрома играют наследственность, центральные нарушения катехоламинов, психический стресс и ожирение (32).
Важную роль в развитии заболевания придают дисфункции коры надпочечников. У значительной части больных надпочечники очень чувствительны к стимуляции АКТГ. В связи с этим высказана гипотеза о секреции гипофизом специфического гормона, стимулирующего андрогены коры надпочечников с молекулярным весом около 60 000 (32). Часть больных является гетерозиготными носительницами дефекта С-21-гидроксилазы (38).
Кроме того, повышенную продукцию андрогенов клетками теки может вызвать и повышенный уровень инсулина за счет перекрытия специфичности инсулина и локальных факторов роста (3). Следовательно, гирсутизм и гиперандрогения могут быть проявлением глубоких метаболических расстройств.
Для гиперандрогенной недостаточности яичников характерно повышение амплитуды и частоты залпов ЛГ гипофиза (41).
Важную роль в патогенезе играет влияние андрогенов на уровень белка, связывающего тестостерон и эстрогены (ТЭСГ). При гиперандрогении и ожирении синтез ТЭСГ в печени снижается, что ведет к повышению активных концентраций эстрогенов и тестостерона в крови, в результате чего проявления гиперандрогении усиливаются. Есть указания на то, что важную роль в развитии синдрома играют ненаследственные внутриутробные влияния, и что гиперандрогения у матери может оказывать неблагоприятное влияние на созревание различных ферментных систем плода (25). При синдроме гиперандрогении меняется соотношение норадреналина и допамина, и возникающий дефицит допамина ведет к усилению выброса ЛГ.
Нарушение развития доминантного фолликула и овуляции при нормогонадотропной недостаточности яичников ведет к развитию НЛФ (23).
Выделяют 5 причин развития НЛФ: нарушение созревания фолликула; недостаточная стимуляция ЛГ во 2- фазу цикла; недостаточная и /или запоздалая лютеинизация преовуляторного фолликула; мягкие формы гиперпролактинемии; гиперандрогении различного происхождения (23). Гормональным проявлением НЛФ является снижение продукции прогестерона желтым телом, сопровождающееся нормальной или повышенной секрецией эстрадиола (относительная гиперэстрогения). На клеточном уровне НЛФ проявляется усилением клеточных делений (эндрометрий, молочная железа, миометрий). Клинически НЛФ проявляется предменструальным синдромом, нарушениями менструального цикла, снижением фертильности, доброкачественными опухолями молочных желез и миомой матки. Причинами бесплодия при НЛФ являются недостаточная зрелость эндометрия, затрудняющая нормальную имплантацию и недостаточный для поддержки ранней беременности уровень прогестерона (26).
- The arcuate nucleus and the control of gonadotropin and prolactin secretion in the female rhesus monkey (Macaca mulatta). -Plant T.M., Krey L.S., Moossy J., McCormack J.T., Hess D.L., Knobil E. //Endocrinology, 1978, v. 102, N 1, p. 52-62.
- Baltzer J., Mickan H. Kern Gynäkologie. 4. Aufl. Stuttgart: Thieme, 1985. -685 S.
- Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistance and acanthosis nigrans syndrome: A common endocrinopathy with distinct pathophysiologic features. //American Journal of Obstetrics and Gynecology, 1983, v. 147, N 1, p. 90-101.
- Bohumil R.J. Pulsatile variations in hormone levels. //Biorythms and human reproduction. — Ferin M., Halberg F.,Richart R. M., Van de Wiele R. L. (Eds) New York: Wiley, 1974, p. 107-131.
- Breckwoldt M. Störungen der Ovarialfunktion. //Reproduktionsmedizin. -Bettendorf J., Breckwoldt M. (Hrsg.). Stuttgart; New York: Fisher, 1989, S. 258-266.
- Central electrophysiological correlates of pulsatile luteinizing hormone secretion in the rhesus monkey. -Wilson R. S., Kesner J.S., Kaufman J.M,, Uemura T., Akema T., Knobil E. //Neuroendocrinology, 1984, v. 39, N 3, p. 256-260.
- Childs G.V. Functional ultrastructure of gonadotropes: a review. //Morfology of hypothalamus and its connections. -Ganten D., Pfaff D. (Eds.). Berlin: Springer, 1986, p. 49-98.
- Correlation of human follicular fluid inhibin activity with spontaneous an
- Davis O.K., Ravnikar V. Induction of ovulation with Clomiphen Citrate. //Reproductive endocrine therapeutics. – Barbiery L., Schiff I. (Eds.). New York: A.R. Liss, Inc., 1988, p. 1-24.
- Diedrich K., Wildt L. Neue Wege in der Behandlung ovarieller Funktionsstorungen. Teil 1. //Neue Wege in der Diagnostik und Therapie der Weiblichen Sterilität. -Diedrich K., Hrsg. -Stuttgart: F. Enke, 1987, p. 26-40.
- DiZerega G.G., Hodgen G.D. Folliculogenesis in the primate ovarian cycle. //Endocrine review 1981, v. 2, N 1, p. 27-49.
- The effect of morphine on the electrophysiological activity of the hypothalamic luteinizing hormone-releasing hormone pulse generator in the rhesus monkey. -Kesner J.S., Kaufman G., Wilson R. C., Kuroda G., Knobil E. //Neuroendocrinology, 1986, v. 43, N 6, p. 486-488.
- Electrophisiological manifestation of luteinizing hormone releasing hormone pulse generator activity in the rhesus monkey: influence of a adrenergic and dopaminergic blocking agents. -Kaufman J.M., Kesner J.S., Wilson R.S., Knobil E. //Endocrinology, 1985, v. 116, N 4, p. 1327-1333.
- Everett J.W. Central neural control of reproductive functions of the adenohypophysis. //Physiology review, 1964, v. 44, p. 373-431.
- Falck B. Site of production of estrogens in rat ovary as studied by microtransplants. //Acta physiologica Scandinavica, 1959, v. 163, N 1, p. 1.
- Ferin M., van Vugt D., Wardlaw S. The hypothalamic control of the menstrual cycle and the role of endogenous opioid peptides. //Recent progress in hormone research, 1984, v. 40, p. 441-485.
- Givens J.R., Andersen R.N., Umstot E.S. Clinical findings and hormonal responses in patients with polycystic ovarian disease with normal versus elevated LH levels. //Obstetrics and gynecology, 1976, v. 47, N 4, p. 388-394.
- Hoffmann F. Untersuchunden über die hormonale Regulation der Follikelreifung im Zyklus der Frau. //Geburtshilfe und Frauerheilkunde, 1961, Bd. 21, S. 554-560.
- Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr.; V. Davaian, 2-nd edition. — Oradell: Medical Economics Books, 1986. -IX, 688 p.
- Kleitmann N. Sleep and wakefulness. — Chicago: Chicago University Press, 1963. -250 p.
- Lakoski J.M. Cellular electrophysiologycal approaches to the central regulation of female reproductive aging. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K.Rassin (Eds.). -New York: Liss, 1989, p. 209-220.
- Lavie P., Kripke D.F. Ultradian circa 1½ hour rhythms: A multioscillatory system. //Life sciences, 1981, v. 29, N 24, p. 2445-2450.
- Lobo R.A. Polycystic ovary syndrome. //Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr. and V. Davajan, 2-nd edition. — Oradell: Medical Economics Books, 1986, p. 319-336.
- Leyendecker G., Wildt L., Plotz E.J. Die hypothamische Ovarialinsuffizienz.//Gynäkologe, 1981, Bd. 14, N 2, S. 84-103.
- Lobo R.A. Polycystic ovary syndrome. //Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr. and V. Davajan, 2-nd edition. — Oradell: Medical Economics Books, 1986, p. 319-336.
- Mauvais-Jarvis P., Kutten F. Insuffisance gonadotrope dissociée (anovulation et dysovulation)
- The microinvironment of the human antral follicle: Interrelationships among the steroid levels in human antral fluid, the population of granulosa cells and the status of the oocyte in vivo and in vitro. -McNatty K.P., Smith D.M., Makris A., Osathanonolh R., Ryan K.J. //Journal of clinical endocrinology and metabolism, 1979, v. 49, N 6, p. 851-860.
- Miller B.T. Peptide modulation of luteinizing hormone releasing hormone secretion. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K. Rassin (Eds.). New York: A.R.Liss, Inc., 1989, p. 255-271.
- Mode of action of progesterone in the blocade of gonadotropin surges in the rhesus monkey. -Pohl C.R., Richardson W.D., Marshall G., Knobil E. //Endocrinology, 1982, v. 110, N 4, p. 1454-1455.
- The Neuro-immune-endocrine connection. — Cotman C., Brinton R.E., Galaburda A., McEwen B.C. -New York: Raven Press, 1986. -150 p.
- Page R.B. Pituitary blood flow. //American journal of physiology, 1982, v. 243, N 6, p. 427-442.
- Parker L.N., Odell W.B. Control of adrenal androgen secretion. //Endocrine review, 1980, v. 1, N 4, p. 392-410.
- Perez-Polo J.R. Introduction: Neuroimmune modulation of reproductive function. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K. Rassin (Eds.). -New York: A.R. Liss, 1989, p. 307-309.
- Plotz E.J. Differentialdiagnose und Therapie ovarieller Funktionsstörungen: Richtlinien fur die Praxis. //Gynäkologe, 1981, Bd. 14, N 2, S. 145-148.
- The pulsatile pattern of gonadotropin secretion and follicular development durung the menstrual cycle and in women with hypothalamic and hyperandrogenic amenorrhea. -Wildt L., Schwilden H., Werner G., Roll C., Brensing K.A., Vuckhaus J., Böhr M., Leyendecker G. //Brain and pituitary peptides II. — G. Leyendecker, H. Stock, L. Wildt (Eds.). -Basel: Karger, 1983, p. 28-36
- Rushton W.A.H. Peripheral coding in the nervous system. //Sensory communication. -W.A. Rosenblith (Ed.). -New York: Wiley, 1961, p. 20-30.
- Shapiro S. Compass on the 90-minutes sleep-dream cycle. //Sleep and dreaming. -Hartman E. (Ed.) -Boston: Little and Brown, 1970, p. 40-49.
- An update of congenital adrenal hyperplasia. — New M.I., Dupont B., Pang S., Pollack M., Levine S.L. // Recent progress in hormone research, 1981, v. 37, p. 105-181.
- Wildt L. Die endokrine Kontrolle der Ovarialfunktion und die Pathologie endokriner Ovarialfunktionsstörungen. // Neue Wege in Diagnostik und Therapie der weiblichen Sterilität. -Hrsg. von K. Diedrich. — Stuttgart: Enke, 1987, S. 1-25.
- Wildt L. Hypothalamus. //Reproduktionsmedizin. — Hrsg. von Bettendorf G., Breckwoldt M. — Stuttgart: Fischer, 1989, S. 6-22.
- Yen S.S.C. The polycystic ovary syndrome. //Clinical endocrinology, 1980, v. 12, N 2, p. 177-207.
- Zeleznik A.J., Schuler H.M., Reichert L.C., Jr. Gonadotropin binding sites in the rhesus monkey ovary: Role of the vasculature in the selective distribution of human chorionic gonadotropin to the preovulatory follicle. //Endocrinology, 1981, v. 109, N 2, p. 356-362.
d induced follicular maturation. -Murrs R.P., Lobo J.D., Campeau J.D., Nakamura R.M., Brown J., Ujita E.L., DiZerega G.S. //Journal of Clinical Endocrinology and Metabolism, 1987, v. 64, N 1, p. 148-152.
. //Médecine de la reproduction. Gynécologie endocrinienne. -Paris: Flammarion, 1982, p. 305-319.
.
Теги: менструальный цикл
Гипоталамус — гипофиз — щитовидная железа
Выделение гормонов щитовидной железы контролируется двумя «вышестоящими» эндокринными железами. Область головного мозга, связывающая воедино нервную и эндокринную систему, называется гипоталамус. Гипоталамус получает информацию об уровне гормонов щитовидной железы и выделяет вещества, влияющие на гипофиз. Гипофиз также расположен в головном мозге в области специального углубления — турецкого седла. Он выделяет несколько десятков сложных по строению и действию гормонов, но на щитовидную железу действует только один из них — тиреотропный гормон или ТТГ.
Уровень гормонов щитовидной железы в крови и сигналы от гипоталамуса стимулируют или тормозят выделение ТТГ. Например, если количество тироксина в крови маленькое, тогда про это будут знать и гипофиз и гипоталамус. Гипофиз немедленно выделит ТТГ, что активирует выброс гормонов из щитовидной железы.
Низкая температура и состояние стресса приводят к более активному выделению ТТГ и, соответственно, повышению количества Т3 и Т4 в крови. Во время сна ТТГ практически не образуется.
Тройная ось взаимодействия гипоталамо-гипофизарно-тиреоидной системы позволяет знать про количество гормонов щитовидной железы не только вышестоящим железам, но и нервной системе, которая непосредственно зависит и влияет на гормональную регуляцию.
Гормоны гипофиза
Меланоцитстимулирующий гормон (МСГ)
Область действия: Кожа.
Функции: Стимулирует выработку меланоцитов, влияющих на цвет кожи.
Антидиуретический гормон, или вазопрессин (АДГ)
Область действия: Почки.
Функции: Удерживает воду в почках, регулирует артериальное давление.
Гормон роста, или соматотропин (ГР, СТГ или РГ)
Область действия: Весь организм.
Функции: Стимулирует рост мышц, костей и органов в детстве и во время полового созревания.
Тиреотропин (ТТГ)
Область действия: Щитовидная железа.
Функции: Стимулирует деятельность щитовидной железы.
Окситоцин
Область действия: Матка
Функции: Провоцирует сокращения матки во время родов.
Адренокортикотропин (АКТГ)
Область действия: Надпочечники.
Функции: Стимулирует выработку кортикостероидов надпочечными железами.
Пролактин (ЛТГ)
Область действия: Грудь.
Функции: Провоцирует выработку молока грудными железами после родов.
Действие гормонов щитовидной железы
В отличии от большинства гормонов, которые действуют только на определенные клетки-мишени (например, для эстрадиола это половые органы), гормоны щитовидной железы необходимы для нормальной работы всем тканям без исключения. Приникая внутрь клетки гормон направляется в ядро, где связываясь с определенными участками на хромосомах, стимулирует комплекс реакций, что ведет к активации процессов окисления и восстановления.
Действие гормонов щитовидной железы на организм:
- повышение выделения тепла
- активация синтеза белка необходимого для построения новых клеток
- правильный рост и развитие центральной нервной системы, особенно головного мозга (особо важно для детей)
- усиление процессов обратного всасывания в кишечнике, образования глюкозы из белков и жиров, повышение уровня глюкозы в крови
- стимуляция распада жиров в жировых депо, что ведет к похудению
- анаболический эффект – рост организма, его созревание, дифференцировка костей
- образование эритроцитов
- нормальное развитие половых органов и выделение половых гормонов.
Сколько должно быть гормонов?
Гормонов должно быть достаточно для обеспечения нормальной деятельности организма. Точноопределить уровень гормонов щитовидной железы позволяет проведение анализов. «Золотым стандартом» среди лабораторных методов анализа гормонов щитовидной железы является радиоиммунный анализ. Но в связи со сложностями использования радиоактивных изотопов большинство лабораторий проводят анализы методом ИФА (иммуноферментного анализа).
Количество гормонов щитовидной железы зависит от:
— интенсивности сигналов, идущих от головного мозга и регулирующих работу и уровень гормонов щитовидной железы
— числа работоспособных клеток в самой железе
— наличия в достаточном количестве йода, который необходим для синтеза гормонов.
Нормальные уровни гормонов щитовидной железы:
— трийодтиронин общий Т3 — 1.2-2.8мМе/л
— тироксин общий Т4 — 60.0- 160.0 нмоль/л
— трийодтиронин свободный FT3 — 2.5 — 5.8 пмоль/л
— тироксин свободный FT4 — 11.5-23.0 пмоль/л
— тиреотропный гормон ТТГ, TSH — 0.17-4.05 мМЕ/л
— тиреоглобулин Тg — менее 50 нг/мл
При проведении анализов на гормоны щитовидной железы оценивают не только их количество, но и показатели антител. При нарушениях в системе иммунного ответа антитела начинают образовываться не только на чужеродные организмы, но и на «родные» ткани. Некоторые из этих антител нарушают работу щитовидной железы и действие её гормонов. Наиболее распространенными являються антитела к рецепторам ТТГ (TSH receptor Ab), антитела к тиреоглобулину (АТТГ) и антитела к тиреопероксидазе (анти-АТПО).
Антитела к рецепторам ТТГ, по строению похожи на ТТГ и их присоединение к рецепторам на щитовидной железе ведет к активному выделению Т3 и Т4. Антитела к тиреоглобулину появляются при аутоиммунном тиреоидите Хасимото и беременности. Контроль за их уровнем в крови указывает на активность воспаления. Анти-АТПО — антитела к тиропероксидазе (АМС, антитела к микросомальной фракции) приводят к разрушению железы и поступлению гормонов в кровь.
Состояние, при котором гормонов щитовидной железы достаточно для организма, называется эутиреоз.
Используемые методы лечения
Стандартно лечение аденомы гипофиза заключается в лекарственной, лучевой и нейрохирургической терапиях. Оптимальный метод воздействия определяется по результатам диагностики: он зависит от состояния пациента, характеристик самой опухоли, наличия сопутствующих заболеваний.
Медикаментозная терапия
Лекарственная терапия назначается в 90% случаев. Препараты помогают избавиться от проявлений болезни и улучшить самочувствие пациента. Первоначально прописываются витаминные и общеукрепляющие комплексы. Далее необходимо определить разновидность опухоли:
- при пролактиномах назначаются агонисты дофамина либо эрголиновые препараты,
- при соматотропиномах – агонисты соматостатина,
- при кортикотропиноме – блокаторы стероидогенеза.
При необходимости проводится заместительная гормонотерапия. Если выбранная схема лечения долгое время не приносит результата, то подбирается более радикальный метод воздействия: лучевая терапия либо операция.
Лучевая терапия
При микроаденомах применяется протонная, гамма- и дистанционная терапия. Суть тактики во введении радиоактивного вещества непосредственно в патологическую область. Благодаря такому воздействию удается остановить рост опухоли, достичь регресса. Обычно лучевая терапия проводится при невозможности хирургического вмешательства и отказе пациента от операции. После такого воздействия аденома гипофиза постепенно уменьшается в размерах, может полностью разрушаться.
Хирургическое вмешательство
При большом размере опухоли и развитии сопутствующих осложнений (кровоизлияниях, образовании кист, нарушении зрения) показано ее удаление транскраниальным методом. Операция предполагает трепанацию черепа. В некоторых случаях возможно проведение вмешательства при помощи эндоскопических методик.
Выбор конкретной тактики лечения в основном зависит от разновидности опухоли. При пролактиноме лучевое воздействие практически бесполезно, когда при кортикотропиноме — показывает высокую эффективность. Если опухоль не вызывает никаких нарушений в организме и пациент не жалуется на ухудшение самочувствия, врачи выбирают выжидательную тактику.
Гормонов щитовидной железы не достаточно
Сниженная функция щитовидной железы — гипотиреоз, возникает при дефиците поступления йода или поступлении веществ нарушающих образование гормонов. Более редкими причинами гипотиреоза являются прием некоторых препаратов (например, кордарона), удаление железы в результате опухолей или дефицита выделения ТТГ. Гипотиреоз в детском возрасте приводит к задержке роста, непропорциональному росту, задержке психического развития, кретинизму. Гипотиреоз у взрослых называется микседемой.
Проявления недостаточности гормонов щитовидной железы:
— увеличение веса, который не снижается диетой и физическими упражнениями
— общая слабость, постоянная усталость, утомляемость
— постоянно угнетенное настроение
— нарушения менструального цикла, бесплодие
— низкая температура тела (35,6-36,3ºС)
— сухая, отекшая кожа, зуд, появление перхоти которая не исчезает при использовании лечебных шампуней, изменения ногтей
— постоянные запоры
— постоянные отеки ног, ступней, одутлость лица
— сниженное давление, низкая частота сердцебиений
— невозможность согреться даже в теплом помещении
— боль в мышцах и суставах
— ухудшение памяти и скорости реакции
Одна из форм гипотиреоза — эндемический зоб, который развивается при недостаточном поступлении в организм йода. Такая ситуация характерна для районов, где низкий его уровень в воде и грунте. Швейцария, одна из первых стран ввела обязательное йодирование соли, подсолнечного масла и хлеба ёще в 1922 году. Сегодня в Швейцарии нет ни одного случая гипотиреоза. Районами йодной недостаточности в России являются Северный Кавказ, Урал, Алтай, Сибирское плато, Дальний Восток, Верхнее и Среднее Поволжье, на Севере и в Центральных областях европейской части страны. В Украине это Волынская, Закарпатская, Ивано-Франковская, Львовская, Ровненская, Тернопольская области.
При авариях на АЭС в воздух попадает большое количество радиоактивного йода. Радиоактивный йод может изнутри облучать железу и встраиваться в гормоны щитовидной железы, что ведет к активному опухолевому росту. Проведение йодной профилактики помогает предупредить поступление радиационного йода в щитовидку замещением его стабильным изотопом.
Роль дофаминомиметиков в лечении и профилактике рецидивов аденомы гипофиза
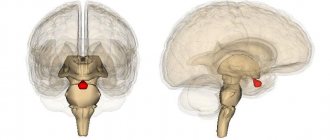
Гипофиз и гипоталамус в функциональном отношении представляют собой единое целое. Гипоталамус является частью промежуточного мозга, а гипофиз развивается из двух эктодермальных зачатков различного происхождения: выпячивания первичного ротового углубления (карман Ратке) и выпячивания дна III желудочка мозга (воронка). Гипофиз, нижний мозговой придаток, или питуитарная железа (hypophysis cerebri, glandula pituitaris), представляет собой сложный эндокринный орган, расположенный в основании черепа в турецком седле основной кости и анатомически связанный ножкой с дном III мозгового желудочка промежуточного мозга. Он состоит из трех долей: передней доли, средней доли и задней доли. Передняя и средняя доли объединяются под названием аденогипофиз, а задняя доля называется нейрогипофизом. К нейрогипофизу относят также срединное возвышение (медиальная эминенция, расположенная на границе между аденогипофизом и гипоталамусом промежуточного мозга).
Ложе гипофиза — турецкое седло, как и гипофиз, имеет овальную форму. Оно выстлано твердой мозговой оболочкой, между листками которой располагается гипофиз. Вход в турецкое седло прикрыт листком твердой мозговой оболочки, который носит название диафрагмы турецкого седла. Через отверстие в диафрагме проходит ножка гипофиза. В норме арахноидальная оболочка располагается по верхней поверхности диафрагмы турецкого седла и не опускается в его полость. При наличии врожденных дефектов диафрагмы турецкого седла арахноидальная оболочка распространяется в полость турецкого седла, позволяя проникать сюда спинномозговой жидкости, что приводит к развитию синдрома пустого турецкого седла.
В передней доле гипофиза вырабатываются белковые гормоны (соматотропный гормон (СТГ) и пролактин), гликопротеины (фолликулостимулирующий, лютеинизирующий и тиреотропный (ТТГ)), а также адренокортикотропный гормон (АКТГ), эндорфины, липотропины и меланоцитстимулирующие гормоны. Задняя доля гипофиза служит резервуаром для хранения нейрогормонов — вазопрессина и окситоцина, которые поступают сюда по аксонам нейронов, расположенных в гипоталамических ядрах.
Причинами дефицита гормонов гипофиза могут быть: дефекты кровоснабжения, кровоизлияние, врожденное недоразвитие гипофиза, менингит или энцефалит, сдавление гипофиза опухолью, черепно-мозговая травма, воздействие некоторых лекарств, облучение, хирургическое вмешательство.
Недостаток гормонов гипофиза может приводить к вторичному недостатку гормонов других эндокринных желез (вторичный гипотиреоз, несахарный диабет), а также к тяжелым физическим нарушениям (гипофизарный нанизм, гипопитуитаризм).
Причиной избытка гормонов гипофиза в большинстве случаев является опухоль самого гипофиза — аденома. При этом повышается уровень тех гормонов, которые производят клетки аденомы, тогда как уровень всех остальных гормонов может значительно снижаться из-за сдавления оставшейся части гипофиза.
Среди всех опухолей, поражающих гипофиз, аденома занимает первое место. Обычно аденома гипофиза встречается у взрослых, но иногда опухоль обнаруживается и в детском возрасте [1]. Половина всех случаев заболевания приходится на средний возраст 30–50 лет, с одинаковой частотой для мужчин и женщин, что составляет до 15% всех внутричерепных новообразований [2]. Истинную распространенность этой опухоли установить трудно, т. к. многие из них долгое время существуют бессимптомно. Выявляемость составляет всего лишь 2 человека на 100 000 населения. На аутопсии аденомы гипофиза обнаруживают у 10–20% пациентов, умерших от не связанных с поражением гипофиза болезней [3].
До недавнего времени аденомы гипофиза подразделялись на ацидофильные (эозинофильные), сопровождающиеся гиперсекрецией СТГ (акромегалия или гигантизм), базофильные, секретирующие АКТГ, а также хромофобные, протекающие без нарушения секреции гормонов, и смешанные. Однако во многих случаях не было достаточной корреляции между клинической картиной заболевания и гистологической структурой аденомы гипофиза. Однако в 1995 году E. Horvath и K. Kovacs, применив гистологические и другие виды исследований при изучении 1700 аденом гипофиза, предложили модифицированную классификацию с учетом частоты встречаемости различных видов аденом. Согласно их классификации, существуют соматотрофная, лактотрофная, маммосоматотрофная, кортикотрофная, тиротрофная, гонадотрофная, плюригормональная, «немая» и другие виды аденомы.
Аденома гипофиза (adenoma hypophysis) — доброкачественная опухоль, исходящая из железистых клеток передней доли гипофиза (аденогипофиза) и локализующаяся в полости турецкого седла клиновидной кости основания черепа (рис. 1).
Само понятие «аденома гипофиза» собирательное и включает в себя целую группу опухолей, вызывающих различные по проявлению заболевания. Как и все опухоли, аденомы гипофиза разделяют по размерам, направлению роста, гистологическим особенностям, а также по гормональной активности. Современная классификация аденом гипофиза основывается на сопоставлении клинической симптоматики и величин концентрации тропных гормонов в крови с иммунно-гистохимической и электронно-микроскопической характеристикой опухоли.
Существует несколько видов классификаций аденом гипофиза. Одна из них — по гормональной активности опухолей, которая стала активно применяться с начала 70-х годов XX столетия. Согласно этой классификации аденомы делят на гормонально-неактивные (25–30%) и гормонально-активные (70–75%) [4].
Аденомы гипофиза, протекающие без клинических проявлений гиперсекреции гипофизарных гормонов, называют «неактивными» аденомами гипофиза, разрастание которых приводит к снижению функции гипофиза — гипопитуитаризму. До появления неврологических симптомов, таких как головная боль, нарушение зрения, связанных с воздействием большой опухоли на окружающие ее структуры, гормонально-неактивные аденомы гипофиза являются клинически «немыми» или «молчащими» опухолями. В литературе применяются также термины «клинически нефункционирующие» аденомы [5]. Однако существуют и гормонально активные аденомы, к которым относятся АКТГ-продуцирующая, пролактинсекретирующая, СТГ-продуцирующая, ТТГ-продуцирующая, а также гонадотропные аденомы. Частота встречаемости соматотропином составляет 20–25%, пролактином — 40%, кортикотропином — 7%, тиротропином — 3% от общего количества аденом гипофиза. Относительно нечасто встречаются смешанные опухоли — пролактосоматотропиномы и пролактокортикотропиномы. Остальные виды аденом гипофиза относятся к редко встречающимся опухолям.
Кроме того, существует классификация аденом гипофиза по направлению роста. Характер роста аденомы гипофиза определяется по отношению опухоли к турецкому седлу, в котором располагается нормальный гипофиз, и к окружающим его структурам. На ранней стадии аденомы гипофиза развиваются в полости турецкого седла (эндоселлярные опухоли). Постепенно увеличиваясь, опухоль может распространяться книзу, в клиновидную пазуху (инфраселлярно), кверху — в направлении диафрагмы турецкого седла и перекреста зрительных нервов (супраселлярно), латерально, оказывая воздействие на структуры кавернозного синуса, базальные отделы височных долей головного мозга и магистральные сосуды головы, кзади — в направлении ствола мозга (ретроселлярно) и кпереди — в направлении лобных долей, глазницы, решетчатого лабиринта и полости носа (антеселлярно). Очень часто направление роста аденомы гипофиза бывает различным (вверх, в сторону, вниз) — тогда опухоль называют эндо/супра/инфра/латероселлярной. По размерам опухоли гипофиза разделяют на микроаденомы (менее 1 см в диаметре) и макроаденомы (диаметр более 1 см).
Причины развития аденом гипофиза до настоящего времени полностью не выяснены, хотя известно, что некоторые из них могут быть обусловлены генетически. В число факторов, предрасполагающих к развитию опухолей гипофиза, входят нейроинфекции, хронические синуситы, черепно-мозговые травмы, гормональный дисбаланс, неблагоприятное внутриутробное воздействие на плод. В последнее время этиологическая роль частично отводится длительному применению оральных контрацептивов.
Развитие опухоли гипофиза — многоэтапный процесс, в который вовлекаются, наряду с соматическими мутациями в гипофизарных клетках, многие другие дополнительные факторы — гормональные, аутокринные и паракринные. Важными патогенетическими факторами, участвующими в туморогенезе в гипофизе, являются гормоны гипоталамуса, нейромедиаторы и факторы роста [6]. Вместе с тем следует подчеркнуть, что нарушения гипоталамической регуляции и другие указанные факторы в отличие от онкогенных мутаций лишь способствуют развитию опухоли гипофиза, но не являются ее непосредственной причиной [7].
Существует концепция первичного поражения гипоталамуса с вторичным вовлечением в процесс ткани аденогипофиза [8], а также концепция первичного поражения гипофиза, следствием которого является возникновение аденомы [9]. Образование некоторых форм аденом гипофиза (тиротропином, гонадотропином) на фоне первичного снижения активности периферических желез внутренней секреции (при первичном гипотиреозе, гипогонадизме) происходит вследствие гиперстимуляции гипофиза гипоталамическими рилизинг-гормонами. Это указывает на существование различных механизмов формирования аденомы гипофиза.
Доказано, что клетки гипофиза способны вырабатывать различные ростовые факторы, в том числе основной фактор роста фибробластов, обладающий мощным митогенным и ангиогенным потенциалом, и имеют соответствующие рецепторы [3].
Клиническая картина аденом гипофиза полиморфна и представлена различными группами симптомов, появления которых определяются функциями гормонов, секретируемыми той или иной формой опухоли (
).
Клинические проявления гормонально-активных аденом гипофиза состоят из эндокринно-обменного синдрома, офтальмоневрологических и рентгенологических симптомов. Выраженность эндокринно-обменного синдрома отражает уровень избыточно вырабатываемого гормона гипофиза и степень повреждения ткани, окружающей опухоль.
При некоторых аденомах гипофиза (кортикотропиномах, некоторых тиротропиномах) клиническая картина обусловлена не столько избыточной выработкой самого тропного гормона, сколько связанной с этим активацией органа-мишени, выражающейся гиперкортицизмом, тиреотоксикозом. Офтальмоневрологические симптомы, свидетельствующие о наличии аденомы гипофиза (первичная атрофия зрительных нервов, изменения поля зрения по типу битемпоральной гемианопсии, гипоксии и др.), зависят от супраселлярного роста опухоли. Из-за давления опухоли на диафрагму турецкого седла возникает головная боль, которая обычно локализуется в лобной, височной и позадиглазничной областях. Эта боль обычно тупого характера, не сопровождается тошнотой, не зависит от положения тела и далеко не всегда купируется обезболивающими препаратами. Дальнейший рост опухоли кверху приводит к повреждению гипоталамических структур. Рост аденомы гипофиза в латеральном направлении вызывает сдавление III, IV, VI и ветвей V черепных нервов с развитием офтальмоплегии и диплопии. Рост опухоли книзу, в направлении дна турецкого седла, и распространение процесса в пазуху клиновидной кости, решетчатые пазухи может сопровождаться чувством заложенности носа и ликвореей [17].
Внезапное усиление головной боли и офтальмоневрологической симптоматики у больных с аденомой гипофиза связано чаще всего либо с ускорением роста опухоли, например, в период беременности, либо с кровоизлиянием в опухоль. Кровоизлияние в опухоль считают тяжелым, но не фатальным осложнением. Кровоизлияния в аденому гипофиза происходят довольно часто и могут приводить, помимо усиления головной боли, зрительных нарушений и развития гипопитуитаризма, к спонтанному «излечению» от гормонально-активной аденомы гипофиза. Спонтанные «излечения» наиболее присущи пролактиномам. Увеличение опухоли во время беременности, возможно, связано с неизбежным увеличением аденогипофиза в этот период; отмечено, что у большинства больных с пролактиномами после родоразрешения опухоль уменьшается [18].
Симптомами аденомы гипофиза, выявляемыми при рентгенологическом исследовании, являются изменение формы и размеров турецкого седла, истончение и деструкция костных структур, образующих его, и др. При компьютерной томографии может быть визуализирована и сама опухоль.
Для отдельных гормонально-активных аденом гипофиза характерны специфические клинические симптомы. Пролактиномы у женщин проявляются синдромом галактореи-аменореи. Нередко основным эндокринным проявлением этих опухолей является только галакторея, или только нарушение менструального цикла, или бесплодие, но чаще отмечают сочетание этих симптомов.
Примерно у трети женщин с пролактиномами наблюдаются умеренное ожирение, нерезко выраженный гипертрихоз, акне, себорея волосистой части головы, нарушения половой функции — снижение либидо, аноргазмия и др. У мужчин основными эндокринными проявлениями пролактиномы являются нарушения половой функции (снижение либидо, импотенция), гинекомастия и галакторея сравнительно редки. У женщин с пролактиномами к моменту выявления опухоли офтальмоневрологические нарушения встречаются не более чем в 26% случаев, у мужчин офтальмоневрологическая симптоматика доминирует. Это связано, по-видимому, с тем, что у женщин пролактиномы чаще выявляют еще на стадии микроаденомы, а у мужчин из-за медленного нарастания таких неспецифических симптомов, как половая слабость и др., почти всегда обнаруживают опухоль уже больших размеров [19].
Соматотропиномы клинически проявляются синдромом акромегалии или гигантизмом у детей. При акромегалии помимо типичных для этой болезни изменений скелета и мягких тканей может повышаться артериальное давление, развиваться ожирение и симптомы сахарного диабета. Нередко наблюдается увеличение щитовидной железы, чаще без нарушения функции. Часто отмечают гирсутизм, появление папиллом, невусов, бородавок на коже, выраженную сальность кожи, усиленное потоотделение; работоспособность больных снижена. Офтальмоневрологическая симптоматика при соматотропиномах развивается на определенной стадии при экстраселлярном росте опухоли. Кроме перечисленных выше симптомов отмечают периферическую полиневропатию, проявляющуюся парестезиями, снижением чувствительности в дистальных отделах конечностей, болями в конечностях [20].
Диагностика опухолей гипофиза сводится к осмотру специалистами (нейрохирург, эндокринолог, офтальмолог), а также к проведению рентгенографии черепа, гормонального исследования крови, компьютерной томографии головного мозга и магнитно-резонансной томографии. Диагностика аденомы гипофиза обязательно должна быть комплексной. Выраженная эмоциональная лабильность больных с аденомой гипофиза, трудности диагностического поиска, вероятность гипердиагностики, медленный рост и доброкачественное клиническое течение многих аденом гипофиза требуют тактичного и бережного ознакомления больных с результатами обследования.
Дифференциальный диагноз проводят с гормонально-неактивными опухолями, расположенными в области турецкого седла, с опухолями негипофизарной локализации, продуцирующими пептидные гормоны, и с гипоталамо-гипофизарной недостаточностью неопухолевого генеза. Дифференцировать аденому гипофиза необходимо с синдромом пустого турецкого седла, для которого также характерно развитие офтальмоневрологического синдрома.
Кроме того, необходимо доказать, что эндокринно-обменный синдром не явился результатом приема некоторых лекарственных средств или нервно-рефлекторных воздействий. Так, нейролептики, ряд антидепрессантов и противоязвенных препаратов могут вызывать развитие галактореи, а кортикостероиды способствуют появлению кушингоидизма. Частая самопальпация молочных желез, наличие внутриматочного контрацептива, хронический аднексит вызывают возникновение рефлекторной галактореи.
Для выявления аномальной реакции аденоматозной ткани на фармакологическое воздействие используют также специальные нагрузочные фармакологические пробы. При подозрении на аденому гипофиза больного следует направить на консультацию к специалисту-офтальмологу. Исследование остроты и полей зрения, осмотр глазного дна позволяют диагностировать зрительные нарушения (хиазмальный синдром), иногда поражение глазодвигательного нерва.
На сегодняшний день существуют три основных вида лечения больных с аденомами гипофиза: нейрохирургическое (трансфеноидальное, транскраниальное удаление опухолей), лучевое (протонотерапия, гамма-терапия, гамма-нож) и медикаментозное. Среди последних выделяют агонисты дофамина (бромокриптин, каберголин, леводопа, хинаголид), аналоги соматостатина (ланреотид, октреотид) и блокаторы рецепторов к соматотропину.
Выбор метода лечения аденомы гипофиза зависит от типа опухоли (гормонально-неактивная или гормонально-активная), ее размеров, выраженности и тяжести клинических проявлений. Эффективность оперативного лечения, дистанционной и внутритканевой лучевой терапии, а также медикаментозного лечения зависит от стадии развития опухоли и тяжести клинической симптоматики (
).
Пролактиномы, независимо от размеров, при отсутствии нарастающих нарушений зрительных функций сначала лечат консервативно агонистами дофаминовых рецепторов, при этом на фоне длительного лечения женщинам можно разрешить беременность. Лечение рефракторных к медикаментозной терапии эндоселлярных пролактином оперативное. Используют также прецизионное протонное облучение. Предпочтение отдается микрохирургическим методам лечения. При больших опухолях, распространяющихся на параселлярные структуры, проводят нейрохирургическую операцию с последующей послеоперационной лучевой терапией [21].
Для соматотропином и пролактосоматотропином при эндоселлярной локализации опухоли оперативное лечение и протонная лучевая терапия являются альтернативными методами. При невозможности радикального оперативного лечения из-за прорастания опухоли в решетчатые пазухи и глазницу или при крайне больших размерах опухоли в послеоперационном периоде для профилактики роста опухоли проводят дистанционную гамма-терапию, используют агонисты дофаминовых рецепторов.
Кортикотропиномы у больных молодого возраста, проявляющиеся синдромом Нелсона или болезнью Иценко–Кушинга легкой или средней тяжести, чаще подвергают дистанционной лучевой терапии. При небольших размерах опухоли предпочтение отдают протонному облучению. В тяжелых случаях целью первого этапа лечения является ликвидация или уменьшение степени гиперкортицизма с помощью химиотерапии и оперативного удаления одного или обоих надпочечников, а дистанционное облучение гипофиза, предпочтительно протонное, проводят на следующем этапе лечения [21].
Тиротропиномы и гонадотропиномы лечат в зависимости от их величины и распространенности, начиная с заместительной гормонотерапии. В дальнейшем, при необходимости, присоединяют оперативное лечение и лучевую терапию. Для лечения гормонально-неактивных аденом гипофиза применяется комплексное воздействие (оперативное лечение и лучевая терапия), а в последующем больным назначают корригирующую гормонотерапию [21].
Сущность медикаментозного лечения аденомы гипофиза сводится к уменьшению действия гормонов, вырабатывающихся опухолью. Однако длительное (зачастую пожизненное) медикаментозное лечение эффективно далеко не у всех пациентов, а кроме того, оно нецелесообразно в случаях, когда размер опухоли достаточно велик. Чаще всего лечение препаратами используется на этапах подготовки к операции и в послеоперационном периоде. Спектр препаратов для лечения аденомы гипофиза представлен в табл. 3.
Не вызывает сомнения целесообразность патогенетического подхода в решении проблемы лечения аденомы гипофиза, а поэтому отдельного внимания заслуживает группа дофаминомиметиков (агонистов D2-рецепторов дофамина). Они существенно снижают уровень продуцируемых опухолью гормонов, одновременно уменьшая размеры опухоли [22]. Дофаминомиметики стали известны в 1972 году, когда была показана эффективность бромокриптина в терапии больных аденомой гипофиза, секретирующей одновременно СТГ и пролактин. Однако последние годы в лечении гормонально-активных аденом гипофиза используют агонисты дофамина нового поколения — квинаголид и каберголин. Более того, последний препарат сегодня является препаратом выбора для лечения аденомы гипофиза (Physicians Desk Reference, 2005) [10].
Каберголин способен уменьшать уровень пролактина, восстанавливать половую функцию и замедлять опухолевый рост у большинства пациентов, обладая минимумом побочных эффектов [23]. Так, в 4-недельном двойном слепом, плацебо-контролируемом исследовании 900 пациентов с гиперпролактинемией, вызванной гормонально-активной аденомой гипофиза, получали каберголин в фиксированных дозах 0,125, 0,5, 0,75 и 1,0 мг два раза в неделю [24]. Выраженность большинства побочных эффектов была слабой или умеренной. Спектр нежелательных явлений, возникших на фоне приема каберголина, представлен на рис. 2.
У этих пациентов дополнительно были выявлены такие нежелательные явления, как галлюцинации, спутанность сознания, периферические отеки. Редко отмечались сердечная недостаточность, плевральный выпот, легочный фиброз, язва желудка или двенадцатиперстной кишки, имеется сообщение об одном случае констриктивного перикардита. Именно поэтому у пациентов, получающих долгосрочное лечение каберголином, необходимо периодическое проведение эхокардиографии.
В ряде исследований установлена связь повышенного уровня пролактина и ухудшения показателей спермограммы [15, 16]. Лечение гиперпролактинемии, обусловленной аденомой гипофиза, каберголином дает положительный эффект в отношении параметров спермы [11, 12]. При анализе исследований восстановления показателей спермы после лечения различными дофаминомиметиками (каберголином, квинаголидом или бромокриптином) в группе каберголина были отмечены более значимые положительные изменения в количестве, подвижности, поступательном движении и нормализации морфологии спермы [13, 14].
Таким образом, доказательная база дофаминомиметиков, их высокая эффективность и широкий профиль безопасности позволяют назначать препараты, содержащие каберголин, в составе комплексного лечения и профилактики рецидивов аденомы гипофиза.
Литература
- Wilson T. M., Yu-Lee L. Y., Kelley M. R. Coordinate gene expression of luteinizing hormone-releasing hormone (LHRH) and the LHRH-receptor after prolactin stimulation in the rat Nb2 T-cell line: implications for a role in immunomodulation and cell cycle gene expression // Mol Endocrinol. 1995; 9: 44–53.
- Кушель Ю. В. Гормонально-неактивные аденомы гипофиза // Проблемы эндокринологии. 1993, № 1.
- Thapar K., Kovacs K., Laws E. R. Pituitary Adenomas: current concepts in classification, histopathology and molecular biology // The Endocrinologist. 1993, 3 (1): 39–57.
- Katznelson U., Alexander J. M., Klibanski A. J. Clinical review 45: clinically nonfunctioning pituitary adenomas // Clin Endocrinol Metab. 1993; 76: 5: 1089–1094.
- Molitch M. E. Clinical review 65. Evaluation and treatment of the patient with a pituitary incidentaloma // J Clin Endocrinol Metab. 1995; 80: 1: 3–6.
- Thapar К., Stefaneanu L., Kovacs K., Scheithauer B. W., Lloyd R. V., Muller P. J., Laws E. R. Jr. Estrogen receptor gene expression in craniopharyngiomas: an in situ hybridization study // Neurosurgery. 1994; 35 (6): 1012–1017.
- Reichlin S. In: Faglia G., Beck-Peccoz P., Ambrosi B., Travaglini P., Spada A. Pituitary adenomas: new trends in basic and clinical research // Elsevier. 1991; 113–121.
- Asa S. L., Kovacs K., Stefaneanu L. Pituitary adenomas in mice transgenic for growth hormone-releasing hormone // Endocrinology. 1992; 131: 2083–2089.
- Ezzat S., Melmed S. The role of growth factors in the pituitary // J Endocrinol Invest. 1990, 13: 691–698.
- 57-th Physicians’ Desk Reference, 2005, p. 2740–2742.
- Merino G., Carranza-Lira S., Martinez-Chequer J. C. Hyperprolactinemia in men with asthenozoospermia, oligozoospermia, or azoospermia // Arch Androl. 1997, 38 (3): 201–206.
- Saie D. J. Hyperprolactinemia presenting with encephalomalacia-associated seizure disorder and infertility: a novel application for bromocriptine therapy in reproductive endocrinology // Neuro Endocrinol Lett. 2005; 26 (5): 533–535.
- De Rosa M., Colao A., Di Sarno A., Ferone D., Landi M. L., Zarrilli S. Cabergoline treatment rapidly improves gonadal function in hyperprolactinemic males: a comparison with bromocriptine // Eur J Endocrinol. 1998, 138 (3): 286–293.
- De Rosa M., Ciccarelli A., Zarrilli S. The treatment with cabergoline for 24 month normalizes the quality of seminal fluid in hyperprolactinaemic males // Clin Endocrinol. 2006; 64 (3): 307–313.
- Vandekerckhove P., Lilford R., Vail A. Androgens versus placebo or no treatment for idiopathic oligo/asthenospermia // Cochrane Database Syst Rev. 2000; 2: CD00015.
- Ciccarelli A., Guerra E., De Rosa M., Milone F., Zarrilli S., Lombardi G., Colao A. PRL secreting adenomas in male patients // Pituitary. 2005; 8 (1): 39–42.
- Касумова С. Ю. Функциональная морфология аденом гипофиза. Дис. д.м.н. М., 1985, с. 360.
- Дедов И. И., Мельниченко Г. А. Персистирующая галакторея-аменорея. M., 1985; с. 166–180.
- Вакс В. В., Кадашев С. Ю., Касумова С. Ю. Отдаленные результаты послеоперационного лечения при «неактивных» аденомах гипофиза // Проблемы эндокринологии. 2001, № 1, с. 16–19.
- Abdel Gadir A., Khatim M. S., Mowafi R. S., Alnaser H. M. I., Alzaid H. G. N., Shaw R. W. Hormonal changes in patients with polycystic ovarian disease after ovarian electrocautery or pituitary desensitization // Clin Endocrinol. 1990, 32: 749–754.
- Kovacs K., Black P. M., Zervas N. T., Ridgway E. C. Secretory tumors of the pituitary gland // Raven Press, New York, 1985; 365–376.
- Кулаков В. И., Серов В. Н. Рациональная фармакотерапия. М., 2005, с. 587.
- Dos Santos Nunes V., El Dib R., Boguszewski C. L., Nogueira C. R. Cabergoline versus bromocriptine in the treatment of hyperprolactinemia: a systematic review of randomized controlled trials and meta-analysis // Pituitary. 2011.
- Шмаков Р. Г., Емельянова А. И., Полушкина Е. С. Современные аспекты подавления лактации // Лечащий Врач. 2009, № 11, с. 24–28.
А. С. Скотников М. А. Фельдман МГМСУ, Москва
Контактная информация об авторах для переписки
Избыток гормонов щитовидной железы
При гипертиреозе – усиленной работе щитовидной железы, усилены синтез и секреция Т3 и Т4, наблюдается увеличение размеров железы, экзофтальм (выпученные глаза).
Симптомы повышенного уровня гормонов щитовидной железы:
- — снижение веса при повышенном аппетите
- — общая слабость, утомляемость
- — перманентное возбуждение
- — нарушения менструального цикла, бесплодие
- — повышенная температура тела, иногда в определенные часы (36,9-37,5ºС)
- — сухая и дряблая кожа
- — учащенное сердцебиение и повышенное давление
- — чувства жара
- — ухудшение памяти и скорости реакции
Гипертиреоз наблюдается при таких заболеваниях щитовидной железы: болезни Базедова-Грейвса(диффузный токсический зоб), болезнь Пламмера (узловой токсический зоб), вирусном тиреоидите де Кервена, аутоиммунном тиреоидите Хасимото. Более редкими причинами повышения количества гормонов щитовидной железы являются избыточное потребление препаратов гормонов щитовидной железы для лечения (тироксин, эутирокс) или с целью похудения, при опухолях яичников и гипофиза, передозировке препаратов йода.
Что делать?
Для того чтоб определить качество работы щитовидной железы нужно сдать анализы на гормоны и антитела, а также сделать УЗ-исследование. Самыми главными гормонами в работе щитовидной железы является оценка уровней свободного Т4 и ТТГ. УЗИ покажет строение железы, её размеры и объем, позволит выявить узлы, кисты.
Для предупреждения болезней щитовидной железы стоит обеспечить поступление с пищей достаточного количества йода и тирозина. Йод содержится в йодированной соли и подсолнечном масле, морской водоросли ламинарии, рыбе (сельдь, камбала, треска, палтус, тунец, лосось), крабах, креветках, кальмарах и других морепродуктах, фейхоа. Источники тирозина — молоко, горох, яйца, арахис, фасоль. Полноценное и сбалансированное питание обеспечивает баланс гормонов щитовидной железы и предупреждает её заболевания.
Будьте здоровы!