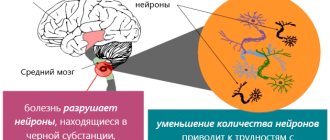
Болезнь Паркинсона — заболевание нервной системы прогрессирующего характера, при котором разрушаются нейроны головного мозга, регулирующие двигательную функцию. Точная причина патологии пока неизвестна, но врачи предполагают, что центральную роль играют наследственная предрасположенность, возрастные изменения и влияние химических веществ.
Основные симптомы — тремор (дрожание) рук и головы, нарушение речи и мимики, изменение походки, скованность движений, на последних стадиях проявляется слабоумие. Характерной особенностью прогрессирующей болезни Паркинсона — развитие у пожилых людей депрессии.
Общая информация
Болезнь Паркинсона вдвое чаще поражает мужчин, чем женщин. В большинстве случаев она развивается после 60 лет, но регистрируются случаи раннего начала заболевания (в 30-40 лет), а также ювенильные формы, развивающиеся у двадцатилетних людей.
Существует несколько гипотез формирования патологии. В настоящее время точно доказано, что одним из механизмов ее развития является постепенная дегенерация нейронов и снижение выработки дофамина. Это важный нейромедиатор, участвующий в передаче нервных импульсов. В результате формируется специфический комплекс нарушений, который позволяет легко поставить диагноз.
Результаты
Цянь и коллеги обнаружили, что истощение запасов PTB1 в астроцитах стимулирует их трансформацию в нейроны. Результат такой трансформации зависит от области мозга, в которой находятся целевые астроциты. Обнаружено, что астроциты в среднем мозге синтезируют низкие уровни факторов транскрипции Lmx1a и Foxa2. Эти факторы являются маркерами предшественников дофаминергических нейронов во время развития среднего мозга. Однако истощение белка PTB1 усиливало продукцию этих факторов транскрипции в астроцитах среднего мозга. С другой стороны, воздействие на корковые астроциты приводило к увеличению синтеза факторов транскрипции, характерных для корковых нейронов.
Спустя 4 недели после воздействия на астроциты in vitro 50–80% клеток стали морфологически похожи на нейроны и дали положительный результат на нейронные маркеры TUJ1 и MAP2.
При экспериментах in vivo спустя 3 недели после введения shPTB около 20% клеток, получивших красный флуоресцентный белок, синтезировали маркер нейронов NeuN. После 10 недель было уже около 80% клеток с NeuN. При этом клетки переставали продуцировать GFAP — белок, присутствующий в астроцитах.
Спустя 12 недель 30–35% этих клеток трансформировались в дофаминергические нейроны. Другими словами, перепрограммирование астроцитов помогло восстановить более 600 погибших дофаминергических нейронов (рис. 4).
Рисунок 4. Мозг мыши с «односторонней» болезнью Паркинсона. Сверху — до репрограммирования с помощью shPTB. Снизу — после. Зеленым показаны дофаминергические нейроны.
One-Time Treatment Generates New Neurons, Eliminates Parkinson’s Disease in Mice
Более того, новоиспеченные нейроны стали активно производить дофамин. Воздействие 6-OHDA привело к снижению уровня нейромедиатора до 25% от нормальных показателей. После терапии концентрация дофамина поднялась до 65% нормального уровня.
Причины
Точные причины возникновения болезни Паркинсона не выявлены. Ученые смогли определить лишь ряд факторов, повышающих риск развития нейродегенеративных процессов:
- естественные процессы старения организма, сопровождающихся снижением способности тканей к регенерации;
- генетическая предрасположенность (это особенно актуально для форм с ранним началом);
- хроническая нехватка витамина Д, защищающего нейроны от патологического воздействия токсинов;
- интоксикация солями тяжелых металлов, пестицидами, алкоголем;
- плохая экологическая обстановка в регионе проживания;
- прием некоторых лекарственных средств (например, хлорпромазин);
- хроническая недостаточность кровоснабжения головного мозга (на фоне атеросклероза, остеохондроза шейного отдела позвоночника и т.п.);
- инфекции, поражающие центральную и периферическую нервную систему (менингит, энцефалит, герпесвирусы, грипп);
- опухоли головного мозга;
- черепно-мозговые травмы;
- курение;
- частые и длительные стрессы, хроническая усталость.
Записаться на прием
Астроциты — возможное лекарство?
В последнее время было опубликовано несколько научных работ по превращению различных клеток в дофаминергические нейроны. В основном, исследователи останавливали свой выбор на астроцитах — клетках, поддерживающих жизнедеятельность нейронов. Свое название они получили за характерную звездчатую форму (рис. 2). В обязанности этих клеток входит обеспечение метаболических потребностей нейронов, участие в своевременном высвобождении нейротрансмиттеров из нервных окончаний, запас питательных веществ и регуляция активности нейронов.
Рисунок 2. Вспомогательные клетки нервной системы — астроциты. В норме они обеспечивают жизнедеятельность нейронов, но воздействуя на молекулярные процессы, протекающие в астроцитах, можно добиться их «превращения» в нейроны любого типа.
Human Astrocytes
Но больше всего ученых интересует их репаративная функция. В 2014 году группа ученых из Лундского университета и Каролинского института обнаружила, что при повреждении нервной ткани после инсульта астроциты способны замещать погибшие нейроны [12]. При этом у них «выключается» сигнальный путь Notch1, имеющий ключевое значение в процессах пролиферации и дифференцировки клеток. В здоровом головном мозге этот путь активен и блокирует превращение астроцитов в нейроны. Однако после инсульта этот механизм подавляется, и астроциты могут начать трансформироваться в нейроны.
Идея для исследования, проведенного группой из Калифорнийского университета, не нова. Еще в 2021 году группа шведских ученых с помощью вирусных векторов превратила человеческие астроциты в нейроны in vitro. После этого трансформировали и мышиные астроциты, но уже in vivo. Для репрограммирования они использовали три транскрипционных фактора (NEUROD1, ASCL1 и LMX1A) и микроРНК miR218 [13]. Трансформация астроцитов in vitro была улучшена с помощью молекул, способных провоцировать перестройку хроматина и активировать несколько сигнальных путей.
Однако в исследовании 2021 года предлагается куда более простой метод перепрограммирования астроцитов: достаточно просто заблокировать производство одного-единственного белка.
Симптомы
Болезнь Паркинсона проявляется специфическими признаками, которые в комплексе составляют четкую картину заболевания:
- тремор: мелкое дрожание начинается с одной руки и затем распространяется на обе конечности и голову; движение пальцев чем-то напоминают счет монет; во время выполнения целенаправленных движений (например, во время работы за компьютером);
- общая замедленность движений (брадикинезия): пациент нередко застывает в одной позе;
- специфическая походка: человек передвигается мелкими, шаркающими шагами, как будто постоянно находится на очень скользком льду;
- обедненность мимики: формируется эффект маски из-за низкой подвижности мимической мускулатуры;
- монотонная, тихая речь;
- повышенный тонус мускулатуры (мышечная ригидность): фигура становится сутулой, руки и ноги слегка согнуты, голова склонена вперед;
- постуральная неустойчивость: у человека возникают затруднения с началом и окончанием движения, в результате чего способность удерживать равновесие снижается;
- нарушения работы вегетативной нервной системы: жирность кожи, избыточное выделение слюны и пота;
- снижение обоняния;
- запоры, нарушения мочеиспускания.
В отличие от других нейродегенеративных заболеваний, болезнь Паркинсона почти не влияет на интеллект на ранней и средней стадии развития. По мере прогрессирования патологии отмечается снижение скорости мышления и разговора, снижение настроения, депрессия и безучастность ко всему происходящему.
Как развивается заболевание
Существует пять основных стадий развития болезни Паркинсона.
- Первая. Болезнь выражается слабым тремором конечностей. Это состояние не мешает человеку вести полноценный, привычный образ жизни, однако в некоторых случаях он может испытывать дискомфорт.
- Вторая. Дрожание рук и ног усиливается. На второй стадии пациент по-прежнему в состоянии вести обычную жизнь, но уже с небольшими ограничениями.
- Третья. На фоне прогрессирующих симптомов отмечается сильный тремор, у больного наблюдается потеря координации в пространстве. Но даже в этом состоянии человек не теряет навыка самообслуживания, при том что его движения значительно замедляются, и он быстро устает.
- Четвертая. Отмечаются серьезные двигательные и речевые нарушения. Больной может обслуживать себя частично, поэтому ему требуется помощь посторонних. На четвертой стадии заболевания происходит поражение лицевых мышц, что приводит к потере мимики. Также на этом этапе возможно появление проблем с мочевым пузырем.
- У больного человека наблюдается полная потеря движений. Для пятой стадии характерно стремительное развитие такого отклонения, как нарушение памяти. У больного могут возникать галлюцинации. Пациенту, находящемуся в этом состоянии, необходим постоянный уход. Лучше всего, чтобы такой больной находился на стационарном лечении.
Болезнь Паркинсона является заболеванием прогрессирующего типа, поэтому переход от одной формы к другой происходит достаточно стремительно. В каждом отдельном случае это зависит от индивидуальных особенностей организма пациента. Степени развития недуга также бывают разными:
- болезнь находится на одной стадии в течение длительного времени: иногда прогрессирование отсутствует более 10 лет;
- умеренный темп развития характеризуется переходом на новую стадию в течение 5 лет;
- стремительный переход в более тяжелую форму, который происходит за 1,5—2 года.
Благодаря современным методикам лечение и уход при болезни Паркинсона помогает значительно замедлить прогрессирование недуга. Опытные медики способны определить возможные отклонения, что также позволяет делать терапию более эффективной.
Стадии развития
В настоящее время врачи выделяют 5 стадий болезни Паркинсона, проявляющиеся определенным комплексом симптомов:
- 0 стадия: отсутствие клинических проявлений;
- 1 стадия: появляются небольшие затруднения движения одной руки, небольшой тремор сначала при волнении, затем в покое; нарушаются обоняние и сон, появляется усталость и апатия;
- 2 стадия: нарушения захватывают вторую руку, появляется дрожание языка и нижней челюсти; слюнотечение; формируется гипокинезия; способность к самообслуживанию сохраняется;
- 3 стадия: скованность и обеднение движений нарастает, мимика почти отсутствует; формируется специфическая походка и поза; во время разговора больной начинает застревать на одном и том же слове; самообслуживание затруднено, но возможно;
- 4 стадия: формируется постуральная неустойчивость, больной начинает часто падать; начинает страдать интеллект, нарастает депрессия; в это время нередки попытки суицида; человеку требуется помощь для выполнения простейших действий;
- 5 стадия: проявления достигают апогея, человек не может самостоятельно садиться, вставать и ходить, прием пищи затруднен из-за нарушений глотания; утрачивается контроль над дефекацией и мочеиспусканием; больной требует постоянного ухода.
Диагностика
Диагноз болезни Паркинсона ставится на основании характерной клинической картины. Пациента осматривает невролог, который отмечает типичные признаки. В обязательном порядке уточняются жалобы, собирается анамнез заболевания (история появления признаков) и жизни (сведения о перенесенных травмах, хронических заболеваниях, хирургических вмешательствах). Лабораторная и инструментальная диагностика используется для уточнения сопутствующей патологии и исключения других причин неврологических нарушений.
Лечение болезни Паркинсона
В настоящий момент успешно подобранное лечение болезни Паркинсона может приостановить процесс деградации и снизить выраженность патологической симптоматики. Болезнь начинает прогрессировать медленнее, что позволяет пациентам дольше оставаться в хорошей форме.
Медикаментозное лечение
Медикаментозное лечение направлено на восстановление баланса дофамина в центральной нервной системе. Используются следующие препараты:
- леводопа и ее аналоги: служат основой для выработки дофамина;
- агонисты дофаминовых рецепторов: стимулируют рецепторы аналогично природному нейромедиатору и снижают выраженности симптоматики;
- ингибиторы МАО-В: уменьшают расщепление дофамина;
- ингибиторы КОМТ: назначаются в комбинации с леводопой и уменьшают ее распад;
- холиноблокаторы: направлены на снижение симптоматики.
Существуют комбинированные средства, сочетающие несколько действующих веществ для максимально быстрого эффекта.
Немедикаментозное лечение
Медикаментозное лечение дополняется физиотерапией, ЛФК и массажем. Физиотерапия используется для активации процессов метаболизма и усиления кровотока в головном мозге. В зависимости от состояния пациента и сопутствующих заболеваний могут быть назначены:
- магнитотерапия;
- ультразвуковая стимуляция;
- электросон;
- минеральные ванны;
- иглорефлексотерапия.
Массаж направлен на улучшение двигательной активности. Интенсивное разминание мускулатуры и пассивная гимнастика снижает ригидность мышц и обладает общеукрепляющим действием.
Упражнения лечебной физкультуры позволяют:
- уменьшить ригидность мускулатуры и укрепить ее;
- повысить чувство баланса;
- улучшить эмоциональное состояние пациента.
Большинство упражнений направлены на тренировку чувства равновесия. Комплекс подбирается индивидуально в зависимости от состояния пациента, его возраста и сопутствующих заболеваний.
Хирургическое лечение
Помощь хирургов актуальна на последних стадиях развития заболевания. Наиболее эффективной и безопасной операцией является установка стимулятора головного мозга. Вмешательство не требует вскрытия черепной коробки. В мозг вводятся тонкие электроды, а под кожу ключицы помещается небольшой стимулятор. Прибор программируется на определенную частоту импульсов, кроме того, больной и его родственники могут менять настройки в зависимости от состояния. Использование стимулятора позволяет сократить дозировку препаратов и длительное время держать симптоматику под контролем.
Другие варианты хирургического лечения требуют работы на открытом мозге:
- таламотомия: разрушение части таламуса, позволяющее избавиться от дрожания, но сохраняющее другую симптоматику;
- паллидотомия: частичное устранение одного из участков мозга (бледный шар), существенно снижающее все основные симптомы патологии.
Одно из наиболее значимых двигательных нарушений у пациентов с болезнью Паркинсона (БП) — нарушение ходьбы. Именно его выраженность в значительной степени определяет тяжесть состояния и качество жизни больного. В результате многочисленных отечественных и зарубежных исследований [1-5] установлено, что нарушение ходьбы является самостоятельным проявлением БП, имеющим особый патогенез, требующим специфического подхода к коррекции, и которое, вероятно, может считаться пятым кардинальным признаком паркинсонизма наряду с гипокинезией, ригидностью, тремором покоя и постуральными расстройствами.
Нарушения походки у пациентов с БП в начале заболевания зависят от гипокинезии и ригидности. В результате наблюдается замедленная инициация ходьбы, снижение ее скорости и уменьшение величины шага (микробазия). Походка становится шаркающей, при этом больной почти не отрывает ног от пола, возникает «семенящий» шаг. Нарушение позы при БП возникает в результате постоянной флексии шейного отдела позвоночника и формирования «согбенной» установки туловища с кифозом. При ходьбе туловище может еще больше наклоняться вперед. Чтобы сохранить равновесие и избежать падения, больные, пытаясь «догнать» центр тяжести тела, вынуждены постепенно ускоряться (пропульсия). У части больных наблюдаются ретро- и латеропульсии. Довольно часто при БП встречается феномен застывания при ходьбе (англ
.: freezing). По мере прогрессирования БП застывания могут встречаться чаще и становиться более продолжительными, что значительно нарушает ходьбу.
Роль постуральной неустойчивости особенно значительна на поздней стадии заболевания, когда смещение центра тяжести больного не вызывает компенсаторных движений туловища и конечностей, что ведет к падениям [3, 6, 7].
Выделяют три типа гипокинезии при паркинсонизме [8]. Первый тип — вторичная замедленность (вторичная акинезия), обусловленная мышечной ригидностью и проявляющаяся нарушением реципрокных и быстрых повторяющихся движений (ахейрокинез, трудности попеременной пронации-супинации). При втором типе отмечается обеднение тонких и автоматизированных движений, которое не зависит от выраженности мышечной ригидности (первичная акинезия). Эти два типа гипокинезии поддаются лечению препаратами леводопы. Третий тип характеризуется отсутствием побуждений к действиям и проявляется трудностями начала движения (инициация ходьбы). Лечение пр епаратами леводопы не только не уменьшает, но даже может привести к нарастанию выраженности этого феномена, в большей степени зависящего от дисфункции недофаминергических механизмов [5, 9, 10].
Снижение общей активности в сочетании с кифотической установкой позвоночника и общей гипокинезией, как правило, приводит к дыхательным расстройствам.
Проблемы диагностики нарушений ходьбы при БП.
Механизмы развития нарушений ходьбы при различных заболеваниях и возможности их компенсации, а также динамика изменений нарушений походки и оценка результатов терапии предполагают развитие инструментальных методов анализа ходьбы [11]. Для регистрации пространственных характеристик шага используются различные ихнометрические методики. В настоящее время наиболее распространен достаточно трудоемкий импрегнационный метод ихнометрии, заключающийся в ручном измерении расстояния между отпечатками стоп на бумажной полосе [12, 13]. Неудобны и механические методы ихнометрии с использованием чернильных самописцев, прикрепляемых к обуви. Оптоэлектронные методы сложны в использовании и дорогостоящи. Более доступны электрические методы ихнографии, однако большинство из них требует использования специальной обуви либо соединения при помощи кабеля закрепленных на обуви пациента электродов и считывающего устройства, что изменяет стереотип ходьбы и отражается на конечных результатах исследования [14-17]. В связи с этим чрезвычайно актуальны задачи создания простого, но достаточно информативного метода регистрации ходьбы, выбора критериев оценки походки с целью более полного понимания ее механизмов в норме и патологии.
Для объективизации параметров ходьбы авторами совместно с опытно-конструкторским бюро Горно-химического комбината Железногорска Красноярского края было создано устройство для определения шагоскоростных характеристик человека (УОШХЧ)1. Это контактная дорожка длиной 10 м с электрическими датчиками, реагирующими на замыкание специальным самоклеющимся контактным диском из алюминиевой фольги диаметром 5 мм. В симметричные точки обуви испытуемого прикрепляют по одному контактному датчику. При ходьбе происходит замыкание контактов, соответствующая информация поступает в блок компьютерного преобразования данных, что позволяет анализировать длину каждого шага, время, затраченное на шаг, частотное распределение различных длин шагов, скорость движения человека, а также сохранять и статистически обрабатывать полученные данные. К достоинствам УОШХЧ следует отнести использование обследуемым привычной обуви и отсутствие влияния на походку контактного датчика, а также быстроту и удобство сохранения данных в электронной форме.
Типичные графики результатов обследования здоровых молодых, здоровых пожилых пациентов с ПБ представлены на рис. 1. Из представленных графиков видно, что для здоровых молодых характерна значительная стандартность походки (соответственно малая вариабельность длины шага) с небольшими колебаниями относительно среднего показателя. В результате график имеет форму пирамиды с узким основанием. У здоровых пожилых основание данной пирамиды расширяется ввиду большего разброса длины шагов (большая вариабельность длины шага). У пациента с БП объективизируется термин «семенящая походка», с топтанием на месте и явлениями моторных флюктуаций в виде застываний, что проявляется большим количеством шагов минимальной длины.
Рис. 1. Типичные графики результатов обследования. а — здоровые в возрасте 19-29 лет; б — здоровые в возрасте 56-75 лет; в — пациенты с Б.П. Здесь и на рис. 2: по оси абсцисс — длина шага (см), по оси ординат — частота.
Другим подходом диагностических оценок является формализация и стандартизация обследования без использования специальных устройств. Например, исследуется время прохождения определенного расстояния или, наоборот, определяется расстояние, пройденное за единицу времени.
Методы темпоритмовой коррекции ходьбы (ТРКХ)
Уже с XIX века известен феномен парадоксальных кинезий, который заключается в уменьшении олигобрадикинезии под влиянием периодизации времени (звучание марша, ритмические команды и т. д.) либо пространства (ступеньки, пол с контрастными половицами и т. д.) [9, 18, 19]. Проводились попытки улучшить ходьбу больного при помощи данных методов. Так, описывался положительный эффект ходьбы больных под музыку, заключающийся в увеличении длины шага [20, 21]. Методика динамической зрительной афферентации [7] также показала существенную эффективность, однако ее внелабораторное применение в настоящее время затруднено. Проведенные метаанализы показали, что звуковая стимуляция более эффективна в сравнении со зрительной в отношении восстановления ходьбы, поскольку влияет не только на длину шага (как зрительная), но и ее скорость и ритм [22-25]. Кроме того, аудиостимуляция более доступна для последующего применения с целью поддержания положительного эффекта [25, 26].
M. Thaut и соавт. [21] предлагали использовать единую частоту подаваемых звуковых сигналов (звук метронома, записанный поверх музыки в базовом режиме и ускоренный на 10%) для коррекции нарушений ходьбы у пациентов с БП, что не учитывало индивидуальные особенности пациентов и степень нарушения походки. В исследовании участвовал всего 21 пациент с II-IV стадиями заболевания по Хену-Яру. Это, очевидно, несколько размывает результаты исследования, не позволяя полноценно изучить эффективность терапии на разных стадиях заболевания. Авторы оценивали результаты коррекции в периоды как включения, так и выключения. Существенным отличием от большинства других работ является объективизация ходьбы с размещением меток на четырех точках каждой стопы при помощи компьютеризированной установки, что значительно повышает достоверность данных. В целом была продемонстрирована относительно небольшая эффективность использованного метода лечения. Также авторы констатировали, что простое изменение длины шага недостаточно для существенного улучшения ходьбы.
По нашему мнению, особое внимание при восстановительном лечении нарушений ходьбы при паркинсонизме должно быть обращено на индивидуальные возможности больного поддерживать различные темпы ходьбы, их динамическую корректировку в зависимости от стадии заболевания и схем приема лекарственных препаратов, опирающихся на количественную регистрацию параметров шага в процессе лечения [25-27].
Нами был разработан и внедрен в практику способ лечения нарушений ходьбы при паркинсонизме, заключающийся в использовании ТРК, основанный на принципе РБ2. После детального исследования параметров ходьбы больных тестировали для подбора индивидуальной частоты внешней стимуляции, которая осуществлялась следующим образом: пациенту предлагалось пройти под заданную звуком частоту в диапазоне от 40 до 120 сигналов в 1 мин (каждое последующее прохождение проводилось с увеличением частоты на 5 сигналов в 1 мин), синхронизируя шаги со звуковым сигналом. Если больной не был способен при повышении частоты синхронизировать шаг со звуковым сигналом, тестирование прекращалось. Исследование проводилось на УОШХЧ с определением линейных параметров ходьбы. Визуально оценивалось изменение двигательного стереотипа ходьбы, проводился контроль адекватности физической нагрузки с определением частоты сердечных сокращений и артериального давления больного. Оптимальным считался ритм, при котором длина шага была наибольшей при меньшем количестве шагов и комфортном самочувствии больного. В течение курса лечения индивидуально подобранный оптимальный ритм звуковых сигналов записывался на аудиокассету, которую больной мог использовать при ходьбе с помощью портативного аудиоплеера и наушников. Для записи оптимальной частоты (ОЧ) с последующим использованием на занятиях с больными применялись флеш-плейер и разработанное нами электронное устройство для тренировки движений3.
Занятия по корректировке ходьбы с синхронизацией шага под ОЧ проводили ежедневно по 5-20 мин от 3 до 6 раз в день в зависимости от состояния больного. Таким образом, во время синхронизированной с темпом звуковой стимуляции ходьбы изменялся двигательный стереотип патологической походки, который, однако, быстро угасал при самостоятельной ходьбе в произвольном темпе без подкрепления экзогенной стимуляцией. С целью закрепления достигнутого эффекта пациентам выдавалась аудиокассета с записанной на ней ОЧ, которую они применяли при ходьбе с использованием аудиоплеера и наушников. ОЧ записывали также на флеш-плейере больных или выдавали разработанное нами устройство для тренировок ходьбы, которое пациенты использовали в повседневной жизни (при ходьбе по квартире, прогулках на улице и т. д.).
По нашим наблюдениям, у некоторых пациентов с БП эффект от использования звуковой стимуляции с ОЧ в отношении резкого увеличения длины шага оказался сопоставим с эффектом действия препаратов леводопы. Приводим графики результатов оценки ходьбы больного БП III стадии в свободном темпе и синхронизированной с ОЧ подаваемых звуковых сигналов (рис. 2). Результаты также представлены в табл. 1 и 2.
Таблица 1. Результаты исследования ходьбы у пациентов с БП II стадии по Хену-Яру Примечание. КВШ — коэффициент вариабельности шага, СДШ — средняя длина шага (см).
Таблица 2. Результаты исследования ходьбы у пациентов с БП III стадии по Хену-Яру
Рис. 2. Результаты обследования пациента М., с БП III стадии по Хену-Яру. а — в режиме свободного темпа; б — в режиме ходьбы, синхронизированной со звуковыми сигналами, подаваемыми с ОЧ.
Было установлено, что метод ТРКХ, использованный в схемах лечения пациентов с БП II стадии по Хену-Яру, показал более высокую эффективность в восстановлении походки, чем в группе сравнения. Положительная динамика показателей ходьбы (СДШ, КВШ) превзошла таковые у больных с БП со II стадией по Хену-Яру, в лечении которых применялись только антипаркинсонические препараты. Нарушения ходьбы у пациентов с БП с III стадией по Хену-Яру оказались более выраженными по сравнению с больными со II стадией. В связи с этим потребность в восстановлении ходьбы у этих пациентов была значительно выше. Положительный эффект от применения ТРКХ у больных с БП III стадии также оказался значительно выше по сравнению с получавшими антипаркинсонические препараты.
Подбор стимулов проводился и в других исследованиях, в частности была предпринята попытка улучшить качество ходьбы у пациентов с ранними стадиями БП, используя ТРКХ с аудиосигналом, который подбирался индивидуально [28]. Для этого пациент проходил с комфортной для него скоростью расстояние в 9 м 15 раз, среднее значение ритма вычислялось (авторы не указывают, какие методы объективного контроля использовались), и в дальнейшем пациенту предлагалось ходить с использованием заданных ритмов. Ценность работы снижает малое количество (11 человек) обследованных и невозможность экстраполяции полученных данных на пациентов с поздними стадиями Б.П. Это связано с тем, что в моменты выраженной гипокинезии ритм пациента может быть очень низким, и его увеличение навряд ли существенно изменит ходьбу. На наш взгляд, недостатком работы является недооценка других параметров ходьбы.
Альтернативным вариантом ТРКХ является использование специального устройства, задающего ритм движения пациенту посредством слабых электрических импульсов, попеременно (чередуя левую и правую ногу) раздражающих кожу и вызывающих слабое мышечное сокращение4. Устройство крепится на пояс пациента, электроды устанавливаются на переднюю поверхность обоих бедер (по одному на каждую ногу). Индивидуально задается сила раздражения,
которая определяется субъективными ощущениями: должно возникать отчетливое ощущение прохождения сигнала и легкое напряжение мышц передней поверхности бедра. Раздражение не должно сопровождаться субъективными неприятными ощущениями. Затем задается ритм стимуляции в диапазоне от 60 до 110 импульсов в 1 мин с шагом в 5 импульсов в 1 мин (диапазон, отличный от такового при звуковой стимуляции, связан с техническими возможностями устройства). Электрические импульсы попеременно стимулируют правую и левую конечности. Пациенту предлагается синхронизировать шаги с подающимися стимулами. Тестирование прекращается, если больной не способен на синхронизацию при повышении частоты. Исследование проводилось на УОШХЧ, визуально оценивалось изменение двигательного стереотипа ходьбы, проводился контроль адекватности физической нагрузки с определением частоты сердечных сокращений и артериального давления больного. Оптимальным считался ритм с наибольшей длиной шага при меньшем количестве шагов и комфортном самочувствии.
Данная методика стимуляции использовалась у относительно небольшого числа пациентов с БП, однако в одном из моноцентровых исследований у пациентов с сосудистым паркинсонизмом (СП) с наличием активного (звуковая стимуляция) и пассивного (отсутствие воздействия) контроля было установлено значительное увеличение СДШ и уменьшение КВШ. Более подробно результаты представлены в табл. 3.
Таблица 3. Данные исходного состояния ходьбы в подгруппах СП Примечание. * — различия достоверны при сопоставлении с группой сравнения (р<0,01).
Эффективность обеих методик, на наш взгляд, следует связать с мобилизацией дополнительных компенсаторных механизмов в виде коркового контроля над ходьбой, реализуемого через премоторную кору, а также, возможно, дополнительного влияния мозжечковых путей, компенсирующего дисфункцию базальных ганглиев и связанной с ним дополнительной моторной коры. Одним из аргументов в пользу этой концепции является работа M. Mak и соавт. [29], показавших существенное ухудшение ходьбы по сравнению со здоровыми у пациентов с БП при отвлечении их внимания на вычисления, и, напротив, больший уровень положительных изменений (длина, скорость и ритм ходьбы) у пациентов с БП по сравнению со здоровыми при предъявлении аудиовизуальных стимулов. Ходьба существенно улучшалась при использовании как слуховых, так и зрительных стимулов, однако их сочетание не давало значительного увеличения эффекта ТРКХ [30]. Это может объясняться индивидуальным доминированием восприятия у пациента сигналов одного из типов либо элементами отвлечения внимания при использовании двух сигналов разного типа, что не позволяло суммировать положительный эффект.
В ходе простого слепого исследования на большой группе из 153 пациентов были получены данные о небольшом (порядка 4,2%), но достоверном урежении эпизодов «замораживания» ходьбы при применении методов, использованных A. Nieuwboer соавт. [31]. Сходные данные получены в результате исследования эффективности аудио- и визуальной стимуляции [32]. Значительный эффект на «замораживание» ходьбы (редукция на 10%) и более высокий уровень доказательности были продемонстрированы в одном из новейших исследований в данной области [10]. Оно носило дизайн рандомизированного перекрестного: в течение 2 нед опытная группа занималась ходьбой со стимуляцией индивидуально подобранной модальности (аудио, визуальная, тактильная — трость, ментальная — музыка), а группа сравнения не получала подобной терапии. Несмотря на относительно небольшую выборку (рандомизировано 23 пациента), результаты сомнений не вызывают, учитывая тщательно проработанный дизайн, жесткие требования по включению пациентов (скринирован 51) и грамотную статистическую обработку.
Методы ЛФК и эрготерапии в лечении БП
Тезис о пользе дыхательной гимнастики для пациентов с БП подтверждается данными работы R. Inzelberg и соавт. [33]. Пациенты были распределены в группу сравнения (ложная дыхательная гимнастика) и основную (дыхательная гимнастика). Достоверно лучшие результаты были в основной группе.
Рассматривая программы, направленные на упражнения для скелетной мускулатуры с позиций доказательной медицины, можно констатировать, что любые систематические занятия, включая самостоятельные домашние, оказывают положительное влияние на моторные функции [34]. Проведенный Cochrane Movement Disorders Group метаанализ (33 исследования, 1518 пациентов) полностью подтверждает значение занятий ЛФК по сравнению с их имитацией (или отсутствие вмешательства) в отношении скорости и длины шага, равновесия и моторных функций [35]. Систематические занятия под контролем специалистов ЛФК достоверно эффективнее, чем самостоятельные домашние, и оказывают положительное влияние на моторные функции (включая показатели шкалы UPDRS, оценка при помощи PDQ-39) и дневную активность (оценка по шкале NEADL) [36]. Применение специализированной программы занятий (ParkFit) у 540 пациентов с БП со сниженной двигательной активностью в рандомизированном контролируемом исследовании не показало существенного воздействия на активность по шкале LAPAQ, однако остальные вторичные точки оценки эффективности (включая дневник активности и 6-минутный тест ходьбы) продемонстрировали достоверное улучшение [37]. Подчеркнем, что исследование касается не просто пациентов с БП, но больных с пониженной моторной активностью. В отношении частоты падений существенного эффекта ЛФК не оказывает [35, 38]. Эрготерапия оказывает положительное влияние на качество жизни (оценка по PDQ-39), дневную активность (оценка по NEADL) [15].
Транскраниальная магнитная стимуляция (ТКМС)
После первых оптимистических единичных сообщений об использовании ТКМС для пациентов с БП появились работы, указывающие на низкую эффективность данного метода [39]. Видимо, проблема связана с подбором оптимального режима стимуляции, в первую очередь частоты воздействия и ее области: так, в указанном исследовании использовалась частота 50 Гц. В другом рандомизированном исследовании [40] имелись группа сравнения (имитация ТКМС) и две группы воздействия с частотой 10 и 1 Гц. Полученные данные свидетельствуют о достоверном улучшении (около 6,8 балла по шкале UPDRS) в группе, получавшей стимуляцию с частотой воздействия 1 Гц, тогда как стимуляция с частотой 10 Гц обладала гораздо меньшим и нестойким эффектом. В открытом неконтролируемом исследовании [25] была отмечена эффективность ТКМС с частотой 9 Гц в сочетании с фармакотерапией (галантамин) у пациентов с БП и деменцией. Интересно, что наблюдалась положительная динамика (повышение метаболизма соответствующих структур нервной системы) по данным позитронно-эмиссионной томографии.
Светотерапия (фототерапия)
Сеансы воздействия белого искусственного света 3300 люкс были эффективными в отношении моторных проявлений БП и эмоционального состояния больных [41]. Использование источника света в 5000 люкс сопровождалось достоверным уменьшением дневной сонливости и слабости у пациентов с БП по сравнению с группой плацебо (источник света в 300 люкс) [42]. Авторы связывают данные эффекты с оптимизацией циркадных циклов выработки мелатонина.
Транскраниальная микрополяризация (ТКМП)
Отечественные работы, касающиеся транскраниальной электрополяризации при БП, представляют интерес, ее применение сопровождается уменьшением гипокинезии [43]. Однако в этих работах нет четкого описания критериев включения пациентов, а также отсутствует элемент заслепления. ТКМП привлекает все большее внимание и зарубежных исследователей. Так, в рандомизированном исследовании с плацебо-контролем были показаны положительные эффекты в отношении улучшения ходьбы и уменьшения брадикинезии, хотя по шкале UPDRS четкого улучшения отмечено не было [39]. В другом пилотном исследовании отмечено существенное улучшение ходьбы при использовании ТКМП [44].
Изучение применения ментальных методик релаксации и аутотренинга не показало эффективности при БП [34]. Также не продемонстрирована эффективность применения общей вибрации (вибромассаж) [45]. В настоящее время обсуждают потенциальные возможности для дезагрегации патологического α-синуклеина для терапии БП с использованием лазеротерапии (фотоакустическая терапия), однако на настоящий момент не имеется данных, касающихся ее эффективности и безопасности.
В отдельных исследованиях показан положительный эффект акупунктуры (иглорефлексо-, апитерапия), однако метаанализы не подтверждают эти данные, в первую очередь вследствие малочисленности участников. Значительным недостатком данных исследований является сложность воспроизведения технологии, которая может значительно различаться у двух разных специалистов. В настоящее время имеется ряд моноцентровых простых рандомизированных и заслепленных исследований в известных центрах акупунктуры (преимущественно в Южной Корее и КНР), которые на малых группах пациентов продемонстрировали положительный эффект. Следует указать, что подавляющее большинство исследований проводилось при использовании акупунктуры в качестве дополнительного лечения к терапии препаратами леводопы. Имеются интересные результаты работ с оценкой не столько клинических конечных точек, сколько изменений в ходе инструментальных исследований. Так, по данным однофотонной эмиссионной компьютерной томографии, на фоне акупунктуры (в сочетании с терапией препаратами леводопы) по сравнению с пациентами на фоне только лекарственной терапии имелось достоверно большее регионарное изменение кровотока при одинаковой активности дофаминтранспортирующих систем [46]. Аналогичные результаты, касающиеся метаболизма мозга, получены при использовании позитронно-эмиссионной томографии [47]. По нашему мнению, окончательного ответа в отношении эффективности акупунктуры при БП не существует. Он может появиться только при должной стандартизации методик акупунктуры и проведении мультицентровых исследований по стандартным методикам.
Таким образом, поиски оптимальных методов нелекарственного воздействия при БП в настоящее время продолжаются с разной степенью успешности. Постепенно повышается уровень доказательной базы. Продолжение изысканий и выработка единых подходов к нелекарственной терапии БП имеет большое значение, принимая во внимание малую эффективность лекарственных средств для лечения немоторных симптомов и нарушений ходьбы. В плане восстановления ходьбы имеются обоснованные надежды в отношении методов ТРКХ.
Конфликт интересов отсутствует.
Патент на изобретение № 2321345, зарегистрирован в Государственном реестре изобретений РФ 10 апреля 2008 г.
Патент на изобретение № 2281695, зарегистрирован в Государственном реестре изобретений РФ 20 августа 2006 г.
Патент на изобретение № 2304997, зарегистрирован в Государственном реестре изобретений РФ 27 августа 2007 г.
Патент на изобретение № 2527170 «Способ лечения больных паркинсонизмом».
Осложнения
Ограничение работы мускулатуры при болезни Паркинсона неизбежно приводит к уменьшению интенсивности кровотока и снижению уровня обмена веществ. Уже на средних стадиях развития заболевания значительно повышается риск образования тромбов и развития опасных состояний:
- ишемический или геморрагический инсульт;
- инфаркт миокарда, стенокардия, сердечная недостаточность;
- тромбоэмболия легочной артерии.
Прикованные к постели пациенты нередко сталкиваются с тяжелыми осложнениями, связанные с лежачим положением:
- застойная пневмония;
- аспирационная пневмония (из-за нарушения глотания пища попадает в дыхательные пути);
- инфицирование пролежней и сепсис.
Большинство больных сталкиваются с апатией и сильной депрессией, которые влекут за собой суицидальные мысли. Некоторые пациенты осуществляют планы и кончают жизнь самоубийством.
Правильно подобранное лечение значительно снижает риск развития осложнений, вот почему важно своевременно обратиться к врачу.
Механизм трансформации астроцитов
В качестве мишени для репрограммирования астроцитов Цянь и коллеги выбрали РНК-связывающий белок PTB1 [14]. Этот белок синтезируется в астроцитах и ингибирует дифференцировку в нейроны. Снижение производства PTB1 вызывает продукцию его нейронного варианта nPTB1.
Сначала ученые провели трансформацию астроцитов in vitro. Астроциты выделили из среднего мозга и коры мыши и из коры человека. Исследователи использовали РНК-шпильку к гену Ptbp1, который кодирует белок PTB1. РНК-шпильки работают по принципу РНК-интерференции: они взаимодействуют с информационной РНК конкретного гена и вызывают ее деградацию, что приводит к неспособности клетки произвести белок. Уровень PTB1 в астроцитах упал, что привело к трансформации астроцитов в нейроны.
Затем исследователи перешли к экспериментам in vivo: они истощали запасы белка PTB1 в мозге мыши. Симптомы болезни Паркинсона у мышей были вызваны с помощью токсичного аналога дофамина, 6-OHDA, вызывающего гибель дофаминергических нейронов. Цянь и коллеги использовали трансгенных мышей, продуцирующих cre-рекомбиназу. Это позволяло нацелить вирусный вектор непосредственно на астроциты. Чтобы убедиться, что вирус достиг своей цели, в него встроили ген красного флуоресцентного белка. В составе вирусного вектора была маленькая РНК-шпилька (shPTB), которая блокировала ген Ptbp1. Такая стратегия также привела к преобразованию астроцитов в нейронные клетки и восстановлению двигательной активности (рис. 3).
Рисунок 3. Слева: астроциты мыши. Справа: нейроны, полученные в ходе репрограммирования астроцитов.
One-Time Treatment Generates New Neurons, Eliminates Parkinson’s Disease in Mice
Профилактика
Профилактика болезни Паркинсона включает:
- правильное питание с минимальным количеством консервантов и искусственных добавок, достаточным количеством витамина Д, омега-3, антиоксидантов;
- регулярные физические нагрузки для профилактики гиподинамии;
- полноценный сон не менее 8 часов в сутки, соблюдение режима труда и отдыха;
- минимизация стрессов и переутомления;
- отказ от курения и употребления спиртных напитков;
- регулярные медицинские осмотры, соблюдение всех рекомендаций врача;
- своевременное обращение к специалисту при появлении любых подозрительных симптомов.
Записаться на прием
Лечение в клинике «Энергия здоровья»
Неврологи клиники «Энергия здоровья» придут на помощь при любой стадии болезни Паркинсона. Мы предлагаем комплексное лечение в соответствии с современными стандартами:
- подбор медикаментозной терапии;
- физиотерапевтические процедуры: магнитотерапия, лазерное лечение и т.п.;
- курсы лечебного массажа;
- ЛФК непосредственно в клинике;
- обучение физическим упражнениям для занятий в домашних условиях;
- организация санаторно-курортного лечения при наличии показаний;
- обучение родственников правилам ухода за больным;
- работа с психологом и психиатром при необходимости.
Лечение народными средствами
В заключение следует упомянуть так называемые «народные средства от болезни Паркинсона». Сейчас различные немедикаментозные способы борьбы с данным заболеванием набирают популярность, в том числе благодаря некоторым недобросовестным источникам СМИ, в том числе псевдонаучным сайтам.
При решении использования всех этих рецептов, отваров, настоек и сборов следует учесть несколько моментов. Во-первых, следует помнить о том, что ни один из растительных препаратов не имеет доказательной базы. А во-вторых, существует такой простой метод как статистика. До изобретения современных методик терапии болезни Паркинсона больные, как упоминалось выше, обычно жили не более 10 лет. Тогда как сейчас продолжительность жизни значимо не отличается от нормальной. Все это говорит о том, что никакая «мудрость предков», «вековой опыт» не имел и не может иметь эффекта при лечении данного заболевания. Тогда как вред многие рецепты могут нанести.
Помните о том, что терапия болезни Паркинсона, методики подбора таблеток для лечения и их дозировок лежат в области компетенции врачей-неврологов. Не занимайтесь самолечением!
Преимущества клиники
Клиника «Энергия здоровья» — это опытные врачи, умелые медсестры и современное оборудование для диагностики и лечения различных заболеваний. Мы предлагаем:
- диагностику с использованием инструментальных, функциональных и лабораторных исследований;
- консультации опытных специалистов различного профиля;
- получение мнения зарубежных коллег при необходимости;
- индивидуальный подбор лечения;
- комплексные терапевтические схемы с использованием медикаментов, физиотерапии и других методов;
- обширные скрининговые программы для ранней диагностики заболеваний;
- подробные консультации по профилактике заболеваний;
- любые справки и заключения.
Болезнь Паркинсона начинается очень медленно, но остановить этот процесс практически невозможно. Если у Вас или Ваших родных появились подозрительные признаки, не затягивайте с обращением к врачу. Запишитесь на диагностику в клинику «Энергия здоровья».