1.Что такое экстрапирамидальные растройства?
Экстрапирамидные расстройства
представляют собой нарушения мышечного тонуса, что отражается на двигательной активности.
Движения могут быть навязчивыми, неконтролируемыми или, наоборот, невыполнимыми (хотя ранее не составляли никаких затруднений). Тяжесть этих нарушений варьирует от небольших тиков и парезов до постоянного дрожания или навязчивого произвольного сокращения группы мышц.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина №06 2001
Нейролептики, или антипсихотические средства, составляют одну из главных групп современных психотропных средств и занимают центральное место в клинической психофармакологии. К нейролептическим средствам относятся препараты различных химических групп, обладающие рядом общих психофармакологических свойств. Эти свойства были наиболее полно сформулированы J.Delay и P.Deniker (1961): 1) психолептическое действие без снотворного эффекта; 2) купирующее действие в отношении различных видов возбуждения, включая и маниакальное; 3) редуцирующее влияние на некоторые острые, хронические и экспериментальные психозы; 4) способность вызывать характерные неврологические и вегетативные нарушения; 5) преобладающее воздействие на подкорковые структуры ЦНС.
Позднее А.Carlsson и соавт. (1963–1987) показали, что особенности клинического действия нейролептиков обусловлены их общими нейрохимическими свойствами, заключающимися в способности избирательно блокировать дофаминовые Д2-рецепторы различных отделов мозга (стриатум, прилежащее ядро, кора мозга) с подавлением центральной дофаминергической передачи и развивающимся компенсаторно увеличением скорости биосинтеза и метаболизма дофамина в соответствующих структурах мозга. Развитие побочных неврологических эффектов классических нейролептиков связано с блокадой дофаминовых Д2-рецепторов в нигростриальной системе мозга. Главным отличием нейролептиков нового поколения (рисполепт, зипрекса и др.) является то, что они не вызывают или почти не вызывают экстрапирамидных побочных эффектов. Это свойство определяется спектром их нейрохимической активности. Атипичные нейролептики обладают избирательностью действия по отношению к мезолимбической и мезокортикальной дофаминергической системе мозга и менее выраженным влиянием на нигростриальную систему. Кроме того, атипичные нейролептики помимо блокады дофаминовых рецепторов одновременно блокируют 5НТ2-серотониновые рецепторы. Взаимоотношениям между блокадой дофаминовых и серотониновых рецепторов отводится важная роль в механизме действия атипичных нейролептиков (R.Baldessarini, 1987; H.Meltzer, 1989; F.Bamaster и соавт., 1997). Установлено, что блокада 5НТ2-серотониновых рецепторов приводит к компенсаторному повышению концентрации дофамина в нигростриальной системе и тем самым уменьшает выраженность экстрапирамидных побочных эффектов, обусловленных дофаминблокирующей активностью этих нейролептиков (C.Saller и соавт., 1990). В соответствии с американской классификацией DSM-IV все экстрапирамидные двигательные расстройства, связанные с приемом нейролептиков, можно разделить
на паркинсонизм, острую дистонию, острую акатизию
и
поздние дискинезии
. Критерии диагностики экстрапирамидных нейролептических расстройств по DSM-IV представлены в
табл. 1.Таблица 1.
Критерии диагностики паркинсонизма, вызванного приемом нейролептиков, по DSM-IV
А. Наличие одного или нескольких симптомов, появляющихся на фоне нейролептической терапии: 1) тремор (конечностей, головы, языка) 2) мышечная ригидность с пластическим повышением мышечного тонуса и симптомом «зубчатого колеса»
3) акинезия В. Симптомы группы А появляются в течение первых нескольких недель с момента начала нейролептической терапии или повышения дозы ранее принимаемых нейролептиков и уменьшаются после назначения антипаркинсонических корректоров С. Симптомы группы А не должны быть обусловлены психическим заболеванием (кататония, негативные симптомы шизофрении, двигательная заторможенность при большом депрессивном эпизоде и др.) D. Симптомы группы А не должны быть обусловлены другими препаратами, неврологическим или соматическим заболеванием (болезнь Паркинсона,болезнь Вилсона и др.)
Критерии диагностики острой дистонии (острой дискинезии), вызванной приемом нейролептиков, по DSM-IV
А. Наличие одного или нескольких симптомов, появляющихся на фоне нейролептической терапии: 1) неправильное положение головы и шеи по отношению к туловищу (ретроколлис, тортиколлис) 2) спазмы жевательных мышц (тризм, зевание, гримасничанье) 3) нарушение глотания (дисфагия), речи или дыхания (ларинго-фарингеальные спазмы, дисфония) 4) смазанная и затрудненная речь, обусловленная гипертонусом или увеличением языка (дизартрия, макроглоссия) 5) высовывание языка 6) спазмы глазодвигательных мышц (окулогирные кризы) В. Симптомы группы А развиваются в течение первых 7 дней с момента начала нейролептической терапии или повышения дозы ранее принимаемых нейролептиков и уменьшаются после назначения антипаркинсонических корректоров С. Симптомы группы А не должны быть обусловлены психическим заболеванием (например, кататоническая форма шизофрении) D. Симтомы группы А не должны быть обусловлены другими препаратами, неврологическим или соматическим заболеванием
Критерии диагностики острой акатизии, вызванной приемом нейролептиков по DSM-IV
А. Появление субъективных жалоб на беспокойство после назначения нейролептиков В. Наличие одного из следующих симптомов: 1) cуетливость, раскачивание 2) перетоптывание с ноги на ногу 3) постоянное хождение, чтобы облегчить беспокойство 4) невозможность сидеть или стоять спокойно в течение нескольких минут С. Симптомы группы А и В появляются в течение первых 4 нед с момента начала нейролептической терапии или повышения дозы нейролептиков и уменьшаются после назначения антипаркинсонических корректоров D. Симптомы группы А и В не должны быть обусловлены психическим заболеванием (психомоторным возбуждением при шизофрении, ажитированной депрессией, манией, синдромом гиперактивности и другими состояниями) Е. Симптомы группы А и В не должны быть обусловлены другими препаратами, неврологическим или соматическим заболеванием
Критерии диагностики нейролептической поздней дискинезии по DSM-IV
А. Непроизвольные движения языка, челюсти, туловища, конечностей, возникающие в связи с назначением нейролептиков В. Непроизвольные движения наблюдаются на протяжении не менее чем 4 нед и характеризуются следующими проявлениями: 1) хореиформные движения 2) атетоидные движения 3) ритмические движения (стереотипии) С. Симптомы группы А и В возникают в процессе нейролептической терапии или в течение 4 нед после отмены обычных и 8 нед после отмены депонейролептиков D. Длительность лечения нейролептиками должна составлять не менее 3 мес (1 мес, если возраст больного 60 лет и старше) E. Симптомы группы А и В не должны быть обусловлены неврологическим или каким-либо общесоматическим заболеванием (хореей Гентингтона, болезнью Вилсона, хореей Сиденгама и другими заболеваниями), а также назначением других препаратов (L-допа, бромокриптин) F. Симптомы группы А и В не должны являться проявлением острой нейролептической дистонии (острой дискинезии)
Разные нейролептики обладают разной экстрапирамидной активностью. Установлено, что способность классических нейролептиков вызывать экстрапирамидные расстройства возрастает с известной закономерностью от алифатических к пиперазиновым производным фенотиазина и к бутирофенонам. При этом изменяется характер побочных экстрапирамидных эффектов – от преобладающего акинето-ригидного синдрома к гиперкинетическому и дискинетическому синдрому (Г.Я.Авруцкий, И.Я.Гурович, В.В.Громова, 1974). Атипичные нейролептики обладают дозозависимым эффектом в плане влияния на развитие экстрапирамидных расстройств.
В среднетерапевтических дозах рисполепт и зипрекса вызывают появление экстрапирамидных симптомов с той же частотой, что и плацебо. По мере увеличение дозировок (рисполепт более 6 мг/сут и зипрекса более 10 мг/сут) частота развития экстрапирамидных побочных эффектов превышает плацебо, но значительно уступает галоперидолу (J.Peuskens, 1992; F.Muller-Spahn, 1992; D.Сasey, 1997). Исключение, по нашим данным, могут представлять больные шизофренией с явлениями резидуальной церебральной органической недостаточности, у которых даже невысокие дозы препаратов могут вызывать появление экстрапирамидных расстройств. Сравнительная характеристика экстрапирамидных побочных эффектов нейролептиков представлена в
табл. 2.Нейролептический паркинсонизм
возникает более чем в 50% случаев при лечении классическими нейролептиками в течение первых недель с момента начала нейролептической терапии или повышения дозы ранее принимаемых нейролептиков и характеризуется появлением общей скованности с характерной позой с согнутыми в локтях и приведенными к туловищу руками, тремором конечностей, акатизией и сопровождающими их вегетативными нарушениями (сальностью лица, потливостью, себореей). Мышечный тонус повышен по пластическому типу с симптомом «зубчатого колеса». Могут наблюдаться различные гиперкинезы, которые не являются стойкими.
Лечение.
Как правило, экстрапирамидная симптоматика редуцируется после назначения антипаркинсонических корректоров – циклодола, акинетона и др. (
табл. 3
). У больных с резидуальной церебральной органической недостаточностью экстрапирамидная симптоматика может приобретать затяжное течение – «затяжной экстрапирамидный синдром» по И.Я.Гуровичу (1971). В этих случаях назначают высокие дозы антипаркинсонических корректоров в сочетании с ноотропами, уменьшают дозу принимаемых нейролептиков, назначают препараты с минимальной экстрапирамидной активностью (
см. табл. 2
). Наши исследования показали, что при тяжелом, затяжном течении экстрапирамидного нейролептического синдрома эффективным является проведение экстракорпоральных методов детоксикации –
плазмафереза
и
гемосорбции
.
Таблица 2. Сравнительная характеристика экстрапирамидных побочных эффектов нейролептиков (по данным литературы и собственного опыта применения препаратов)
| Препарат | Паркинсонизм | Гиперкинетические проявления(тремор, гиперкинезы, акатизия) | Дискинезии |
| Алифатические производные фенотиазина | |||
| Аминазин(хлорпромазин) | ++ | + | + |
| Пропазин (промазин) | + | + | +- |
| Тизерцин (левомепромазин) | + | + | — |
| Терален (алимемазин) | + | + | +- |
| Пиперазиновые производные фенотиазина | |||
| Френолон (метофеназин) | + | + | + |
| Этаперазин (перфеназин) | ++ | + | + |
| Трифтазин (трифлуоперазин) | ++ | ++ | ++ |
| Мажептил (тиопроперазин) | ++ | +++ | +++ |
| Модитен (фторфеназин) | ++ | +++ | ++ |
| Метеразин (прохлорперазин) | ++ | ++ | ++ |
| Пиперединовые производные фенотиазина | |||
| Сонапакс (тиоридазин) | + | +- | +- |
| Неулептил (перициазин) | ++ | + | + |
| Пипортил (пипотиазин) | ++ | ++ | ++ |
| Производные бутирофенона | |||
| Галоперидол | ++ | ++ | ++ |
| Триседил (трифлуперидол) | +++ | +++ | ++ |
| Производные дифенилбутилпиперидина | |||
| Орап (пимозид)* | + | ++ | + |
| Имап (флушпирелен)* | + | + | ++ |
| Семап (пенфлюридол) | + | ++ | + |
| Производные дибензодиазепина | |||
| Лепонекс (клозапин)** | +- | +- | — |
| Оланзапин (зипрекса)** | +- | + | +- |
| Производные тиоксантена | |||
| Хлорпротиксен (труксал) | + | — | — |
| Клопиксол (зуклопентиксол) | ++ | + | + |
| Флюанксол (флупентиксол) | ++ | + | + |
| Тиотиксен (наван) | ++ | ++ | ++ |
| Замещенные бензамиды | |||
| Эглонил (сульпирид) | +- | + | — |
| Топрал (сультоприд) | ++ | ++ | + |
| Тиаприд (тиапридал) | + | + | + |
| Производные бензизоксазола | |||
| Рисперидон (риспердал)** | +- | + | +- |
| Примечание. Знаком (+) обозначена примерная выраженность эффекта при применении препарата в среднетерапевтических дозах; знаком (-) — отсутствие эффекта; * — в настоящее время препараты сняты с производства; ** — атипичные нейролептики практически не вызывают развития экстрапирамидных побочных эффектов и не приводят к существенному повышению пролактина в плазме крови, но могут вызывать увеличение массы тела и развитие отеков за счет гиперсекреции антидиуретического гормона. | |||
Острые дистонии
(или ранние дискинезии) возникают в 25–75% случаев в первые 7–10 дней с момента начала терапии классическими нейролептиками или повышения дозы ранее принимаемых препаратов и характеризуются внезапным появлением двигательных нарушений спастического тетаноформного характера. Моторные нарушения могут быть локальными и возникать в типичных областях, затрагивая изолированную группу мышц, или генерализованными, сопровождающимися общим моторным возбуждением с аффектами страха, тревоги, сужением сознания и вегетативными расстройствами (профузный пот, гиперсаливация, слезотечение, вазомоторные реакции и др.). При локальных дистониях возникают судороги языка, тризм, гиперкинезы мимической мускулатуры, спазмы взора (окулогирные кризы), кривошея, опистотонус, диспноэ и др. Описан также оральный синдром (Kulenkampff-Tarnow), который проявляется неожиданным тоническим сокращением мышц шеи, рта, высовыванием языка, нарушением фонации и дыхания. В некоторых случаях эти симптомы могут быть расценены как проявления эпилепсии или инфекционных заболеваний ЦНС (менингита, энцефалита и др.).
Лечение.
При развитии локальных дистоний наиболее эффективным является внутримышечное или внутривенное введение акинетона в дозе 5 мг (Г.Я.Авруцкий, Д.И.Малин, 1994). При отсутствии препарата дистонические реакции можно купировать аминазином – 25–50 мг внутримышечно и 2 мл 20% раствора кофеина подкожно (Г.Я.Авруцкий, И.Я.Гурович, В.В.Громова, 1974). При генерализованных дистониях показано одновременное назначение аминазина или тизерцина в дозе до 50 мг внутримышечно и антипаркинсонических корректоров (акинетона 5 мг внутримышечно). Острые дистонии можно купировать назначением диазепама (реланиума) 20 мг внутривенно медленно или внутримышечно. Для предупреждения повторного развития дискинезий назначают антипаркинсонические корректоры или увеличивают их дозу.
Акатизия
возникает в течение первых 4 нед с момента начала нейролептической терапии или повышения дозы нейролептиков и характеризуется появлением жалоб на беспокойство, неусидчивость, потребность двигаться, менять положение тела. Больные становятся суетливыми, перетоптываются с ноги на ногу, вынуждены постоянно ходить, для того чтобы облегчить беспокойство, не могут сидеть или стоять на месте в течение нескольких минут. Акатизия может сочетаться с нейролептическим паркинсонизмом. Описаны также редкие «поздние» случаи акатизии, при которых не наблюдается быстой реакции на назначение антипаркинсонических корректоров и уменьшение дозы нейролептиков. Эти случаи трудно отличить от поздних дискинезий (M.Munetz, C.Cornes, 1982).
Лечение.
Антипаркинсонические корректоры циклодол, акинетон и др. Эффективно также назначение транквилизаторов – диазепама, клоназепама, феназепама в среднетерапевтических дозах.
Поздние дискинезии
являются одними из наиболее тяжелых неврологических осложнений нейролептической терапии и развиваются у 20–30% больных, постоянно принимающих классические нейролептики. Частота развития поздних дискинезий у лиц молодого возраста, принимающих нейролептическую терапию в течение года, составляет 5%, у пожилых – 25–30%. При лечении атипичными нейролептиками (рисполепт, зипрекса) поздние дискинезии развиваются значительно реже. Так, согласно исследованиям P.Lemmens и соавт. (1999) при лечении рисполептом в течение года поздние дискинезии были отмечены у 0,23% больных. По данным DSM-IV, двигательные нарушения при поздних дискинезиях должны сохраняться на протяжении более чем 4 нед после отмены нейролептической терапии. Они могут возникать на фоне длительного приема нейролептических средств или появляться в течение первых 4 нед после отмены обычных нейролептиков и 8 нед после отмены нейролептиков пролонгированного действия. Клиническая картина этого осложнения характеризуется постепенным развитием разнообразных гиперкинезов (оральных, атетоидных, хореиформных, торсионно-дистонических) с тенденцией к их генерализации. В других случаях гиперкинезы могут появляться после внезапного прекращения приема нейролептиков. Часто гиперкинезы усиливаются в перерывах между курсами терапии, в то время как другие экстрапирамидные расстройства подвергаются обратному развитию. Одновременно с неврологическими стойкие изменения возникают и в психической сфере. Их совокупность описана как проявления психофармакотоксической энцефалопатии (И.Я.Гурович, Э.П.Флейс, 1969). Они характеризуются пассивностью больных, повышенной психофизической истощаемостью, аффективной неустойчивостью, замедлением интеллектуальных процессов, назойливостью, а также явлениями «истеризации» психики с тенденцией к демонстративному усилению имеющихся дискинезий.
Лечение.
При появлении первых признаков развития поздних дискинезий необходима отмена нейролептиков (при условии, что это позволяет сделать психическое состояние больного). В тех случаях, когда терапию прекратить нельзя, предпочтение следует отдавать атипичным нейролептикам (азалептину, рисполепту, зипрексе), при которых риск развития осложнения существенно ниже. Установлено, что в половине случаев поздние дискинезии проходят после прекращения приема препаратов. При этом после отмены нейролептиков дискинезии могут обостриться, а улучшение состояния во многих случаях наступает в течение нескольких месяцев (J.Kane, J.Smith, 1982). Для уменьшения дискинезий эфективным является применение антиоксиданта альфа-токоферола (витамина Е). В связи с наличием у многих больных церебральной органической недостаточности в схему терапии должны включаться препараты нейрометаболического действия (ноотропил, пикамилон, пантогам, фенибут и др.), методы общеукрепляющей и физиотерапии. Рекомендуется также баклофен 15–30 мг в сутки, вальпроат натрия 400–600 мг в сутки. Если дискинезии не исчезают, то больным назначают нейролептики в невысоких дозах – сонапакс 50–150 мг/сут, лепонекс 50–100 мг/сут. Наиболее эффективным является применение тиапридала 200–600 мг/сут. Рекомендуется также прием бензодиазепинов – диазепама 10–30 мг/сут, клоназепама 2–6 мг/сут. Применение антипаркинсонических корректоров с центральной холинолитической активностью при хроническом экстрапирамидном нейролептическом синдроме оказывается малоэффективным. Некоторое уменьшение выраженности дискинезий можно добиться при применении акинетона, который, по нашему мнению, по сравнению с другими антипаркинсоническими препаратами более эффективно действует на гиперкинетические проявления. Кроме того, наличие ампулированной формы позволяет использовать акинетон для парентерального – внутримышечного и внутривенного капельного введения, что усиливает терапевтический эффект (Г.Я.Авруцкий, Д.И.Малин, 1994). Некоторые авторы отмечают возможность усиления дискинезий при применении антихолинергических корректоров (T.Friis, J.Gerlach, 1983; W.Greil и соавт., 1984). Наши исследования показали,что антихолинергические корректоры оказывают положительный эффект, если одновременно с дискинезиями наблюдаются явления паркинсонизма в виде амиостатического симптомокомплекса с пластическим повышением мышечного тонуса. Предполагается, что развитие дискинезий связано с гиперчувствительностью дофаминовых рецепторов. Не исключено, что в этот процесс могут вовлекаться аутоиммунные механизмы. В последнее время было установлено, что аутоиммунный процесс может затрагивать непосредственно структуры дофаминовой системы на уровне дофаминовых рецепторов с образованием антирецепторных антител со стимулирующим и блокирующим действием (Г.И.Коляскина, Т.П.Секирина, 1990). С этих позиций теоретически оправданным может быть применение методов экстракорпоральной детоксикации, оказывающих детоксикационное и иммунокорригирующее действие. Результаты собственных исследований показали, что после проведения плазмафереза и гемосорбции одновременно с уменьшением двигательных нарушений наблюдается улучшение психического и общего физического состояния – уменьшение вялости, апатии, повышение активности, улучшение сна, аппетита. Таким образом, вместе с экстрапирамидной симптоматикой редукции подвергаются и проявления психоорганического синдрома.
Таблица 3. Лечение экстрапирамидных побочных эффектов нейролептиков
| Побочный эффект | Лечение |
| Паркинсонизм | Назначение антихолинергических |
| корректоров: | |
| циклодол 2-18 мг/с | |
| акинетон 2-24 мг/с | |
| тремблекс 0,25-0,5 (2-4 мл) | |
| внутримышечно | |
| бензотропин 3-9 мг/с | |
| Острая дистония | Акинетон 5-10 мг/с внутримышечно, |
| внутривенно | |
| Реланиум 10-20 мг внутримышечно, | |
| внутривенно | |
| При отсутствии акинетона аминазин | |
| 25-50 мг внутримышечно + 2 мл | |
| 20% раствора кофеина подкожно | |
| С целью профилактики увеличивают | |
| суточную дозу корректоров | |
| Акатизия | Антихолинергические корректоры |
| Транквилиизаторы — диазепам, клоназепам, | |
| феназепам в среднетерапевтических дозах. | |
| Поздние дискинезии | Невысокие дозы некоторых нейролептиков: |
| сонапакс 50-150 мг/с; лепонекс 50-100 мг/с | |
| Наиболее эффективен тиаприд 200-600 мг/с | |
| Транквилизаторы — клоназепам 2-6 мг/с; | |
| диазепам 20-30 мг/с | |
| В некоторых случаях эффективен акинетон | |
| Витамин Е | |
| Ноотропы | |
| Экстракорпоральные методы детоксикации | |
| (плазмаферез, гемосорбция) | |
| Злокачественный нейролептический синдром | Отмена нейролептиков |
| Назначение интенсивной инфузионной | |
| терапии (от 2,5 до 6 л в сутки) | |
| Ноотропы | |
| Бромокриптин 7,5-15 мг/с | |
| Дантролен 100 мг/с | |
| Плазмаферез, гемосорбция |
Профилактика осложнения должна строится на основе учета факторов риска. Установлено, что поздние дискинезии возникают наиболее часто при следующих предрасполагающих факторах: 1) наличие церебральной органической недостаточности; 2) пожилой возраст; 3) длительность применения высоких доз нейролептиков, особенно пиперазиновых производных фенотиазина и бутирофенонов; 4) склонность к развитию массивной экстрапирамидной симптоматики с преобладанием затяжных гиперкинезов. При наличии указанных факторов, особенно при их сочетании, терапию следует проводить с особой осторожностью, учитывая возможности возникновения осложнения (Г.Я.Авруцкий, И.Я.Гурович, В.В.Громова, 1974).
2.Причины заболевания
Причина этих расстройств связана с поражением экстрапирамидной системы головного мозга и нейромедиаторным дисбалансом. Экстрапирамидная часть мозга обеспечивает контроль позы, плавность движений, их соответствие задуманному действию. Точность, скорость и координация работы разных групп мышц также управляется этой системой.
Довольно часто экстрапирамидные расстройства возникают как побочный эффект от приёма нейролептических препаратов
. Лекарственные экстрапирамидные расстройства могут наблюдаться также при приёме антидепрессантов, антагонистов кальция, противоаритмических препаратов и лекарств, назначаемых при болезни Паркинсона. Побочное действие этих препаратов может возникать в первые дни лечения или как следствие продолжительного регулярного приёма (соответственно, «ранние» и «поздние» медикаментозные расстройства). Поздние экстрапирамидные расстройства могут развиться даже после отмены препарата и быть необратимыми. Такой риск необходимо учитывать при включении этих лекарств в терапевтическую схему.
Экстрапирамидные расстройства в значительной степени снижают качество жизни пациентов, резко ограничивая социальную активность. Психологический статус характеризуется тревожностью, чувством неполноценности, когнитивными расстройствами, замкнутостью, потерей интереса к внешнему миру и серьёзными переживаниями одиночества.
Посетите нашу страницу Неврология
Паркинсонизм и его вторичные формы: сходства и различия
Паркинсонизм — синдром двигательных расстройств — в 70% случаев является проявлением болезни Паркинсона, которая связана с естественным старением организма и/или наследственной предрасположенностью, диагностируется обычно у людей старше 60 лет.
Остальные 30% — это вторичные формы паркинсонизма, которые могут развиваться в любом возрасте в результате разнообразных повреждений центральной нервной системы. Такие патологии можно классифицировать по наиболее часто встречающимся причинам их возникновения:
- лекарственный паркинсонизм является побочным эффектом некоторых лекарственных препаратов — нейролептиков, симпатолитиков, противоэпилептических средств и др.;
- токсический — обычно приравнивается к лекарственной форме, но при таком типе ведущую роль играет отравление солями тяжелых металлов, солями синильной кислоты, угарным газом, злоупотребление алкоголем, применение суррогатных и синтетических наркотиков, «экстази»;
- сосудистый — развивается после перенесенного инсульта, а также на фоне других сосудистых патологий (дисциркуляторная энцефалопатия, церебральный атеросклероз и др.);
- постинфекционный — часто расценивается как хроническая стадия энцефалита, потому что обычно возникает на фоне этого заболевания;
- гидроцефалический — следствие расширения желудочков головного мозга без повышения внутричерепного давления;
- посттравматический — возникает после серьезной черепно-мозговой травмы или вследствие частых травм головы средней и легкой степени тяжести (у спортсменов, сотрудников силовых структур).
Симптомы болезни Паркинсона и вторичных форм паркинсонизма примерно одинаковы:
- тремор — дрожь в руках;
- гипокинезия — малоподвижность;
- мышечная ригидность — постоянно повышенный тонус мышц-сгибателей;
- нарушение равновесия, координации движений, шаткая походка и др.
Паркинсонизм отличается от болезни Паркинсона следующим:
- более быстрым началом заболевания;
- более злокачественным течением, быстро приводящим к инвалидности;
- менее выраженным или полным отсутствием эффекта от противопаркинсонического лечения.
3.Виды экстрапирамидных расстройств
Аметоз
Этот вид расстройства чаще всего проявляется в кистях рук и мышцах лица. Характерны медленные извивающиеся движения пальцев, которые выглядят как червеобразные и лишённые костей. На лице могут наблюдаться подёргивания губ и языка, искривление и асимметрия. Лицевые мышцы поочерёдно напрягаются и расслабляются. Такие нарушения могут быть следствием родовой травмы, энцефалита, сифилиса и черепно-мозговых травм.
Хорея
Эта разновидность расстройств проявляется беспорядочными неритмичными движениями всего тела. При этом для мышц туловища и конечностей характерно снижение тонуса.
Торсионный спазм
Сочетание дистонии мышц туловища со спазмами, вплоть до полного замирания всего тела. Расстройство этого типа начинается с мышц шеи, которые непроизвольно поворачивают голову в сторону. Такая торсионная кривошея может развиться, охватывая другие группы мышц. В некоторых случаях наблюдается «писчий спазм» – во время письма или даже при попытке придать пальцам «пишущее» положение наступает спазм кисти из-за гипертонуса в пальцах.
Тик
Непроизвольные повторяющиеся сокращения определённых мышц (чаще лица или шеи). Этот расстройство может варьировать от подёргивания века до навязчивых сморщиваний, подмигиваний, запрокидывания головы, подёргивания плечом. Как правило, стрессогенные ситуации, волнение усиливают проявление этого вида экстрапирамидных расстройств.
Гемибаллизм
Наблюдаются размашистые односторонние движения конечностей, напоминающие подбрасывание или попытку сделать хватательное движение. Этот вид навязчивых движений чаще всего развивается на фоне инфекционного поражения мозга (туберкулёз, сифилис, энцефалит). Также может иметь место при тяжёлых сосудистых нарушениях и метастазировании в мозг.
Тремор
Дрожание рук, тремор головы. При попытке сделать точное движение амплитуда и частота движений нарастают с повышением концентрации на объекте. При некоторых формах (болезнь Паркинсона) наблюдается «тремор покоя» – дрожание возникает при статическом положении, а во время движения не проявляется.
Лицевой гемиспазм
Спазм половины лица, включая язык, глаз и шею. Этот вид может сопровождаться издаваемыми звуками наподобие смеха, плача, вскрикиваний.
Перечисленные виды экстрапирамидных расстройств чаще всего сочетаются друг с другом в разных комбинациях
и входят в симптомокомплекс серьёзных заболеваний наследственного или приобретённого генеза. Грубые нарушения обмена веществ и мозгового кровообращения, травмы, нейроинфекции приводят к мышечным спазмам и дистонии. Любые изменения тонуса и потеря контроля над движениями могут быть проявлением тяжёлых нарушений мозга и
требуют немедленного обращения к невропатологу.
О нашей клинике м. Чистые пруды Страница Мединтерком!
Экстрапирамидные нарушения при цереброваскулярных заболеваниях
В статье рассматриваются наиболее распространенные постинсультные экстрапирамидные расстройства. На примере препарата Цераксон® обсуждаются возможности нейропротективной терапии в лечении постинсультных экстрапирамидных расстройств.
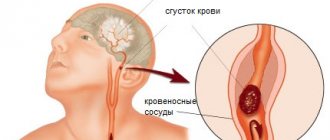
Цереброваскулярные заболевания являются важнейшей медико-социальной проблемой. Распространенность мозгового инсульта остается высокой во всем мире: за 2015 г. было зарегистрировано 16,9 млн инсультов, заболеваемость в среднем составила 258 случаев на 100 тыс. населения [1]. Ежегодно от инсульта в мире умирает 5,9 млн человек. Частота инсульта в России существенно выше, чем в западноевропейских странах, и составляет 300–350 случаев на 100 тыс. населения. Только в Москве в 2014 г. произошло свыше 35 тыс. инсультов. Вызывает тревогу и рост числа инсультов среди лиц молодого возраста. Экстрапирамидная симптоматика, которая отличается большим разнообразием, вовлечением в патологический процесс различных структур, неоднородностью подходов к лечению и прогнозом, не относится к числу частых проявлений острого инсульта. Однако возникающие нарушения могут отличаться стойкостью и вызывать значительную инвалидизацию. Между тем врачи осведомлены о постинсультных экстрапирамидных нарушениях гораздо хуже, чем о другой очаговой симптоматике.
Экстрапирамидные расстройства: эпидемиология и патогенез
Согласно эпидемиологическим данным, экстрапирамидные расстройства наблюдаются у 1–4% больных, перенесших инсульт, примерно в равных соотношениях у мужчин и женщин [2]. Возможно, распространенность постинсультных экстрапирамидных нарушений сильно занижена, так как они могут развиваться отсроченно (через несколько лет), что затрудняет их учет в эпидемиологических исследованиях.
Основная роль базальных ганглиев в системе организации произвольных движений заключается в регуляции моторной активности коры, подготовке к движению, регуляции мышечного тонуса и контроле последовательности включения различных мышечных групп. Своеобразными «выходными воротами» базальных ганглиев являются внутренний сегмент бледного шара и ретикулярная часть черной субстанции. На этих структурах реализуется суммарный вектор активности прямого и непрямого дофаминергических путей. В норме происходит торможение бледного шара и ретикулярной части черной субстанции, растормаживание таламокортикальных проекций, что приводит к облегчению инициированного корой движения. В то же время кора через прямые кортикостриарные, кортикосубталамические пути оказывает регулирующее действие на базальные ганглии. Кроме того, между отдельными структурами базальных ганглиев имеются многочисленные активирующие и тормозные связи. Упрощенно развитие гипокинетического синдрома можно объяснить повышенной активностью непрямого пути, гиперкинетические расстройства – прямого пути.
Несмотря на то что базальные ганглии играют огромную роль в контроле произвольных движений, грубое поражение базальных ганглиев вследствие инсульта не всегда сопровождается моторными нарушениями. Согласно данным Лозаннского регистра инсульта, из 2500 пациентов только у 29 (1%) были постинсультные экстрапирамидные нарушения [3]. На сегодняшний день вопрос, почему морфологическое повреждение базальных ганглиев в ряде случаев не сопровождается клинической симптоматикой, остается открытым. Вероятно, влияние оказывают такие факторы, как индивидуальная чувствительность к ишемии нейрональных подкорковых структур, возможность пластичности мозговой ткани, включение компенсаторных механизмов. Кроме того, по-видимому, для нарушения работы базальных ганглиев имеет значение не столько одиночный, лакунарный очаг, сколько дисфункция целого ряда межнейрональных связей [4, 5]. Действительно, в механизмах развития акинетико-ригидного синдрома при болезни Паркинсона играет роль не только дисфункция прямого и непрямого дофаминергических путей вследствие нарушения выработки дофамина нейронами черной субстанции, но и изменение функциональной активности корковых и стволовых структур. Так, по данным позитронно-эмиссионной томографии с фтордезоксиглюкозой, отмечается снижение активности метаболических процессов в премоторной и дополнительной моторной коре, а также в ассоциативных зонах височной доли [6].
Постинсультные экстрапирамидные расстройства
Постинсультные экстрапирамидные расстройства представлены, как правило, односторонними контралатеральными очагу инсульта нарушениями (83% случаев), но возможна и двусторонняя симптоматика [3]. Кроме того, инсульт в стволе мозга или мозжечке может приводить к односторонним ипсилатеральным симптомам.
К наиболее распространенным связанным с инсультом экстрапирамидным синдромам относятся гемихорея (в сочетании или без гемибаллизма), дистония, тремор, паркинсонизм или миоклония [3, 7]. Постинсультные экстрапирамидные расстройства могут развиваться остро, наряду с другими очаговыми проявлениями инсульта, и отсроченно (через несколько недель, месяцев и даже лет), а также прогрессировать со временем [2]. Описаны варианты трансформации гиперкинезов от гемибаллизма в остром периоде в гемихорею и позднее в гемидистонию [8].
Наблюдается зависимость между сроками формирования экстрапирамидных симптомов и их характером [9–11]. Так, хорея проявляется значительно раньше, чем симптомы паркинсонизма. В исследовании, проведенном F. Alarcón и соавт., среднее время развития гемихореи составило 4,3 дня, паркинсонизма – 117,5 дня (p
Обнаружена корреляция между временем развития гиперкинезов, их характером и возрастом пациентов. B.L. Scott и J. Jankovic установили, что в молодом возрасте экстрапирамидные симптомы проявляются не сразу [11]. Так, у двух пациентов (средний возраст 28,7 года) с ишемическими инфарктами гемидистония на стороне гемипареза дебютировала через 42,8 года. У пожилых пациентов латентный период развития симптоматики составил один – четыре года. Кроме того, для молодых пациентов характерна тенденция к генерализации гиперкинеза, в то время как для пожилых – фокальные или сегментарные формы дистонии [11].
По данным F. Alarcón и соавт., при инсульте у молодых чаще встречается дистония, в старших возрастных группах – хорея [7].
Патофизиология отсроченного дебюта экстрапирамидных расстройств не совсем понятна. Этот феномен характерен не только для инсульта, но и для черепно-мозговой травмы. В качестве объясняющей его гипотезы рассматривается роль синаптической пластичности, которая приводит к постепенному образованию новых функциональных связей в системе подкорково-корковых кругов, изменению баланса активирующих и тормозных влияний и в результате формированию аномальных двигательных паттернов [2].
Экстрапирамидная симптоматика чаще всего вызвана очаговыми изменениями в стриатуме/паллидуме (44%) и таламусе [3]. Четкой корреляции между локализацией очага инсульта и характером гиперкинеза нет. Более того, поражение одних и тех же образований способно приводить к различной экстрапирамидной симптоматике. Так, причиной гемибаллизма может стать поражение не только субталамического ядра, но и стриатума и таламуса. Гемидистония, гемихорея, гемиатетоз возникают вследствие поражения как чечевицеобразного, так и хвостатого ядра [3]. После инсульта в таламусе может развиться хорея, атетоз или дистония. Экстрапирамидные синдромы чаще всего возникают вследствие небольших глубинных инфарктов на фоне микроангиопатии [3, 7, 11]. Однако описаны случаи гиперкинезов после кардиоэмболического или атеротромботического инсульта, а также после паренхиматозного или субарахноидального кровоизлияния [4].
Сосудистая хорея
Хорея – самый частый постинсультный гиперкинез. Наблюдается у 0,4–1,3% пациентов, перенесших острое нарушение мозгового кровообращения, преимущественно у людей пожилого возраста [11]. Хореический гиперкинез дебютирует остро в первые четыре дня от момента инсульта [3, 11]. Гиперкинез чаще всего представлен гемихореей или в случае двустороннего сосудистого поражения может быть генерализованным. У большинства пациентов сочетается с мышечной слабостью на той же стороне. Реже встречаются случаи без пареза. Кроме того, описано несколько случаев одновременного наличия контралатеральной гемихореи и гемипареза на противоположной стороне [3, 13]. Хореический гиперкинез, несмотря на восстановление мышечной силы в конечностях, может сохраняться и приобретать хроническое течение. Хорея в тяжелых случаях может сочетаться с бросковыми движениями, то есть переходить в гемибаллизм. Последний, в отличие от хореи, предполагает не только большую амплитуду движений, но и обязательное вовлечение проксимальных отделов конечностей.
Сосудистая хорея развивается вследствие ишемического или геморрагического поражения таламуса, лентиформных ядер, реже субталамического ядра (область кровоснабжения латеральных лентикулостриарных или таламоперфорирующих артерий – бассейн средней и задней мозговых артерий) [12, 13]. В нескольких работах было показано, что причиной сосудистой хореи может стать поражение лобных, височных или теменных долей. Гиперкинез в этом случае является результатом снижения активирующего влияния коры на подкорковые ганглии и функциональной инактивации последних. Другое объяснение – наличие мелких очагов в базальных ганглиях, не идентифицированных с помощью структурной нейровизуализации. Так, N. Mizushima и соавт. описали пациента с инфарктом в правой височной доле и контралатеральной гемихореей, у которого только с помощью однофотонной эмиссионной компьютерной томографии было выявлено снижение перфузии в базальных ганглиях справа [14]. Случай гемихореи наблюдался и при стенозе экстракраниального отдела внутренней сонной артерии, с гипоперфузией по мелким артериям базальных ганглиев, обнаруживаемой при функциональной нейровизуализации, и редукцией гиперкинеза после реваскуляризации.
Развитие гемибаллизма связывают с преимущественным поражением субталамического ядра (по данным клинико-патологических исследований, поражением не менее 20% вещества субталамического ядра). Гемибаллизм может быть следствием геморрагического очага в стриатуме.
Спонтанный регресс хореического гиперкинеза на фоне острого инсульта наблюдается в 50% случаев. У части больных гиперкинез может носить стойкий характер. Как показывают наблюдения, прогноз лучше у пациентов с корковыми инсультами по сравнению с теми, кто перенес субкортикальные инфаркты. Это согласуется с предположением о том, что хорея при корковых инсультах является следствием транзиторной гипоперфузии подкорково-таламических путей или же их функциональной инактивации. В случае с гемибаллизмом прослеживается та же закономерность – прогноз лучше в случае коркового поражения.
Стратегия ведения больных с сосудистой хореей такая же, как больных с острым инсультом – проведение вазоактивной, метаболической, антиагрегантной терапии. Однако если гиперкинез приобретает выраженный характер, сопровождается большой амплитудой движений (хорея и гемибаллизм), необходимо назначать симптоматическую терапию, направленную на блокирование рецепторов дофамина. Для лечения используют типичные нейролептики (галоперидол, сульпирид, пимозид) в низких дозах. Длительность их применения должна быть ограничена двумя неделями с постепенной отменой [15]. Эффективность атипичных нейролептиков, таких как рисперидон, кветиапин, оланзапин, клозапин, подтверждена в ряде исследований [16]. Хорошие результаты отмечены у тетрабеназина – атипичного нейролептика, истощающего пул пресинаптического дофамина и широко используемого в мире для лечения хореи Гентингтона.
Кроме нейролептиков в качестве симптоматической терапии сосудистой хореи назначают бензодиазепины (клоназепам, диазепам), препараты вальпроевой кислоты, габапентин, тригексифенидил. Есть отдельные сообщения об эффективности использования амантадинов. В нескольких рандомизированных плацебоконтролируемых исследованиях было показано, что внутривенное введение 400 мг/сут амантадина приводило к достоверному уменьшению выраженности гиперкинеза [17].
Хирургическое лечение сосудистой хореи не получило широкого распространения. Вместе с тем в ряде тяжелых случаев гемихореи/баллизма (продолжительностью более одного года) проведение стереотаксических операций на таламусе или задневентральная паллидотомия имели положительный эффект [18]. Глубокая стимуляция мозга (таламуса, внутреннего сегмента бледного шара) в настоящее время также рассматривается как способ коррекции хореического гиперкинеза. В отдельных исследованиях продемонстрировано по крайней мере трехлетнее улучшение самочувствия [19].
Дистония
Дистония – второй (после хореи) по распространенности гиперкинез. Возникает через несколько недель или месяцев после инсульта (в среднем через девять месяцев). Постинсультная дистония формируется контралатерально очагу поражения, расположенного в скорлупе или таламусе, реже в бледном шаре [2, 4]. Описаны случаи изолированной дистонии кисти в результате инсульта в теменной доле.
Дистония чаще всего носит фокальный характер, но может быть сегментарной или генерализованной (гемидистония). Постинсультная гемидистония в детском возрасте часто сочетается с гемиатрофией [8]. Типично развитие дистонической установки кисти со сгибанием в области пястно-фаланговых суставов и разгибанием межфаланговых суставов, приведением и сгибанием локтя. При дистонии мышц в ноге формируется эквиноварусная позиция стопы с разгибательной установкой большого пальца или без нее (по типу симптома Бабинского). Описаны случаи, когда к дистонии руки через несколько месяцев присоединяется дистония стопы [8]. Краниальная дистония (блефароспазм, оромандибулярная дистония) встречается крайне редко (поражение стволово-диэнцефальных проекций или таламуса) [21]. Цервикальная дистония может быть следствием ишемического или геморрагического очага в полушарии мозжечка, моста или покрышки мозга [22].
Лечение постинсультной дистонии требует комплексного подхода с назначением холинолитиков, клоназепама, карбамазепина, вальпроатов, баклофеновой помпы. При фокальных дистониях используют инъекции ботулотоксина. В тяжелых случаях рекомендовано оперативное вмешательство – деструкция бледного шара или ядер таламуса, а также глубокая стимуляция мозга.
Сосудистый паркинсонизм
Концепцию сосудистого паркинсонизма впервые выдвинул в 1929 г. M. Critchley [23]. Он описал клинические проявления паркинсонизма, развившегося на фоне цереброваскулярного заболевания, у пожилых пациентов и предложил термин «атеросклеротический паркинсонизм». К основным симптомам атеросклеротического паркинсонизма он отнес ригидность, маскообразное лицо, шаркающую походку. В зависимости от дополнительных симптомов (псевдобульбарного паралича, деменции и недержания мочи, пирамидной симптоматики, мозжечковой недостаточности) M. Critchley выделил шесть типов заболевания [23]. Концепция M. Critchley в последующие годы подверглась серьезной критике, так как клинически болезнь Паркинсона и паркинсонизм вследствие цереброваскулярного заболевания трудно дифференцировать. Многие пациенты с болезнью Паркинсона имеют сосудистые факторы риска. Более того, наличие сосудистого компонента усугубляет течение заболевания. Накопленные впоследствии патологоанатомические данные подтвердили правильность предположения M. Critchley о вероятной сосудистой природе заболевания. Вместе с тем даже сегодня, несмотря на возможности нейровизуализации, нередко возникают проблемы в постановке диагноза.
По эпидемиологическим данным, на долю сосудистого паркинсонизма приходится 3–12% всех случаев паркинсонизма [24]. Распространенность сосудистого паркинсонизма, согласно исследованиям с патологоанатомическим подтверждением, колеблется в диапазоне 1–6% [24]. Так, в работе K.A. Jellenger при проведении аутопсии у 759 пациентов с паркинсонизмом сосудистая этиология была подтверждена в 3,4% случаев [25].
Сосудистый паркинсонизм чаще всего развивается на фоне множественного поражения базальных ганглиев. Реже паркинсонизм становится следствием одиночных инфарктов в таламусе, чечевицеобразных ядрах или мосте. Следует подчеркнуть, что только у очень небольшого числа пациентов с сосудистой патологией и даже имеющих сосудистые очаги отмечаются симптомы паркинсонизма [24]. I. Reider-Groswasser выявил, что паркинсонизмом страдали только 38% пациентов с очаговыми изменениями в базальных ганглиях [26].
Лакунарные инфаркты часто сочетаются с лейкоареозом и поражением белого вещества лобных долей. В исследовании с участием 14 пациентов с сосудистым паркинсонизмом наиболее характерной нейровизуализационной находкой было сочетание лакунарных изменений стриатума и лейкоареоза [2]. Крайне редко очаговое поражение затрагивает черную субстанцию, но в этих случаях клиническая картина заболевания идентична болезни Паркинсона.
В основе лакунарного поражения базальных ганглиев при сосудистом паркинсонизме чаще всего лежит микроангиопатия на фоне гипертонической болезни или сахарного диабета [27]. Описаны случаи сосудистого паркинсонизма при CADASIL-синдроме и болезни Моямоя [2]. Другая причина лакунарных изменений в базальных ганглиях – липогиалиноз мелких сосудов, приводящий к микроокклюзии, ишемии и глиозу. При патоморфологическом исследовании обнаруживают пролиферацию астроцитов, демиелинизацию аксонов, расширение периваскулярных пространств. В результате формируются множественные лакунарные изменения в базальных ганглиях, внутренней капсуле, семиовальном центре [24].
По характеру развития выделяют две формы сосудистого паркинсонизма:
- с острым началом вследствие обширного лакунарного инфаркта в базальных ганглиях и ступенеобразным прогрессированием симптомов;
- постепенным началом и медленным прогрессированием на фоне диффузного поражения субкортикального белого вещества в сочетании с ишемическими изменениями в стриатуме, чечевицеобразных ядрах или мосте. Подобный вариант течения сосудистого паркинсонизма встречается у каждого второго-третьего пациента с сосудистым паркинсонизмом.
К классическим вариантам сосудистого паркинсонизма относят случаи паркинсонизма «нижней части тела» – с двусторонней симметричной симптоматикой в виде брадикинезии, ригидности в ногах и нарушениями походки (уменьшением длины и высоты шага, широкой базой, шарканьем, постуральной неустойчивостью, тенденцией к падениям). Нередко у больных с сосудистым паркинсонизмом встречается стартовая задержка при ходьбе, тенденция к пропульсиям. В отличие от болезни Паркинсона ахейрокинез (отсутствие содружественных движений рук при ходьбе) для сосудистого паркинсонизма не характерен. Наличие тремора покоя по типу «скатывания пилюль» с частотой 4–6 Гц исключает диагноз сосудистого паркинсонизма. Возможен небольшой постуральный или кинетический тремор. Ригидность по типу «зубчатого колеса» наблюдается очень редко. Чаще встречается сочетание ригидности и спастичности, преимущественно в нижних конечностях. Практически у всех больных (80%) с сосудистым паркинсонизмом можно выявить пирамидные симптомы (повышение сухожильных и периостальных рефлексов, симптом Бабинского), когнитивные нарушения, расстройства мочеиспускания, симптомы псевдобульбарного паралича. Однако встречаются случаи сосудистого паркинсонизма с менее очевидной картиной. Так, в итальянском многоцентровом перекрестном исследовании у пациентов с диагностированным сосудистым паркинсонизмом в 59% случаев имел место асимметричный дебют [2]. Гемипаркинсонизм развивается, как правило, в первые месяцы после перенесенного острого нарушения мозгового кровообращения и связан с крупным очагом в базальных ганглиях.
Диагноз сосудистого паркинсонизма должен быть подтвержден нейровизуализационными данными в виде очаговых изменений в базальных ганглиях, таламусе, лобной доле. В большинстве случаев на DAT-скане не выявляется нарушений связывания с дофаминовым транспортером. Вместе с тем при сосудистом паркинсонизме изменения, по данным функциональной нейровизуализации, могут встречаться, но они, в отличие от болезни Паркинсона, носят симметричный характер [24]. Дополнительным диагностическим тестом может быть исследование обонятельной функции. Аносмия характерна для болезни Паркинсона и болезни диффузных телец Леви, но не для сосудистого паркинсонизма.
Дофаминергическая терапия малоэффективна при сосудистом паркинсонизме. Только у 20–30% пациентов отмечается умеренный непродолжительный эффект от приема леводопы, при этом, как правило, используются высокие дозы леводопы – 750–1500 мг/сут [28]. Если в течение четырех – шести недель положительной динамики не достигнуто, то продолжать лечение леводопой не имеет смысла. В ряде исследований замечено, что пациенты с изменением на DAT-скане лучше реагируют на леводопу [28]. Для улучшения паттерна ходьбы рекомендуют использовать звуковые ритмичные сигналы (метроном, музыку), зрительные ориентиры в виде нарисованных на полу поперечных полосок, соответствующих ширине шага, трость с поперечной перекладиной. Определенное значение имеют курсы вазоактивной и метаболической терапии в соответствии с принципами лечения хронической недостаточности мозгового кровообращения и постинсультных состояний.
Тремор
Изолированный постинсультный тремор встречается крайне редко. Как правило, это односторонний постуральный или кинетический тремор. Тремор относится к числу отсроченных постинсультных гиперкинезов. Как симптом острого периода инсульта тремор не встречается [29]. Развитие гиперкинеза обусловлено поражением таламуса или дентато-рубро-таламических, мозжечково-таламических или нигростриарных путей. Описаны случаи изолированного тремора при письме в результате лакунарного инфаркта лобной доли. С поражением среднего мозга связан тремор Холмса – односторонний, преимущественно вовлекающий проксимальные отделы конечностей, возникающий в покое, в момент удержания позы (постуральный) и усиливающийся при движении [30]. Постинсультный тремор практически рефрактерен к фармакотерапии. Пропранолол или примидон редко дают эффект. В тяжелых случаях рекомендована глубокая стимуляция мозга с вживлением электродов в вентральные ядра таламуса [24].
Миоклонии
Миоклонии крайне редко развиваются после острого инсульта. В литературе нет сообщений о генерализованной миоклонии, проявившейся в отдаленном периоде острого нарушения мозгового кровообращения. Встречаются единичные описания астериксиса (негативной миоклонии) – повторяющегося ритмичного падения мышечного тонуса в кистях рук при попытке их удержать в горизонтальном положении. Астериксис в этих случаях носил односторонний (контралатеральный очагу поражения) или двусторонний характер. Появление астериксиса связывают с поражением таламуса, возможно в сочетании с субталамическим ядром [31, 32].
Роль нейропротективной терапии при постинсультных экстрапирамидных расстройствах
В основе лечения экстрапирамидных нарушений как очаговых симптомов, развившихся в остром периоде инсульта, лежат принципы патогенетической терапии ишемического или геморрагического инсульта. Одно из направлений терапии в остром периоде – применение нейропротективных препаратов. Среди них предпочтение следует отдавать препаратам с убедительной доказательной базой, обладающим мультимодальным действием и доказанным профилем безопасности.
Цитиколин (Цераксон®) широко используется в клинической практике как при ишемическом, так и при геморрагическом инсульте. Введение цитиколина при инсульте достоверно снижает показатели смертности и стойкой инвалидизации. В ряде исследований с применением компьютерной и магнитно-резонансной томографии было показано, что назначение цитиколина в первые сутки ишемического инсульта приводило к уменьшению объема ишемического очага. Эффект препарата носил дозозависимый характер (использовались дозировки 500, 1000, 2000 мг/сут). Средний прирост объема очага поражения на фоне терапии препаратом Цераксон® в дозе 2000 мг/сут составил всего 1,8% [33]. A. Davalos и соавт. в четырех клинических испытаниях изучили результаты перорального приема цитиколина у 1372 больных с ишемическим инсультом [34]. Цитиколин назначался начиная с первых суток заболевания в течение шести недель. К 12-й неделе в группе цитиколина восстановление было достигнуто в 25% случаев, в группе плацебо – в 20% (p
Во всех клинических исследованиях подчеркивается хорошая переносимость и безопасность препарата [33–35]. Цитиколин включен в европейские рекомендации и российские стандарты по лечению инсульта [34, 36].
Нейропротективные свойства препарата связывают с выраженным мембраностабилизирующим действием. Цитиколин участвует в синтезе основных фосфолипидов (фосфатидилхолина, сфингомиелина, кардиолипина) клеточных мембран [37–40]. Оказывая прямой репарационный эффект, цитиколин препятствует повреждению клеточной поверхности и мембран митохондрий при воздействии факторов ишемии/гипоксии, а также при нейродегенеративных заболеваниях. Стабилизируя мембраны, цитиколин предотвращает процесс расщепления фосфолипидов на жирные кислоты и образование свободных радикалов [37–40]. Дополнительный защитный эффект может объясняться увеличением экспрессии в нейронах мозга важнейшего фактора эндогенной нейропротекции белка сиртуина 1. Цитиколин обладает многокомпонентным нейротрансмиттерным действием, способствуя синтезу ацетилхолина, серотонина, норадреналина [41]. Отмечена способность цитиколина влиять на глутаматергические и ГАМК-рецепторы [41]. В ряде экспериментальных моделей паркинсонизма препарат увеличивал уровень дофамина в полосатом теле, стимулируя его высвобождение за счет усиления активности тирозингидроксилазы [42, 43]. Еще одна причина повышения уровня дофамина – подавление обратного захвата дофамина, возможно связанное с влиянием цитиколина на синтез фосфолипидов [44].
Дофаминстимулирующее действие цитиколина послужило основанием для его включения в комплексную терапию болезни Паркинсона. В нескольких двойных слепых перекрестных исследованиях было продемонстрировано, что назначение цитиколина в виде внутривенных инфузий в дозе 500 мг/сут в течение 10–20 дней позволило улучшить показатели двигательной активности, уменьшить выраженность брадикинезии, ригидности и тремора. Улучшение наблюдалось при назначении цитиколина как в монотерапии, так и в комбинации с леводопой [45, 46].
В исследовании J. Acosta цитиколин назначали в дозе 500 мг/сут (на фоне стабильной дозы леводопы) в течение десяти дней внутривенно, а затем в течение 14 дней – в виде перорального раствора [47]. По окончании курса терапии у 36% пациентов отмечался хороший эффект, преимущественно в отношении брадикинезии и ригидности. Достоверного влияния на тремор отмечено не было. По данным анализа эффективности в зависимости от времени назначения цитиколина, лучшие результаты наблюдались у больных, находившихся на терапии леводопой менее двух лет. У ряда пациентов добавление цитиколина позволило снизить дозу леводопы на 25–30% [47]. Эти данные были подтверждены R. Eberhardt и соавт., которые сделали вывод о том, что назначение цитиколина позволяет снизить дозу леводопы и уменьшить тем самым риск побочных реакций, связанных с ее применением [48].
В многоцентровом слепом плацебоконтролируемом исследовании C. Loeb и соавт. на фоне введения цитиколина в дозе 1000 мг/сут внутривенно капельно в дополнение к проводимой терапии был отмечен не только положительный достоверный эффект препарата в сравнении с плацебо, но и ухудшение состояния больных после отмены цитиколина. Это демонстрирует эффективность цитиколина как адъювантного средства на фоне терапии леводопой у пациентов с болезнью Паркинсона [49].
С учетом нейропротективного действия и нейротрансмиттерного потенциала Цераксон® показан и в остром периоде инсульта, сопровождающегося экстрапирамидной симптоматикой. Цераксон® может быть эффективен в комплексной терапии сосудистого паркинсонизма. В экспериментальных исследованиях было доказано трофическое и нейропротективное действие цитиколина в отношении нигростриарных дофаминергических нейронов. В частности, цитиколин защищает дофаминергические нейроны от токсического действия метил-4-фенил-пиридина [50, 51] и глутамата [50]. Рекомендуемые дозы препарата Цераксон® в остром периоде инсульта составляют 1000 мг/сут внутривенно капельно каждые 12 часов начиная с первых суток с последующим переходом на пероральные формы (пакетированная форма препарата с питьевым раствором). Важно подчеркнуть, что внутривенные и пероральные формы препарата Цераксон® имеют одинаковую биодоступность. Лечение препаратом Цераксон® должно продолжаться не менее шести недель.