|
Почти всякая незыблемая общепринятая теория, которую с проклятьями зубрят школьники и которую устало и одинаково рассказывают учителя и даже профессора ВУЗов, при внимательном рассмотрении оказывается отнюдь не однозначной, захватывающей и полной загадок. К теории мышечного сокращения вышесказанное относится в полной мере. В общих чертах она была разработана еще в 50-х годах прошлого века, и классический рисунок (рис. 1) с актиновыми и миозиновыми нитями до сих пор кочует из учебника в учебник. Однако реальная картина сокращения мышцы куда запутаннее, интереснее и непонятнее, со множеством подробностей и неожиданных действующих лиц и со сложными ролями, которые исполняют эти лица. О новой и удивительной отрасли науки, находящейся на стыке физики, математики и биологии и изучающей механизмы мышечного сокращения, рассказали в своих лекциях на проходящей при поддержке РВК, Фонда «Династия» и РФФИ Зимней школе Future Biotech доктор физико-математических наук Андрей Кимович Цатурян и доктор биологических наук, заведующий Лабораторией биологической подвижности Института иммунологии и физиологии УрО РАН Сергей Юрьевич Бершицкий.
Нервно-мышечная реакция на силовую тренировку[править | править код]
Источник: «Программы тренировок»
, научное изд.
Автор:
профессор, доктор наук Тудор Бомпа, 2021 г.
Структура мышц[править | править код]
Мышца
— это комплексная структура, отвечающая за движение. Мышцы состоят из саркомеров, которые содержат определенное сочетание фибриллярных белков — миозина (толстые нити) и актина (тонкие нити), которые играют важную роль в мышечных сокращениях. Таким образом,
саркомер
— это сократительный элемент мышечного волокна, состоящий из миозиновых и актиновых белковых нитей.
Помимо этого, способность мышцы сокращаться и прилагать силу зависит конкретно от ее вида, площади поперечного сечения, а также длины и количества волокон внутри мышцы. Число волокон определяется генетикой, и на него невозможно повлиять с помощью тренировок; однако тренировки в состоянии изменить другие переменные. Например, число и толщина миозиновых нитей увеличивается посредством упорных тренировок с максимальной силовой нагрузкой. Увеличение толщины мышечных нитей увеличивает размер мышцы и силу сокращений.
Человеческое тело состоит из различных типов мышечных волокон, подразделяющихся на группы, и каждая группа относится к одной двигательной единице. В общем и целом в нашем организме имеются тысячи двигательных единиц, в которых находятся десятки тысяч мышечных волокон. Каждая двигательная единица содержит сотни или тысячи мышечных волокон, пребывающих в покое до тех пор, пока им не нужно действовать. Двигательная единица управляет совокупностью волокон и направляет их действия по закону «все или ничего». Этот закон означает, что при раздражении двигательной единицы импульс, направляемый в ее мышечные волокна, либо распространяется полностью — таким образом раздражая всю совокупность волокон, — либо не распространяется вообще.
Разные двигательные единицы реагируют на разные нагрузки при тренировках. Например, выполнение жима лежа с 60% повторного максимума задействует определенную совокупность двигательных единиц, тогда как более крупные двигательные единицы ожидают более высокой нагрузки. Поскольку последовательное задействование двигательных единиц зависит от нагрузки, необходимо разрабатывать специальные программы, чтобы активизировать и адаптировать основные группы двигательных единиц и мышечных волокон, играющих доминирующую роль в избранном виде спорта. К примеру, в тренировках для спринта на короткую дистанцию и легкоатлетических дисциплин (таких как толкание ядра) следует использовать тяжелые нагрузки, чтобы способствовать развитию силы, необходимой для оптимизации скорости и взрывных действий.
Мышечные волокна выполняют разные биохимические (метаболические) функции; выражаясь конкретнее, одни лучше приспособлены с физиологической точки зрения к работе в анаэробных условиях, а другие лучше работают в аэробных условиях. Волокна, которые используют кислород для выработки энергии, называются аэробными, тип I, красными или медленными. Волокна, которым кислород не требуется, называются анаэробными, тип II, белыми или быстрыми. Быстрые мышечные волокна, в свою очередь, делятся на подтипы IIА и IIХ (иногда называемые IIВ, хотя у людей тип IIВ практически не встречается[1]).
Медленные и быстрые волокна существуют примерно в равной пропорции. Однако в зависимости от их функций, в некоторых группах мышц (например, подколенные сухожилия, бицепсы) содержится больше быстрых волокон, тогда как в других (например, в камбаловидной мышце) содержится больше медленных волокон. В таблице 2.1 мы сравниваем характеристики быстрых и медленных волокон.
Сравнение быстрых и медленных волокон
| МЕДЛЕННЫЕ ВОЛОКНА | БЫСТРЫЕ ВОЛОКНА |
| Красные, тип I, аэробные | Белые, тип II, анаэробные |
| • Медленно устают • Нервная клетка меньше — иннервирует от 10 до 180 мышечных волокон • Развивают долгие, продолжительные сокращения • Применяются для развития выносливости • Активизируются во время низко- и высокоинтенсивной деятельности | • Быстро устают • Большая нервная клетка — иннервирует от 300 до 500 (или более) мышечных волокон • Развивают короткие, сильные сокращения • Применяются для развития скорости и силы • Активизируются только во время высокоинтенсивной деятельности |
Тренировки могут влиять на эти характеристики. Датские ученые Андерсен и Аагаард[2][3][4][5][6] в своих исследованиях показывают, что при объемных нагрузках или лактатных по природе тренировках волокна IIХ приобретают характеристики волокон IIА. То есть богатая миозином цепочка этих волокон становится более медленной и более эффективно справляется с лактатной деятельностью. Эти изменения можно повернуть вспять, снижая тренировочную нагрузку (тейперинг), в результате чего волокна IIХ возвращаются к изначальным характеристикам наиболее быстрых волокон[3]. Силовые тренировки также увеличивают размер волокон, благодаря чему вырабатывается больше силы.
Сокращение быстрой двигательной единицы более быстрое и мощное, чем сокращение медленной двигательной единицы. В результате пропорция быстрых волокон, как правило, выше в организме успешных спортсменов, занимающихся скоростно-силовыми видами спорта, но они также быстрее утомляются. Спортсмены с более высоким скоплением медленных волокон, напротив, обычно преуспевают в видах спорта на выносливость, поскольку они могут выполнять нагрузки низкой интенсивности в течение более продолжительного времени.
Активизация мышечных волокон происходит по принципу величины, известному также как принцип Хеннемана[7], согласно которому двигательные единицы и мышечные волокна активизируются начиная с меньшей в сторону большей. Активация всегда начинается с медленных волокон. При низкой или умеренно интенсивной нагрузке активируются медленные волокна и выполняют большую часть работы. При сильной нагрузке сначала сокращаются медленные волокна, затем в процесс вовлекаются быстрые волокна. При повторениях до отказа с умеренной нагрузкой двигательные единицы, состоящие из быстрых волокон, постепенно активизируются, чтобы поддерживать выработку силы, тогда как ранее задействованные двигательные единицы утомляются (см. рис. 1).
рис. 1. Последовательная активизация двигательных единиц в подходе упражнений до концентрического отказа
В распределении типов мышечных волокон у спортсменов, занимающихся разными видами спорта, могут наблюдаться различия. Это иллюстрируют рис. 2 и 2.3, представляющие общий процент содержания быстрых и медленных мышечных волокон у спортсменов в избранных видах спорта. Например, существенная разница между спринтерами и марафонцами четко дает понять, что успех в некоторых видах спорта хотя бы частично определяется генетическим составом мышечных волокон спортсмена.
рис. 2. Распределение типов волокон у мужчин в разных видах спорта. Обратите внимание на преобладание медленных волокон у спортсменов, занимающихся аэробными видами спорта, и на преобладание быстрых волокон у спортсменов, занимающихся скоростно-силовыми видами спорта
Следовательно, пиковая мощность, вырабатываемая спортсменами, также имеет отношение к распределению типов волокон — чем выше процент быстрых волокон, тем большую мощность развивает спортсмен. Процент быстрых волокон также имеет отношение к скорости: чем выше скорость спортсмена, тем выше процент имеющихся у него быстрых волокон. Из таких людей получаются превосходные спринтеры и прыгуны, а подобный природный талант следует направлять в русло скоростно-силовых видов спорта. Попытка тренировать их, скажем, для бега на дистанцию означает трату таланта; в таких дисциплинах их ждет лишь средний успех, тогда как из них могут выйти отличные спринтеры, бейсболисты или футболисты (на этом список скоростносиловых видов спорта не кончается).
рис. 3. Распределение типов волокон у женщин в разных видах спорта
Roll and lock: поворачиваем и запираем
По гипотезе рычага, в мышечном сокращении существует только один момент генерации силы — когда поворачивается миозиновый хвост (рычаг). Однако некоторые данные рентгенографии и томографии мышц не то чтобы не согласуются с этой теорией, а свидетельствуют о том, что существует еще какой-то непонятный момент в сокращении мышцы, который гипотеза рычага не объясняет. Поэтому группа исследователей под руководством А. К. Цатуряна предложила теорию мышечного сокращения под названием «Roll and lock» — «Поворачиваем и запираем» (см.: Michael A. Ferenczi et al., 2005. The «Roll and Lock» Mechanism of Force Generation in Muscle). По этой теории, миозиновые головки садятся на актин еще до гидролиза АТФ, причем садятся не стройно и организованно, а как попало. На головке миозина есть длинный выступающий домен — «щуп», — который «нащупывает» подходящую себе (кислую и отрицательно заряженную) часть актиновой нити и прилипает к ней — как придется, под первым попавшимся углом. Однако стоит произойти гидролизу АТФ, как миозин меняет свою конформацию, головки поворачиваются под нужным углом и крепко и четко, как ключ с замком, сцепляются с актиновой нитью, а из миозинового кармана выбрасывается фосфат. И вот только после этого происходит поворот рычага. Иными словами, модель получается двухстадийной — на первом этапе головка миозина крепко и четко вцепляется в актин и при этом немного поворачивается, а на втором — поворачивается рычаг, причем сила, которая потом приведет к движению мышцы, генерируется на обоих этих этапах.
Помимо рентгеноструктурных и томографических данных, которые очень хорошо согласуются с теорией «Roll and lock», существует и несколько косвенных, но очень красивых доказательств ее правоты. Например, известно, что во время мышечного сокращения, в том случае, если мышца не меняет свою длину, всего чуть более 40% миозиновых головок сидит на актине, а остальные болтаются ни к чему не присоединенными. Однако когда сжатую мышцу насильно растягивают (например, такое бывает при беге, когда человек приземляется на напряженную мышцу), то жесткость мышцы резко увеличивается из-за того, что почти все свободные миозиновые головки резко сцепляются с актиновой нитью. Однако, судя по рентгеноструктурным данным, сцепляются они отнюдь не «намертво», как ключ с замком, а просто как попало. Объяснить это можно как раз с помощью теории «Roll and lock». Гидролиз АТФ при растяжении мышцы прекращается (оно и понятно: какой смысл тратить АТФ, если работа совершается не мышцей
, а
над мышцей
), и все миозиновые головки переходят в состояние «активного актинового поиска» — их торчащий щуп ищет актиновую нить, нащупывает на ней подходящее место и сцепляется с ним — не крепко-накрепко, не как ключ с замком, а как попало. Однако для того, чтобы увеличить жесткость мышцы (и этим защитить кости от перелома) этого оказывается достаточно.
Механизм мышечных сокращений[править | править код]
Как мы описывали раньше, мышечные сокращения
происходят в результате цепочки событий с участием белковых нитей — миозина и актина. В миозиновых нитях содержатся поперечные мостики — крошечные перемычки, выступающие вбок по направлению к актиновым нитям. Возбуждение, приводящее к сокращениям, стимулирует все волокно, создавая химические изменения, позволяющие актиновым нитям соединяться с миозиновыми поперечными мостиками. Связывание миозина с актином посредством поперечных мостиков высвобождает энергию, из-за чего поперечные мостики поворачиваются, таким образом подтягивая или совершая скользящее движение, связывающее миозиновые нити с актиновыми. Это скользящее движение вызывает мышечное сокращение, которое вырабатывает силу.
Чтобы визуализировать это иначе, вообразите гребную лодку. Весла представляют собой миозиновые нити, а воды — актиновые. Когда весла ударяются о воду, лодка с силой тянется вперед — и чем больше в воде весел, чем выше физическая сила гребца, тем больше вырабатываемая сила. Увеличение количества и толщины миозиновых нитей таким же образом повышает выработку силы.
Описанная ранее теория скользящих нитей дает понять, как работают мышцы, чтобы выработать силу. Эта теория включает в себя механизмы, способствующие эффективным мышечным сокращениям. Например, освобождение запаса эластичной энергии и рефлекторная адаптация играют ключевую роль в оптимизации спортивной работоспособности, но подобная адаптация происходит только тогда, когда в процессе тренировки происходит правильная стимуляция. Например, способность спортсмена использовать запас энергии для того, чтобы прыгать выше или толкать ядро дальше, оптимизируется посредством взрывных движений, как те, которые используются в плиометрическом тренинге. Однако мышечные компоненты — как, например, эластичные компоненты (сюда входят сухожилия, мышечные волокна и поперечные мостики) — не могут осуществлять эффективную транспортировку энергии, если спортсмен не укрепляет параллельные эластичные компоненты (напр., связки) и коллагеновые структуры (обеспечивающие стабильность и предохраняющие от травм). Если телу нужно выдерживать силы и воздействия, которым спортсмен подвергается, чтобы оптимизировать эластичные качества мышц, анатомическая адаптация должна предшествовать силовому тренингу.
Рефлекс
— это непроизвольное мышечное сокращение, вызванное внешним стимулом[8]. Два основных компонента контроля рефлексов — это мышечные веретена и нервносухожильное веретено. Мышечные веретена реагируют на величину и скорость мышечного растяжения[9], тогда как нервно-сухожильное веретено (которое находится в местах соединения мышечных волокон с сухожильными пучками [8]) реагирует на мышечное напряжение. Когда в мышцах развивается высокая степень напряжения или растяжения, мышечные веретена и нервно-сухожильное веретено непроизвольно расслабляют мышцу, чтобы защитить ее от повреждения и травмы.
При пресечении этих ингибиторных реакций повышается спортивная работоспособность. Единственный способ добиться этого — адаптировать организм к более высокой степени напряжения, что повышает порог активизации рефлексов. Этой адаптации можно добиться посредством силового тренинга с использованием постепенно утяжеляющейся нагрузки (до 90 процентов повторного максимума или даже выше), таким образом вынуждая нервно-мышечную систему выдерживать более высокое напряжение, постоянно задействуя большее число быстрых волокон. В быстрых волокнах вырабатывается больше белка, что способствует увеличению силы.
Все спортивные движения выполняются по двигательной модели, которая называется циклом растяжение — сокращение и характеризуется тремя основными типами сокращения: эксцентрическим (удлинение), изометрическим (статичное положение) и концентрическим (сокращение). Например, волейболист, который быстро приседает и сразу подпрыгивает, чтобы блокировать атакующий удар, выполнил весь цикл растяжение — сокращение. То же касается и спортсмена, который опускает штангу на грудь и быстро выполняет взрывное движение, вытягивая руки. Чтобы полноценно пользоваться физиологическими качествами цикла растяжение — сокращение, мышца должна быстро переходить от удлинения к сокращению[10] (Schmidtble-icher, 1992).
Мышечный потенциал оптимизируется, когда активизируются все сложные факторы, влияющие на цикл растяжение — сокращение. Их влияние можно использовать для улучшения спортивных показателей только тогда, когда нервно-мышечная система стратегически стимулируется в правильной последовательности. Именно для достижения этой цели периодизация тренировки силы основывает планирование этапов на физиологической базе выбранного вида спорта. После составления эргогенного профиля (оценки вклада энергетических систем) выбранного вида спорта нужно пошагово распланировать этапы тренировки, чтобы перенести положительную нервно-мышечную адаптацию на практические показатели деятельности человека. Таким образом, понимание прикладной человеческой физиологии и установление цели в конце каждого этапа помогают тренерам и спортсменам интегрировать физиологические принципы в конкретную спортивную тренировку.
Повторим:
скелетно-мышечная система тела — это сочетание костей, прикрепляемых друг к другу с помощью связок в области суставов. Пересекающие эти суставы мышцы дают силу для движения тела. Однако скелетные мышцы не сокращаются независимо друг от друга. Движения, выполняемые вокруг сустава, производятся несколькими мышцами, каждая из которых выполняет определенную роль, как уже было упомянуто выше.
Агонисты — или синергисты — это мышцы, которые взаимодействуют друг с другом при выполнении движения. В большинстве случаев, особенно если речь идет об умелом и опытном спортсмене, мышцы-антагонисты расслабляются, облегчая движение. Поскольку взаимодействие мышц группы агонистов и антагонистов напрямую влияет на спортивные движения, неправильное взаимодействие между этими группами может привести к порывистому или скованному движению. Следовательно, гладкость мышечного сокращения можно улучшить, если сосредоточиться на расслаблении антагонистов.
По этой причине одновременное сокращение (одновременная активизация мышц-агонистов и антагонистов, чтобы стабилизировать сустав) рекомендуется только на ранних стадиях реабилитации после травмы. Здоровому же спортсмену, особенно если он занимается силовыми видами спорта, не нужно выполнять упражнения (например, на нестабильной поверхности), вызывающие одновременные сокращения. К примеру, одной из основных характеристик элитных спринтеров является очень низкая миоэлектрическая активность мышц-антагонистов в каждой фазе цикла шага[11].
Первичные мышцы в первую очередь отвечают за суставное действие, которое является частью объемного силового движения или технической способности. Например, во время флексии локтя (сгибание бицепса) первичной мышцей является двуглавая мышца, тогда как трехглавая мышца (трицепс) выступает в роли антагониста и должна быть расслаблена, чтобы обеспечить беспрепятственное действие. В дополнение к этому стабилизаторы, или фиксаторы (обычно это меньшие мышцы), сокращаются изометрически, чтобы закрепить кость так, чтобы у первичных мышц была прочная база, откуда начинать натяжение. Мышцы других конечностей также могут принимать в этом участие, выступая в роли стабилизаторов, позволяющих первичным мышцам выполнять необходимые движения. Например, когда дзюдоист тянет соперника на себя, удерживая его за дзюдоги, мышцы его спины, ног и живота сокращаются изометрически, чтобы обеспечить стабильное основание для действия локтевых сгибателей (бицепсов), плечевых разгибателей (задние дельты) и лопаточных аддукторов и депрессоров (трапециевидная мышца и широчайшая мышца спины).
Видеоиллюстрации:
Видеоиллюстрация гипотезы рычагаМиозин цепляется к актиновой нити, вцепляется в нее, поворачивает хвост, затем отцепляется и возвращает хвост в прежнее положение. Видео Кеннета Холмса. |
Видеоиллюстрация гипотезы «Roll and lock»Миозин вначале ищет подходящее положение на актиновой нити, затем слабо соединяется с ней, потом сцепляется крепко — при этом вся головка поворачивается и развивает некоторое усилие, и только затем поворачивается хвост. Видео Мэри Риди. |
Механика мышечных сокращений[править | править код]
Источник: «Спортивная диагностика»
Автор:
профессор В.П. Губа, 2021 год
Если мышцу стимулировать коротким электрическим импульсом, спустя небольшой латентный период происходит ее сокращение. Такое сокращение называется «одиночное сокращение мышцы». Одиночное мышечное сокращение длится около 10-50 мс, причем оно достигает максимальной силы через 5-30 мс.
Каждое отдельное мышечное волокно подчиняется закону «все или ничего», т. е. при силе раздражения выше порогового уровня происходит полное сокращение с максимальной для данного волокна силой, а ступенчатое повышение силы сокращения по мере увеличения силы раздражения невозможно. Поскольку смешанная мышца состоит из множества волокон с различным уровнем чувствительности к возбуждению, сокращение всей мышцы может быть ступенчатым в зависимости от силы раздражения, при этом при сильных раздражениях происходит активация глубжележащих мышечных волокон.
Механизм скольжения филаментов[править | править код]
рис. 1. Схема образования поперечных связей — молекулярной основы сокращения саркомера
Укорочение мышцы происходит за счет укорочения образующих ее саркомеров, которые, в свою очередь, укорачиваются за счет скольжения относительно друг друга актиновых и миозиновых филаментов (а не укорочения самих белков). Теория скольжения филаментов была предложена учеными Huxley и Hanson (Huxley, 1974; рис. 1). (В 1954 г. две группы исследователей — X. Хаксли с Дж. Хэнсон и А. Хаксли с Р. Нидергерке — сформулировали теорию, объясняющую мышечное сокращение скольжением нитей. Независимо друг от друга они обнаружили, что длина диска А оставалась постоянной в расслабленном и укороченном саркомере. Это позволило предположить, что есть два набора нитей — актиновые и миозиновые, причем одни входят в промежутки между другими, и при изменении длины саркомера эти нити каким-то образом скользят друг по другу. Сейчас эта гипотеза принята почти всеми.)
Актин и миозин — два сократительных белка, которые способны вступать в химическое взаимодействие, приводящее к изменению их взаимного расположения в мышечной клетке. При этом цепочка миозина прикрепляется к актиновой нити с помощью целого ряда особых «головок», каждая из которых сидит на длинной пружинистой «шее». Когда происходит сцепление между миозиновой головкой и актиновой нитью, конформация комплекса этих двух белков изменяется, миозиновые цепочки продвигаются между актиновыми нитями и мышца в целом укорачивается (сокращается). Однако, чтобы химическая связь между головкой миозина и активной нитью образовалась, необходимо подготовить этот процесс, поскольку в спокойном (расслабленном) состоянии мышцы активные зоны белка актина заняты другим белком — тропохмиозином, который не позволяет актину вступить во взаимодействие с миозином. Именно для того, чтобы убрать тропомиозиновый «чехол» с актиновой нити, требуется быстрое выливание ионов кальция из цистерн саркоплазматического ретикулума, что происходит в результате прохождения через мембрану мышечной клетки потенциала действия. Кальций изменяет конформацию молекулы тропомиозина, в результате чего активные зоны молекулы актина открываются для присоединения головок миозина. Само это присоединение осуществляется с помощью так называемых водородных мостиков, которые очень прочно связывают две белковые молекулы — актин и миозин — и способны в таком связанном виде находиться очень долго.
Для отсоединения миозиновой головки от актина необходимо затратить энергию аденозинтрифосфа-та (АТФ), при этом миозин выступает в роли АТФазы (фермента, расщепляющего АТФ). Расщепление АТФ на аденозиндифосфат (АДФ) и неорганический фосфат (Ф) высвобождает энергию, разрушает связь между актином и миозином и возвращает головку миозина в исходное положение. В дальнейшем между актином и миозином могут снова образовываться поперечные связи.
При отсутствии АТФ актин-миозиновые связи не разрушаются. Это и является причиной трупного окоченения (rigor mortis) после смерти, т. к. останавливается выработка АТФ в организме — АТФ предотвращает мышечную ригидность.
Даже при мышечных сокращениях без видимого укорочения (изометрические сокращения, см. выше) активируется цикл формирования поперечных связей, мышца потребляет АТФ и выделяет тепло. Головка миозина многократно присоединяется на одно и то же место связывания актина, и вся система миофиламентов остается неподвижной.
Внимание
: Сократительные элементы мышц актин и миозин сами по себе не способны к укорочению. Мышечное укорочение является следствием взаимного скольжения миофиламентов относительно друг друга (механизм скольжения филаментов).
Как же образование поперечных связей (водородных мостиков) переходит в движение? Одиночный саркомер за один цикл укорачивается приблизительно на 5-10 нм, т.е. примерно на 1 % своей общей длины. За счет быстрого повторения цикла поперечных связей возможно укорочение на 0,4 мкм, или 20% своей длины. Поскольку каждая миофибрилла состоит из множества саркомеров и во всех них одновременно (но не синхронно) образуются поперечные связи, суммарно их работа приводит к видимому укорочению всей мышцы. Передача силы этого укорочения происходит через Z-линии миофибрилл, а также концы сухожилий, прикрепленных к костям, в результате чего и возникает движение в суставах, через которые мышцы реализуют перемещение в пространстве частей тела или продвижение всего тела.
Гипотеза рычага
Теперь пришло время подробней разобраться, что же происходит с миозином при мышечном сокращении. Начнем с общепринятой в настоящее время теории, известной под названием «Гипотеза рычага».
Посмотрим внимательнее на молекулу миозина (а конкретнее — самого удобного для исследований миозина II, рис. 7). Понятно, что в головке миозина должно быть как минимум два важных места — одно, хватающееся за актин, и второе, в которое залезает АТФ. Исследователи, работающие с миозином, остроумно назвали «актиновый» участок головки «пастью», а «АТФный» — «карманом». И пертурбации, происходящие с миозином, можно описать довольно грубым выражением: «закрой пасть и держи карман шире».
|
Дело в том, что, чтобы АТФный карман открылся и в него мог попасть АТФ, актиновая пасть должна быть закрыта (то есть миозин должен сидеть на актине): закрытая верхняя челюсть пасти оттягивает створку кармана, и тот открывается. АТФ влезает в широко раскрытый карман.
И вот тут начинается самое интересное. Гидролиз АТФ может происходить только в закрытом кармане, а для того, чтобы карман закрылся, должна открыться пасть — то есть миозин должен отвалиться от актина. Но это еще не всё. Чтобы обеспечить гидролиз, окрестности кармана должны немного перестроиться, сдвинуться. Сдвигаясь, околокарманные участки вызывают небольшие изменения соседних областей, которые, в свою очередь, приводят к тому, что жесткий домен миозина под названием «конвертер» перебрасывается из одного устойчивого положения в другое и тянет за собой миозиновый хвост, отклоняя его на целых 60°. Курок взводится.
Теперь начинается следующий акт. Миозин с карманом, набитым АДФ и фосфатом, должен обязательно прильнуть к актину и закрыть пасть, потому что иначе выплюнуть фосфат он не в состоянии (то есть чисто теоретически он его когда-нибудь выплюнет, но очень нескоро; поэтому миозин — это, по сути, актин-зависимая АТФаза). Миозин сначала слабо связывается с актином при помощи электростатических взаимодействий, а затем запускается процесс закрытия пасти. Происходит это так. В результате конформационных изменений миозиновая головка разворачивается к актиновой нити таким образом, что, во-первых, образует контакт, очень большой по площади (больше 18 нм2!), а во-вторых, миозин сцепляется сразу с двумя актиновыми молекулами с помощью гидрофобных и электростатических взаимодействий, в результате чего сродство миозина к актину оказывается в тысячу раз выше, чем при первом соединении.
Итак, миозин выплевывает фосфат и, крепко-накрепко вцепившись в актин, претерпевает обратные конформационные изменения — хвост его «выстреливает», сдвигается относительно головки. Это происходит сразу на множестве молекул миозина и потому приводит к движению актиновой нити относительно миозиновой, а следовательно — и к сокращению мышцы. После этого АДФ выбрасывается из кармана. Миозин остается сцеплен с актином; пасть его закрыта — даже заперта! — крепко-накрепко, и если клетка мертва и все АТФ в ней уже закончились, то на этом грустном моменте история заканчивается, миозин и актин так и остаются в навсегда сцепившемся, застывшем состоянии, а у организма начинается трупное окоченение. Более оптимистичный сценарий, характерный для живой клетки с солидным запасом АТФ, предполагает, что в карман (который, как мы помним, головка с закрытой пастью держит шире) влезает новая молекула АТФ, пасть открывается, миозин отлипает от актина и цикл повторяется заново.
Связь между длиной саркомера и силой мышечных сокращений[править | править код]
рис. 2. Зависимость силы сокращений от длины саркомера
Наибольшую силу сокращений мышечные волокна развивают при длине 2-2,2 мкм. При сильном растяжении или укорочении саркомеров сила сокращений снижается (рис. 2). Эту зависимость можно объяснить механизмом скольжения филаментов: при указанной длине саркомеров наложение миозиновых и актиновых волокон оптимально; при большем укорочении миофиламенты перекрываются слишком сильно, а при растяжении наложение миофиламентов недостаточно для развития достаточной силы сокращений.
Влияние растяжения на силу сокращений: кривая растяжения в покое[править | править код]
рис. 4. Влияние предварительного растяжения на силу сокращения мышцы. Предварительное растяжение повышает напряжение мышцы. Результирующая кривая, описывающая взаимоотношения длины мышцы и силы ее сокращения при воздействии активного и пассивного растяжения, демонстрирует более высокое изометрическое напряжение, чем в покое
Важным фактором, влияющим на силу сокращений, является величина растяжения мышцы. Тяга за конец мышцы и натяжение мышечных волокон называются пассивным растяжением. Мышца обладает эластическими свойствами, однако в отличие от стальной пружины зависимость напряжения от растяжения не линейна, а образует дугообразную кривую. С увеличением растяжения повышается и напряжение мышцы, но до определенного максимума. Кривая, описывающая эти взаимоотношения, называется кривой растяжения в покое
.
Данный физиологический механизм объясняется эластическими элементами мышцы — эластичностью сарколеммы и соединительной ткани, располагающимися параллельно сократительным мышечным волокнам.
Также при растяжении изменяется и наложение друг на друга миофиламентов, однако это не оказывает влияния на кривую растяжения, т. к. в покое не образуются поперечные связи между актином и миозином. Предварительное растяжение (пассивное растяжение) суммируется с силой изометрических сокращений (активная сила сокращений).
Архитектура скелетных мышц человека
1.1. Классификация мышц
Существуют различные классификации скелетных мышц: по форме и размерам, по направлению волокон, по функции, по отношению к суставам.
Классификация по направлению мышечных волокон
Для конечностей наиболее типичны веретенообразные и перистые мышцы. Если волокна проходят параллельно продольной оси мышцы, она называется веретенообразной. Если мышечные волокна располагаются под углом к продольной оси мышцы, она называется перистой.
Из-за существования мышц с различным ходом мышечных волокон в анатомии, физиологии и биомеханике мышц утвердились понятия анатомического и физиологического поперечников.
Если произвести разрез мышцы в плоскости, перпендикулярной линии, соединяющей ее начало и конец (длиннику мышцы), и измерить площадь полученной фигуры (площадь поперечного сечения мышцы), то получим значение анатомического поперечника.
Если произвести разрез мышцы в плоскости, перепендикулярной ходу мышечных волокон, и измерить площадь полученных фигур, то сумма площадей будет характеризовать значение физиологического поперечника мышцы.
Анатомический поперечник у веретенообразной мышцы совпадает с ее физиологическим поперечником, в то время как у мышцы перистой физиологический поперечник больше анатомического.
Классификация по количеству головок
Некоторые мышцы имеют несколько головок. Такие мышцы называют соответственно числу головок двуглавыми, трехглавыми и т.д.
Классификация мышц по их отношению к суставам
Мышцы делят на группы по их отношению к суставам. Односуставные мышцы оказывают действие на один сустав. Если мышца перекидывается через два или более суставов, она называется двусуставной или многосуставной.
Рекомендую обратить внимание на учебные пособия «Биомеханика мышц» и «Гипертрофия скелетных мышц человека«
Возле двуосного сустава мышцы группируются соответственно двум его осям движения (сгибание — разгибание, приведение — отведение). К шаровидному суставу, имеющему три оси движения, мышцы прилежат с нескольких сторон и действуют на него в разных направлениях. Так, например, у плечевого сустава имеются мышцы-сгибатели и разгибатели, осуществляющие движения вокруг фронтальной оси, отводящие и приводящие мышцы — вокруг сагиттальной оси и мышцы-вращатели – вокруг продольной оси.
Классификация мышц по их функции
В зависимости от функции различают мышцы-синергисты и мышцы-антагонисты. Как правило, на каждый сустав в одном направлении действует две или более мышц. Такие содружественные по направлению действия мышцы называют синергистами. Мышцы, действующие на сустав в противоположном направлении (сгибатели и разгибатели), являются антагонистами.
Классификация мышц по особенностям прикрепления и выполняемой функции
П.Ф. Лесгафтом (1905) предложена классификация мышц в зависимости от их морфометрических характеристик П.Ф. Лесгафт различал мышцы сильные и мышцы ловкие. Он писал: « …мышцы по преимуществу сильные начинаются и прикрепляются к большим поверхностям, удаляясь по мере увеличения поверхности прикрепления от опоры рычага, на которой он действует; физиологический поперечник таких мышц относительно мал, несмотря на что они могут проявить большую силу при небольшом напряжении, почему и не так легко утомляются. Они действуют преимущественно всею своею массою и не могут производить мелких оттенков при движении; силу свою они проявляют с относительно малою скоростью и состоят чаще всего из коротких мышечных волокон. Мышцы второго типа, отличающиеся ловкостью в своих действиях, начинаются и прикрепляются на небольших поверхностях, близко к опоре рычага, на который действуют; физиологический поперечник их относительно велик, они действуют с большим напряжением, скорее утомляются, состоят чаще всего из длинных волокон и могут действовать отдельными своими частями, производя различные оттенки движений. Это будут мышцы, допускающие главным образом ловкие и быстрые движения».
1.2. Макроструктура мышцы
Основными структурными элементами скелетной мышцы являются мышечные волокна и соединительнотканные элементы, выполняющие в мышце вспомогательные функции.
Мышечные волокна, объединенные в пучки, формируют брюшко мышцы, переходящее в сухожилие. Окончания мышечных волокон «специализируются» в передаче силы сухожилию. Мышечные волокна по мере приближения к сухожилию значительно сужаются, и диаметр их уменьшается почти на 90%. Сужение волокон придает брюшку мышцы его типичную веретенообразную форму. На конце каждого волокна имеются складки. Они обеспечивают распределение сократительной силы на большей площади, тем самым, снижая нагрузку на поверхность волокна. Кроме того, передача силы под углом обусловливает сдвигающую нагрузку на соседние структуры.
Сухожилия состоят из плотной волокнистой соединительной ткани, богатой коллагеновыми волокнами, формируются как продолжение внутримышечных соединительнотканных элементов и вплетаются в надкостницу. Сухожилие снаружи покрыто футляром из плотной волокнистой соединительной ткани. В соединительнотканных прослойках проходят кровеносные сосуды и нервы. Сухожилие мало растяжимо, обладает значительной прочностью и выдерживает огромные нагрузки. Более подробно о механических свойствах сухожилия будет рассказано в третьей лекции.
Скелетные мышцы имеют определенные особенности прикрепления к костям. Проксимальный отдел мышцы начинается от одной кости – это начало мышцы. Дистальный конец – сухожилие – прикрепляется к другой кости – это прикрепление мышцы. При сокращении мышцы один ее конец остается неподвижным (фиксированная точка), другой изменяет свое положение (подвижная точка). Иногда фиксированная и подвижная точки меняются местами.
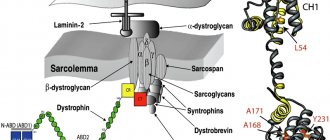
Соединительно-тканные оболочки. Поперечный разрез брюшка мышцы свидетельствует о его сложной структуре. Снаружи мышца окружена плотной соединительной тканью — эпимизием. Эпимизий состоит из пучков коллагеновых волокон. Разрезав эпимизий можно увидеть пучки мышечных волокон как бы «завернутых» в оболочку соединительной ткани. Эта соединительнотканная оболочка называется перимизий. Перимизий также достаточно плотный и относительно толстый. Разрезав перимизий, можно увидеть отдельные мышечные волокна, окруженные рыхлой соединительною тканью. Эта оболочка называется эндомизий (рис.1.1).
Рис. 1.1. Соединительнотканные структуры мышцы (В.С. Гурфинкель, Ю.С. Левик, 1985): 1 – перимизий; 2 –эндомизий, 3 – эпимизий
Фасции представляют собой соединительнотканные футляры для мышц. Они отделяют мышцы друг от друга, создают опору для мышцы при ее сокращении, служат местом начала для некоторых мышц.
Строение фасций зависит от функций мышц, давления, которое мышцы оказывают на фасции при своем сокращении. В тех местах, где мышцы много работают, фасции хорошо развиты, плотные, подкреплены сухожильными волокнами и по внешнему виду напоминают тонкое, широкое сухожилие (широкая фасция бедра, фасция голени).
Функции соединительной ткани
1. В процессе развития соединительная ткань выполняет функцию каркаса (мягкого скелета мышцы), на котором фиксируются мышечные волокна. После завершения развития мышц соединительная ткань продолжает удерживать их вместе и во многом определяет структуру мышечного брюшка.
2. В перимизии располагаются каналы для кровеносных сосудов и нервов, обслуживающих мышечные волокна.
3. Соединительная ткань противостоит пассивному растяжению мышцы и обеспечивает такое распределение сил, при котором вероятность повреждения мышечных волокон сводится к минимуму. Кроме того, свойство эластичности, обусловленное эластиновыми фибриллами и коллагеновыми пучками, позволяет брюшку восстановить свою форму после устранения действия пассивных сил.
4. Посредством эндомизия часть силы, развиваемой мышечным волокном передается сухожилию.
1.3. Микроструктура мышцы
Рассмотрим подробно строение основного структурного элемента мышцы – мышечного волокна.
Поперечнополосатая (скелетная) мышца образована расположенными параллельно друг другу мышечными волокнами длиной от 4 см и более и толщиной до 0,1 мм. Каждое волокно имеет цилиндрическую форму, покрыто двумя оболочками: базальной мембраной и сарколеммой. Между оболочками мышечного волокна находятся клетки-сателлиты. Внутри волокно заполнено гелеобразным содержимым — саркоплазмой. В саркоплазме находятся: миофибриллы, ядра, митохондрии, рибосомы, лизосомы и др. Каждая миофибрилла как муфтой окружена саркоплазматическим ретикулумом. В нем находятся ионы Са2+. В сарколазме также содержится белок миоглобин, который, подобно гемоглобину, может связывать 02. В зависимости от количества миоглобина в мышечных волокнах различают так называемые красные и белые мышечные волокна.
Миофибриллы являются основными сократительными элементами мышцы. Их внешний вид можно сравнить со стеблем бамбука. Длинные участки — это саркомеры, а промежутки между ними — Z-диски, рис.1.2.
Рис. 1.2. Схема строения миофибриллы
1.4. Строение саркомера
Участок миофибриллы между двумя Z-дисками называется саркомером. В обе стороны от Z-диска отходят тонкие филаменты, а в середине саркомера находятся толстые нити. В определенных участках саркомера толстые и тонкие нити перекрываются. Этому участку соответствует темный диск, в то время, как в районе светлого диска находятся только актиновые нити. Средняя часть диска темного диска более светлая; она называется Н зоной, и, в свою очередь, подразделяется надвое линией М, которая делит миозиновые нити на две равные части. Поперечный разрез миофибриллы свидетельствует о том, что в соте вокруг одного толстого филамента размещаются шесть тонких филаментов. Однако в саркомере таких сот много. Расчеты показывают, что в одном саркомере диаметром 1 мкм содержится 1261 толстый филамент и 5292 тонких филаментов. При увеличении площади саркомера отношение количества тонких филаментов к количеству толстых уменьшается с 12 (12 тонких филаментов на один толстый) до 4,19 (5292 тонких на 1261 толстый), если диаметр саркомера достигает 1 мкм.
Строение толстого филамента
Основным структурным элементом толстого филамента является белок миозин. Молекула миозина состоит из двух частей: длинного палочкообразного участка («хвоста») и присоединенного к одному из его концов глобулярного участка, который представлен двумя одинаковыми «головками». Молекулы миозина расположены в толстом филаменте таким образом, что головки регулярно распределяются по всей ее длине, кроме небольшого срединного участка, где их нет («голая» зона), рис.1.3.
Рис. 1.3. Строение толстого филамента (В.Л. Быков, 1998)
Строение тонкого филамента
Каждый тонкий филамент образован двумя спиральными нитями из молекул актина, закрученными один вокруг другого и двух вспомогательных белков тропомиозина и тропонина. Оба вспомогательных белка (тропомиозин и тропонин) подавляют взаимодействие актина с миозином в отсутствии ионов кальция, рис.1.4.
Рис. 1.4. Тонкий филамент, состоящий из молекул актина, тропомиозина и тропонина (Дж.Х. Уилмор, Д.Л. Костилл, 1997)
1.5. Теория скользящих нитей
Способ сокращения волокон скелетной мышцы был определен в результате двух различных исследований, проведенных в начале 1950-х годов при участии ученых Эндрю и Хью Хаксли. В то время, когда Хью Хаксли проводил свои исследования при помощи электронного микроскопа, Эндрю Хаксли использовал интерференционный микроскоп для изучения характеристик мышечных волокон лягушки во время сокращения и расслабления. Он обнаружил, что во время сокращения светлый диск становился короче, тогда как длина темного диска не изменялась; в то же время бледная Н-зона в темном диске сужалась и могла вообще исчезнуть. Оба ученых независимо друг от друга выдвинули предположение, что полученные ими результаты можно объяснить скользящим движением филаментов актина и миозина относительно друг друга. Теория скольжения филаментов сегодня является общепризнанной. Кратко ее сущность состоит в следующем.
Установлено, что во время сокращения (укорочения) саркомера длина тонкого и толстого филаментов не меняется. При этом неизменной особенностью сокращения является центральное положение толстого филамента в саркомере, посередине между Z-дисками. При поступлении по аксону мотонейрона нервного импульса нервные окончания выделяют нейромедиатор – ацетилхолин, который «привязывается» к рецепторам сарколеммы. При достаточном его количестве электрический заряд передается по всей длине мышечного волокна. Этот процесс называется развитием потенциала действия. Кроме деполяризации мембраны мышечного волокна, электрический импульс проходит через сеть трубочек волокна (Т-трубочки и саркоплазматический ретикулум) во внутреннюю часть клетки. Поступление электрического импульса приводит к выделению значительного количества ионов Са2+ в саркоплазму. Следует заметить, что концентрация ионов Са2+ в саркоплазматическом ретикулуме выше, чем в саркоплазме. После этого ионы Са2+ связываются с тропонином, который начинает процесс сокращения, «поднимая» молекулы тропомиозина с активных участков актиновых филаментов.
Миозин в покое неактивен, так как на его головке находится отрицательно заряженный комплекс Mg, ATФ, не позволяющий белку проявлять АТФ-азные свойства. После поступления ионов Са2+ происходит нейтрализация заряда на головке, что приводит миозин в возбужденное состояние. После этого миозиновые головки начинают прикрепляться к активным участкам тонкого филамента.
Когда миозиновая головка толстого филамента прикрепляется к тонкому филаменту, между толстым и тонким филаментами образуется поперечный мостик. При взаимодействии с актином каждая миозиновая молекула ежесекундно гидролизует до 10 молекул АТФ. За счет энергии, высвобождающейся при расщеплении АТФ, миозиновая головка поворачивается, что приводит к скольжению толстого и тонкого филаментов относительно друг друга. В конце гребка (поворота) к миозиновой головке присоединяется новая молекула АТФ, что приводит к отделению головки от актина и присоединению к новому активному участку тонкого филамента до тех пор, пока миозиновые головки не достигнут Z-диска. Так как при сокращении саркомера расстояние между Z-дисками уменьшается, происходит уменьшение его длины. Одновременное сокращение всех саркомеров приводит к уменьшению длины миофибриллы и мышечного волокна. Ввиду того, что саркомер представляет собой не плоскую, а объемную структуру, при его сокращении происходит не только уменьшение его длины, но и увеличение его поперечного сечения (когда тонкие нити втягиваются в толстые), поперечного сечения мышечных волокон и всей мышцы. рис.1.5.
Рис. 1.5. Схема, иллюстрирующая взаимодействие толстого и тонкого филаментов (Л. Страйер, 1985)
Прекращение нервного импульса приводит к расщеплению ацетилхолина и разрыву поперечных мостиков между актином и миозином. Благодаря действию «кальциевого насоса» ионы Са2+ возвращаются в саркоплазматический ретикулум, актин и миозин инактивируются, длина саркомера возвращается к исходному значению. Мышца расслабляется. Мышечное сокращение может продолжаться до тех пор, пока не истощатся запасы ионов кальция. Затем они снова перекачиваются в саркоплазматический ретикулум посредством активной системы «кальциевого насоса». Следует отметить, что для осуществления этого процесса необходима энергия АТФ.
Каким образом доставляется энергия к филаментам? Кроме участка для прикрепления к тонкому филаменту, миозиновая головка содержит участок, в котором локализуется АТФ. Освобождающая вследствие реакции гидролиза (расщепления АТФ) энергия используется для прикрепления миозиновой головки к тонкому филаменту, а после осуществления поворота головки – для отделения миозиновой головки от тонкого филамента.
Источники[править | править код]
- Harrison BC. et al. 2011. lib or not lib? Regulation of myosin heavy chain gene expression in mice and men. Skeletal Muscle. 1 (1): 5. doi: 10.1186/2044-5040-1-5.
- Andersen, J.L., et al. 1994. Myosin heavy chain isoforms in single fibres from m. vastus lateralis of sprinters: Influence of training. Acta Physiologica Scandinavica 151 (2): 135-42.
- ↑ 3,03,1 Andersen T.L, Aagaard P. 2000. Myosin heavy chain IIX overshoot in human skeletal muscle. Muscle Nerve. 23 (7): 1095-104.
- Andersen, L.L., et al. 2010. Early and late rate of force development: Differential adaptive responses to resistance training? Scandinavian Journal of Medicine and Science in Sports 20 (1): el62-69. doi:10.1111/j.l600-0838.2009.00933.x.
- Anderson, K., and Behm, D.G. 2004. Maintenance of EMG activity and loss of force output with instability. Journal of Strength and Conditioning Research 18:637-40.
- Aagaard, R, et al. 2011. Effects of resistance training on endurance capacity and muscle fiber composition in young top-level cyclists. Scandinavian Journal of Medicine and Science in Sports 21 (6): e298-307. doi:10.1111/j. 1600-0838.2010.01283.x.
- Henneman, E., Somjen, G., and Carpenter, D.O. 1965. Functional significance of cell size in spinal motoneurons./. Neurophysiol. 28:560-580.
- ↑ 8,08,1 Latash, M.L. 1998. Neurophysiological basis of movement. Champaign, IL: Human Kinetics.
- Brooks, G.A., Fahey, T.D., and White, T.P. 1996. Exercise physiology: Human bioenergetics and its applications. 2nd ed. Mountainview, CA: Mayfield.
- Schmidtbleicher, D. 1992. Training for power events. In Strength and power in sport, ed. P.V. Komi, 381-95. Oxford, UK: Blackwell Scientific.
- Wiemann, K., and Tidow, G. 1995. Relative activity of hip and knee extensors in sprinting—Implications for training. New Studies in Athletics 10 (1): 29-49.