А.Ю. Лубнин, А.А. Потапов, И.В. Никитенкова, И.А. Савин, К.А. Попугаев, А.В. Ошоров
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Для корреспонденции: Лубнин Андрей Юрьевич — д-р мед. наук, профессор, руководитель отдела анестезиологии, реанимации и интенсивной терапии ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва; е-mail
Для цитирования: Лубнин А.Ю., Потапов А.А., Никитенкова И.В., Савин И.А., Попугаев К.А., Ошоров А.В. Внезапный отек мозга после неосложненной двухсторонней краниопластики. Клиническое наблюдение и обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2020;2:137–145. DOI: 10.21320/1818-474X-2020-2-137-145
Реферат
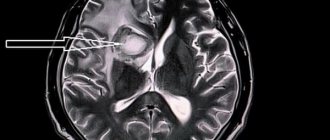
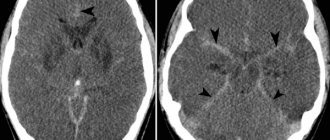
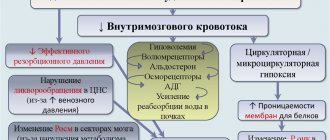
В работе приведено описание клинического наблюдения острого развития отека мозга после неосложненной двухсторонней краниопластики. В обсуждении и обзоре литературы рассматриваются механизмы развития отека мозга, возникающего после закрытия обширных костных дефектов черепа, в особенности больших и двухсторонних, а также возможная роль субгалеальных дренажей.
Ключевые слова: краниопластика, осложнения, острый отек мозга
Поступила: 03.03.2020
Принята к печати: 02.06.2020
Читать статью в PDF
Статистика Plumx русский
Способы пластики костного дефекта черепа
Костный дефект черепа – это отверстие в нем, которое образуется после нейрохирургического вмешательства на органах центральной нервной системы или вследствие травмы. Поговорим подробнее о дефектах черепа в медицинской практике.
После удаления участка кости и образования отверстия в черепе пациенты переживают не только психологический дискомфорт, но и так называемый «синдром трепанированного черепа». И в том и в другом случае, отверстие нужно закрывать имплантатом. А теперь обо всем подробнее.
Литература
- Arac A., Blanchard V., Steinberg G.K. Assessment of outcome following decompressive craniectomy for malignant middle cerebral artery infarction in patients older than 60 years of age. Neurosurg. Focus. 2009; 26: E3. DOI: 10.3171/2009.3.FOCUS0958
- Bohman L.E., Schuster J.M. Decompressive craniectomy for management of traumatic brain injury: an update. Curr. Neurol. Neurosci. Rep. 2013; 13: 392. DOI: 10.1007/s11910-013-0392-x
- Bor-Seng-Shu E., Figueiredo E.G., Amorium R.L., et al. Decompressive craniectomy: a meta-analysis of influences on intracranial pressure and cerebral perfusion pressure in the treatment of traumatic brain surgery. J. Neurosurg. 2012; 117: 589–596. DOI: 10.3171/2012.6.JNS101400
- Coutinho J.M. Cerebral venous thrombosis. J. Thromb. Haemost. 2015: 13(Suppl. 1): S238–S244. DOI: 10.1111/jth.12945
- Merenda A., DeGeorgia M. Craniectomy for acute ischemic stroke: how to apply the data to the bedside. Curr. Opin. Neurol. 2010; 23: 53–58. DOI: 10.1097/WCO.0b013e328334bdf4
- Rahme R., Zuccarello M., Kleindorfer D., et al. Decompressive hemicraniectomy for malignat middle cerebral artery territory infarction: is life worth living? J. Neurosurg. 2012; 117: 749–754. DOI: 10.3171/2012.6.JNS111140
- Raza E., Shamim M.S., Wadiwala M.F., et al. Decompressive surgery for malignant cerebral venous sinus thrombosis: a retrospective case series from Pakistan and comparative literature review. J. Stroke Cerebrovasc. Dis. 2014; 23: e13–e23. DOI: 10.1016/ j.jstrokecerebrovasdis.2013.07.045
- Sahuquillo J., Martinez-Ricarte F., Poca M.A. Decompressive craniectomy in traumatic brain injury after DECRA trial. Where do we stand? Curr. Opin. Crit. Care. 2013; 19: 101–106. DOI: 10.1097/MCC.0b013e3285eba1a
- Wijdicks E.F., Sheth K.N., Carter B.S., et al. AHA Stroke Council. Recommendations for management of cerebral and cerebellar infarction with swelling: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014; 45: 1222–1238. DOI: 10.1161/01.str.0000441965.15164.d6
- Hill C.S., Luoma A.M., Wilson S.R., Kitchen N. Titanium cranioplasty and prediction of complications. Br. J. Neurosurg. 2012; 26: 832–837. DOI: 10.3109/02688697.2012.692839
- Klinger D.R., Madden C., Beshay J., et al. Autologous and acrylic cranioplasty: a review of 10 eyars and 258 cases. World Neurosurg. 2014; 82: e525–e530. DOI: 10.1016/j.wneu.2013.08.005
- Schwarz F., Dunisch P., Walter J., et al. Cranioplasty after decompressive craniectomy: is there a rationale for an initial artificial bone-substitute implant? A single-center experience after 631 procedures. J. Neurosurg. 2015; 124: 1–6. DOI: 10.3171/2015.4.JNS159
- Durga P., Sahu B.P. Neurological deterioration during intubation in cervical spine disorders.Indian J.Anaesth. 2014; 58: 684–692. DOI: 10.4103/0019–5049.147132
- Harris E.A. Airway management for the patient with an unstable cervical spine. In: Ruskin K.J., Rosenbaum S.H., Rampil I.J. (Eds.). Fundamentals of Neuroanesthesia. 2014. Oxford Univ. Press. P. 288–303.
- Amoozegar F., Ronskley P.E., Sauve R., Menon B.K. Hormonal contraceptives and cerebral venous thrombosis risk: a systematic review and meta-analysis. Front. Neurol. 2015; 6, A7: 1–11. DOI: 10.3389/fneur.2015.00007
- Coutinho J.M., Majoie C.B., Coert B.A., Stam J. Decompressive hemicraniectomy in cerebral sinus thrombosis: consecutive case series and review of the literature. Stroke. 2009; 40: 2233–2235. DOI: 10.1161/STROKEAHA.108.543421
- Ferro J.M., Canhao P. Cerebral venous sinus thrombosis: update on diagnosis and management. Curr. Radiol Rep. 2014; 16: 523. DOI: 10.1007/s11886-014-0523-2
- Fischer C., Goldstein J., Edlow J. Cerebral venous sinus thrombosis in the emergency department: retrospective analysis of 17 cases and review of the literature. J. Emerg. Med. 2010; 38: 140–147. DOI: 10.1016./jemermed.2009.08.061
- Kenmur C.L., Jovin T., Jadhav A. Cerebral venous sinus thrombosis in users of a hormonal vaginal ring. Obstet. Gynecol. 2015; 126: 830–833. DOI: 10/1097/AOG.0000000000000931
- Siudut J., Swiat M., Undas A. Altered fibrin clot properties in patients with cerebral venous sinus thrombosis: Association with the risk of recurrence. Stroke. 2015; 46: 2666–2668. DOI: 10.1161/STROKEAHA.115.009528
- Agner C., Dujovny M., Gaviria M. Neurocognitive assessment before and after cranioplasty. Acta Neurochir. 2002; 144: 1033–1040.
- Decaminada N., Pernter P., Imondi A., Tomassini A. CT perfusion evaluation of cerebral hemodynamics before and after cranioplasty. Neuroradiol. J. 2008; 21: 459–471. DOI: 10.1177/19714009080210042
- Erdogan E., Duz B., Kokaoglu M., Izci Y., Nimurkaynak E. The effect of cranioplasty on cerebral hemo-dynamics: evaluation with transcranial Doppler sonography. Neurol. India. 2003; 51: 479–481.
- Kemmling A., Duning T., Lemcke L., et al. Case report of MR perfusion imaging in sinking skin flap syndrome: growing evidence for hemodynamic impairment. BMC Neurol. 2010; 10: 80. DOI: 10.1186/1471-2377-10-80
- Jelcic N., Della Puppa A., Mottaran R., et al. Case series evidence for improvement of executive functions after late cranioplasty. Brain Inj. 2013; 27: 1723–1726. DOI: 10.3109/02699052.2013.844857.
- Jeyaraj P. Importance of early cranioplasty in reversing the “Syndrome of the trephine/motor trephine syndrome/sinking skin flap syndrome”. J. Maxillofac. Oral. Surg. 2015; 14: 666–673. DOI: 10.1007/s12663-014-0673-1
- Kuo J.R., Wang C.C., Chio C.C., Cheng T.J. Neurological improvement after cranio-plasty — analysis by transcranial Doppler ultrasonography. J. Clin. Neurosci. 2004; 11: 486–489. DOI: 10.1016/j.jocn.2003.06.005
- Song J., Liu M., Mo X., et al. Beneficial impact of early cranioplasty in patients with decompressive craniectomy: evidence from trenscranial Doppler ultrasonography. Acta Neurochir. 2014; 156: 193–198. DOI: 10.1007/s00701-013-1908-5
- Winkler P.A., Stummer W., Linke R., et al. The influence of cranioplasty on postural blood flow regulation, carabrovascular reserve capacity, and cerebral glucose metabolism. Neurosurg. Focus. 2000; 8: e9. DOI: 10.3171/foc.2000.8.1.1920
- Sakamoto S., Eguchi K., Kiura Y., et al. CT perfusion imaging in the syndrome of the sinking flap before and after cranioplasty. Clin. Neurol. Neurosurg. 2006; 108: 583–585. DOI: 10.1016/j.clineuro.2005.03.012
- Annan M., De Toffol B., Hommet C., Mondon K. Sinking skin flap syndrome (or syndrome of the trephined): A review. Br. J. Neurosurg. 2015; 29: 314–318. DOI: 10.3109/02688697.2015.1012047
- Honeybul S. Neurological susceptibility to a skull defect. Surg. Neurol. Int. 2014; 5: 83. DOI: 10.4103/2152–7806.133886
- Honeybul S., Janzen C., Kruger K., Ho K.M. The incidence of neurological instability to a skull defect. World Neurosurg. 2015; pii: S1878–8750(15)01249–8. DOI: 10.1016/j.2neu.2015.09.081.
- Chan K.W., Datta N.N. Iatrogenic acute subdural hematoma due to drainage catheter. Surg. Neurol. 2000; 54: 444–446.
- Karamchandani K., Chouhan R.S., Bithal P.K., Dash H.H. Severe bradicardia and hypotension after connecting negative pressure to the subgaleal drain during craniotomy closure. Br. J. Anaesth. 2006; 96: 608–610. DOI: 10.1093/bja/ael063
- Mohindra S., Mukherjee K.K., Chhabra K.K., Khosla V.K. Subgaleal suction drain leading to fatal sagittal sinus hemorrhage. Br. J. Neurosurg. 2005; 19: 352–354. DOI: 10.1080/02688690500305308
- Prabhakar H., Bithal P.K., Chouhan R.S., Dash H.H. Rupture of intracranial aneurysm after partial clipping due to aspiration drainage system — a case report. Middle East J. Anaesthesiol. 2008; 19: 1185–1190.
- Roth J., Galeano E., Milla S., et al. Multiple epidural hematomas and hemodynamic collapse caused by a subgaleal drain and suction-induced intracranial hypotension: case report. Neurosurgery. 2011; 68: E271–E276. DOI: 10.1227/NEU.0b013e3181fe6165
- Toshniwal G.R., Bhagat H., Rath G.P. Bradycardia following negative pressure suction of subgaleal drain during craniotomy closure. Acta Neurochir. 2007; 149: 1077–1079. DOI: 10.1007/s00701-007-1246-6
- Van Roost D., Thees C., Brenke C., et al. Pseudohypoxic brain swelling: a newly defined complication after uneventful brain surgery, probably related to suction drainage. Neurosurgery. 2003; 53: 1315–1326. DOI: 10.1227/01.neu.0000093498.08913.9e
- Yadav M., Nikhar S.A., Kulkarni D.K., Gopinath R. Cardiac arrest after connecting negative pressure to the subgaleal drain during craniotomy closure. Case Rep Anesthesiol. 2014; 2014: Article ID 146870. DOI: 10.1155/2014/146870
- Chitale R., Tjoumakaris S., Gonzalez F., et al. Infratentorial and supratentorial strokes after cranioplasty. Neurologist. 2013; 19: 17–21. DOI: 10.1097/NRL.0b013e31827c6bb6
- Honeybul S. Sudden death following cranioplasty: a complication of decompressive craniectomy for head injury. Br. J. Neurosurg. 2011; 25: 343–345. DOI: 10.3109/02688697.2011.568643
- Lee G.S., Park S.Q., Kim R., Cho S.J. Unexpected severe cerebral edema after cranioplasty: Case report and literature review. J. Korean Neurosurg. Soc. 2015; 58: 76–78. DOI: 10.3340/jkns.2015.58.1.76
- Santana-Cabrera L., Perez-Ortiz C., Rodriguez-Escort C., Sanchez-Palacios M. Massive postoperative swelling following cranioplasty. Int. J. Crit. Illn. Inj. 2012; 2: 107–108. DOI: 10.4103/2229–5151.97277
- Zebian B., Critchley G. Sudden death following cranioplasty: a complication of decompressive craniectomy for head injury. Br. J. Neurosurg. 2011; 25: 785–786. DOI: 10.3109/02688697.2011.623801
- Robles A., Cuevas-Solorzano A. Massive brain swelling and death after cranioplasty: A systematic review. World Neurosurg. 2018; 111: 98–108. DOI: 10.1016/wneu2017.12.061
- Spetzler R.F., Wilson C.D., Weinstein P., et al. Normal perfusion pressure breakthrough theory. Clin. Neurosurg. 1978; 25: 651–672.
- Petrozza P.H. Hyperemic complications following resection of arterio-venous malformation: New througts. J. NS Anesth. 1995; 7: 202.
- Dodson B.A. Normal perfusion pressure breakthrough syndrome: Entity or excuse? J. NS Anesth. 1995; 7: 203–207.
- Al-Rodhan N.R.F. Occlusive hyperemia remains the most logical explanation for the hemodynamic complications of resected intracerebral arteriovenous malformations. J. NS Anesth. 1995; 7: 208–210.
- Moulakakis K.G., Mylonas S.N., Styroeras G.S., Andrikopoulos V. Hyperperfusion syndrome after carotid revascularization. J. Vasc. Surg. 2009; 49: 1060–1068. DOI: 10.1016/j.jvs.2008.11.026
- Medel R., Crowley R.W., Dumont A.S. Hyperperfusion syndrome following endovascular cerebral revascularization. A review. Neurosurg. Forum. 2009; 26: E4. DOI: 10.3171.2009.1.FOCUS08276
- Lieb M., Shah U., Hines G.L. Cerebral hyperperfusion syndrome after carotid intervention: A review. Cardiol. Rev. 2012; 20: 84–89. DOI: 10.1097/CRD.0b013e318237eef8
- Farooq M.U., Goushganian C., Min J., Gorelik P.B. Pathophysiology and management of reperfusion injury and hyperperfusion syndrome after carotid endarterectomy and carotid artery stenting. Exp. Transl. Stroke Med. 2016; 8: 7. DOI: 10.1186/s13231-016-0021-2
Последствия дефектов черепа
Кости черепа не только защищают головной мозг от механического повреждения. Отсутствие одного участка может вызывать у пациента массу неприятных симптомов или осложнений. Именно их наличие служит прямым показанием к хирургической пластике.
Это может быть:
- Головная боль. Она возникает не только в месте дефекта, но захватывать другие участки. Чаще всего симптом усиливается или возникает при смене показателей атмосферного давления и температуры воздуха. Появляется, так называемая, метеочувствительность.
- «Астено-невротический синдром». Сюда входят жалобы на рассеянность, снижение концентрации внимания, трудности в решении интеллектуальных задач, частая смена настроения, снижение способности противостоять стрессам и толерантности к алкоголю.
- Выпячивание содержимого черепа наружу. При кашле или чиханьи, физическом напряжении или нагрузках, часть вещества мозга может выпячиваться через отверстие в черепе, под кожу. Это приводит к травматизации внутренних тканей о края костного дефекта.
- Симптоматическая эпилепсия.
- Расстройства психики.
Особенности проведения операции
К хирургическому вмешательству нельзя приступать при определении воспалительных процессов в полости черепа, в мозговой оболочке или мозге. Противопоказаниями также являются заметные психические отклонения пациента, наличие в полости черепа части костной ткани или инородного предмета, выбухание мозга в проблемной зоне. Если при визуальном осмотре и диагностике не выявлен ни один из перечисленных моментов, назначается операция.
Пластика черепа после трепанации и другие похожие манипуляции называются краниопластикой. Она направлена на восстановление целостности черепа после декомпрессивно-стабилизирующих операций, огнестрельных ранений, падений с высоты, механических повреждений. Выбор технологии вмешательства зависит от сроков проведения пластики, и она бывает первичной (1-2 дня после травмы), первично-отсроченной (до 2 недель), ранней (до 8 недель), поздней (более 2 месяцев).
Существует несколько правил, которых нужно придерживаться при любом типе операции по пластике черепа:
- максимально возможное сохранение элементов костной ткани;
- использование отделившихся осколков в качестве аутотрансплантата;
- строгое соответствие размера пластины и размера области закрытия;
- отсутствие острых и слишком истонченных частей черепа.
Устранение дефекта черепа — достаточно сложная и ответственная операция, первым шагом которой станет иссечение оболочечно-мозгового рубца. Все манипуляции выполняются максимально аккуратно, чтобы избежать травматизации мозговой ткани. Для хорошего сцепления костей черепа и импланта проводится обнажение краев всей проблемной области, а материал обязательно устанавливается «заподлицо» с костями черепа. Чтобы предотвратить такое негативное явление, как смещение трансплантата, проводится надежная фиксация. Обычного ушивания мягких тканей недостаточно.
Краниопластика
Именно так называется операция по восстановлению герметичности черепа. Она призвана восстановить защиту головного мозга от внешних воздействий, нормализовать кровоток и лимфоток, устранить вышеперечисленные симптомы, косметический дефект и снять психологический дискомфорт.
Суть процедуры – закрыть отверстие в черепе имплантатом. Разобраться в великом множестве предлагаемых сегодня медициной имплантатов и выбрать лучший поможет грамотный нейрохирург. Заполните заявку на сайте или позвоните нам для получения консультации ведущего специалиста для правильного выбора имплантата и обсуждения особенностей предстоящей операции.
Мы же расскажем, какие бывают имплантаты для краниопластики и как проводится операция по их установке.
Как проходит реабилитация после операции на головном мозге?
Вначале пациента осматривают врачи реабилитационной бригады, далее по результатам осмотров коллегиально формируется программа реабилитации. Далее с пациентом начинают заниматься инструктор ЛФК, эрготеапевт, нейропсихолог, логопед, проводятся физиопроцедуры и процедуры массажа. Врачи реабилитационной бригады осматривают больного в процессе реализации программы, оценивают динамику состояния больного и корректируют при необходимости задачи реабилитационных мероприятий. В заключении реабилитационной программы проводится итоговый осмотр врачей реабилитационной бригады и формулируются рекомендации для пациента.
Эрготерапия
Бобат-терапия
В чем заключается методика PNF?
Гирудотерапия
Амплипульс (СМТ терапия)
Вакуумная терапия
Имплантаты
Есть перечень обязательных качеств, которыми они должны обладать:
- достаточная прочность;
- биосовместимость;
- легкость;
- пластичность;
- не давать инфекционных осложнений;
- не обладать канцерогенным эффектом.
Имплантаты могут быть изготовлены из собственной кости пациента (аутотрансплантаты) и быть искусственными (ксенотранстплантаты).
Аутотрансплантаты
Это кость, которая была временно удалена для доступа к мозговым тканям пациента. Если кость нужно сохранить для закрытия дефекта черепа позже, ее помещают под кожу живота либо передненаружной поверхности бедра пациента. Если такое сохранение невозможно, используют другие техники использования собственной костной ткани человека. А при невозможности замещения дефекта аутотрансплантатами, прибегают к замещающим их материалам.
Ксенотрансплантанты
Так называемые «искусственные кости» изготавливают из металла (алюминия или титана), используют метилметакрилат или гидроксиапатит.
Каждый из упомянутых имплантатов имеет свои выгодные стороны и недостатки. Например, гидроксиапатит можно использовать при дефектах до 30 квадратных сантиметров. Этот материал обладает полной биосовместимостью. И способен превратиться в собственную костную ткань уже через 18 месяцев при небольших дефектах. А риск инфекционных осложнений у этого вида имплантатов самый низкий среди подобных.
Титан реже всех вызывает местные воспалительные реакции. И из него можно воссоздать утраченные фрагменты лицевого скелета, основания черепа, свод и стенки глазницы. Это делается при помощи моделирования и нейронавигации в предоперационном периоде.
Разобраться во всем многообразии имплантатов, а также узнать какие есть самые современные разработки медицины в области имплантологии, поможет доктор на очном приеме. Заполните заявку на нашем сайте, и мы запишем Вас на прием к ведущему специалисту в области нейрохирургии.
В каждом конкретном случае важно учитывать не только прямую пользу для человека, но и эстетическую и психологическую стороны. А также ограничения, накладываемые на пациента в связи с выбором (например, металлический имплантат не позволяет пациенту в дальнейшем прибегать к МРТ обследованию).
Показания к трепанации
Причины проведения операции – состояния, заболевания, при которых нарушается функционирование головного мозга, кровообращение за счет патологий, сдавливающих структуры мозга, сосуды:
- черепно-мозговые травмы;
- воспалительные процессы;
- увеличение внутричерепного давления;
- тромбы, эмболы, аневризма церебральных сосудов;
- кровоизлияния;
- аномалии развития черепа;
- опухоли;
- полости со сгустками крови и другой жидкостью.
Подготовка
При экстренной операции времени на полное обследование нет, ограничиваются только анализами крови по cito (экстренно), которые включают определение группы крови, резус-фактора, определение уровня гемоглобина, эритроцитов, лейкоцитов, показатели свертывающей системы. Из инструментальных исследований – рентген черепа или КТ. При плановой операции – полный лабораторный анализ мочи, крови, МРТ, консультация кардиолога, терапевта, офтальмолога и других узких специалистов.
За день до операции последний прием пищи – не позднее 6 часов вечера. Исключают жирные, соленые, острые блюда, алкоголь. Прекращают прием лекарственных препаратов, влияющих на свертываемость крови, алкоголя за 7 дней. В день манипуляции запрещено пить, есть, курить. В области разреза сбривают волосы. Выбор анестезии зависит от вида трепанации, чаще общая, реже местная, если необходимо контролировать реакции пациента во время манипуляций.
Положение пациента на операционном столе зависит от трех требований: анестезиологических, локальных, общих. Первые требования – расположение больного не должно затруднять движения грудной клетки, при остановке сердца, дыхания положение не должно мешать экстренным реанимационным мероприятиям. Локальные требования – оптимальное обнажение структур головного мозга, удобный подход нейрохирурга к пациенту. Общие – положение не должно провоцировать ухудшение состояния пациента, осложнения.
При трепанации лобных долей для получения доступа к черепной ямке, хиазмы человека кладут на спину. При манипуляциях на височной, затылочной, теменной зонах положение на боку или затылке с поворотом туловища в противоположную сторону от области операции.