В последнее время ВЖК стали значительной проблемой в детской нейрохирургии. Это объясняется повышением качества выхаживания недоношенных детей с малым весом. По данным литературы среди детей с массой тела менее 2500 г. ВЖК встречаются в 60% случаев. Нейрохирургического пособия требуют дети с тяжелой степенью ВЖК, приводящей к развитию прогрессирующей гидроцефалии. Тяжесть внутрижелудочковых кровоизлияний напрямую зависит от степени недоношенности. 2012 год ознаменовался принятием ВОЗовских нормативов живорожденности. В настоящее время живорожденными считаются младенцы с весом 500 грамм. Выхаживание детей с экстремально низкой массой тела значительно осложняется высокой частотой среди них тяжелых ВЖК. Это категория больных, для которых своевременность и квалифицированность оказания помощи им во многом определяет степень дальнейшей инвалидизации. Оказание помощи этой категории пациентов начинается еще на этапе родильного дома. Выездная бригада оценивает состояние новорожденного пациента и оценивает его транспортабельность.
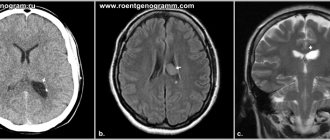
Хорошо видны расширенные боковые желудочки мозга. Тяжесть состояния во многом объясняется выраженной внутричерепной гипертензией.
Лечение в подобных случаях начинаем с серии люмбальных пункций. Противопоказаниями к проведению люмбальных пункций может служить наличие окклюзии или баллотирующего сгустка крови в просвете желудочков. Иногда удается скомпенсировать процесс серией люмбальных пункций. Для снижения ВЧД выполняем вентрикулярные пункции. Многократные вентрикулярные пункции нецелесообразны, так как доказано, что частые вентрикулярные пункции приводят к развитию порэнцефалических кист. Таким образом для длительной разгрузки желудочковой системы часто приходится прибегать к различным дренирующим операциям. Например, вентрикулостомия с последующим наружным дренированием. Данную манипуляцию проводим под УЗ контролем, чтобы визуально контролировать постановку дренажа в просвет бокового желудочка. На снимке хорошо виден катетер в просвете правого бокового желудочка.
Данный снимок выполнен интраоперационно:
Это необходимо т.к. дренаж иногда остается стоять на длительный срок. На фоне дренирования, как правило, купируется гипертензионная симптоматика, нормализуется гемодинамика, купируется судорожный синдром, нормализуется дыхание.
Сложность ситуации в том, что на фоне различных способов дренирования достигнуть окончательной нормализации ликворооттока удается крайне редко. Подобное состояние разрешается как правило шунтирующей операцией. Но и здесь не все просто. Достигнуть санации ликвора достаточной для установки шунта иногда удается только спустя 1-2 месяца. Это превращает данную категорию больных в большую проблему для отделения. Наружный дренаж требует к себе постоянного внимания, и создает серьезный риск инфицирования системы дренажа и развития вентрикулита. Последние 6 лет мы практически не используем наружное дренирование у новорожденных.
Используются методики закрытого дренирования, такие как субгалеальный резервуар и установку резервуаров типа Омайя. Мы применяем эти методики, как первый этап лечения гидроцефалии у недоношенных с ВЖК, позволяющий отсрочить имплантацию шунта до полной санации ликвора.
Субгалеальный резервуар.
Суть метода состоит в установке силиконового катетера в боковой желудочек и выведение его в сформированный под апоневрозом резервуар.Ликвор из желудочковой системы устремляется в субапоневротический резервуар, откуда его можно безболезненно периодически эвакуировать.
Резервуар пунктируется тонкой внутрикожной иглой от 1 до 3 раз в неделю с выведением скопившегося ликвора и введением растворов антисептиков и антибиотиков. По возможности, пациента перевожу на дневной стационар для психологической реабилитации матери. Резервуар выполняет функцию ресивера, порта и амортизатора и позволяет контролировать вентрикуломегалию.
Преимущество данной методики по сравнению с наружным дренированием состоит в том , что она позволяет проводить санацию ликворной системы с минимальным риском инфицирования и значительно облегчает уход за больным. По сравнению с наружным дренированием мы получили более обнадеживающие результаты.
Признаки и симптомы ишемии головного мозга у новорожденных
Заболевание проявляет себя явными симптомами, которые обращают на себя внимание.
- Ребенок легко возбудим, плачет без причин, плохо спит, вздрагивает, у него наблюдается тремор.
- Мышечный тонус понижен, малыш мало двигается, с трудом сосет и глотает.
- Родничок увеличен, внутричерепное давление повышено из-за того, что в головном мозге скапливается жидкость.
- Возникают судороги, подергивания конечностей и головы, а также коматозные состояния с потерей координации движений, сознания.
- Кожа новорожденного приобретает мраморный оттенок.
- Нарушается работа ЖКТ – наблюдаются вздутие, запор, понос.
УЗ – навигация.
Отдельно хотелось бы остановиться на вмешательствах с использованием УЗ-навигации. Данный вид вмешательств относится к категории щадящих и малоинвазивных. При достаточной квалификации хирурга под УЗ контролем можно производить манипуляции с высокой точностью. Если ребенок грудного возраста, то датчик устанавливается на мембрану большого родничка. У старших детей датчик ставится на ТМО, для чего производится наложение трефинационного отверстия, часто и это не требуется, достаточно установить датчик на височную кость, которая даже у подростков сохраняет «прозрачность». Ниже пример осложненного течения гидроцефалии с т.н. изоляцией IV желудочка.
В этом случае УЗ-навигация позволила провести вентрикулярный катетер через отверстие Монро, III желудочек, провести реканализацию водопровода и провести его в IV желудочек, проведя т.о. Панвентрикулостомию:
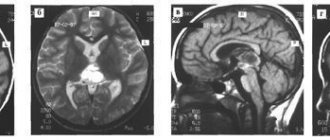
На представленных томограммах у девочки 10 лет имеет место обширная киста хиазмально-селлярной области, затрудняющая отток ликвора через отверстия Монро и вызывающая окклюзионную гидроцефалию.
Под УЗ контролем выполнена пункция кисты через отверстие Монро с последующей ее катетеризацией и имплантацией резервуара Омайя. На последующих томограммах подтверждается точность установки катетера. Гидроцефалия значительно уменьшилась.
В дальнейшем производились регулярные( 1 раз в месяц) пункции резервуара, что обеспечило купирование гидроцефалии. Ребенок посещает обычную школу. Контрольные МРТ спустя год. Видно, что киста сохраняет свой объем, но гидроцефалия купирована.
Очень важная проблема в детской нейрохирургии проблема гнойных заболеваний. Наиболее часто встречаются риногенные осложнения, как в данном случае контактный абсцесс лобной доли. СМ. снимок:
Этот пример имеет больше академическое значение, т.к. в свое время, как в этом случае абсцессы было принято удалять открыто в капсуле.
Послеоперационный снимок:
Хорошо видно, что мозг расправлен. Боковой желудочек не поврежден. В последствие через 6 мес. ребенку выполнена операция краниопластики. Выписан без неврологического дифицита.
В настоящее время удаление абсцесса в капсуле практически не используем. Современные методики малоинвазивные. Мы проводим катетеризацию абсцесса под УЗ навигацией и эвакуацию гноя, что позволяет легко излечивать даже небольшие и глубинно расположенные абсцессы как в этом случае у подростка с болезнью Дауна.
Введение
К неонатальным внутримозговым кровоизлияниям (ВМК) у доношенных новорожденных относят кровоизлияния в паренхиму головного мозга в первые 28 дней жизни, подтвержденные нейровизуализационными исследованиями или вскрытием в отличие от недоношенных новорожденных, у которых кровоизлияния развиваются из герминативного матрикса [1]. Исходы ВМК тяжелые и зависят от области и размеров поражения: тяжелые двигательные нарушения, когнитивный дефицит, поведенческие изменения, симптоматическая эпилепсия и т.д. [2].
По топографическим признакам ВМК могут располагаться в коре, белом веществе, полушариях мозга (чаще всего в одном), подкорковых образованиях, в стволовых структурах. Наиболее часто располагаются в височной области. Морфологически они могут подразделяться на кровоизлияния по типу гематом или геморрагического пропитывания. ВМК могут развиваться в результате как травматических (асфиксия, родовые травмы: травматическое повреждение сосудов в результате деформации и смещение мозга при конфигурации головки), так и атравматических (нарушения гемокоагуляции, тромбоцитопатии, лейкозы, тромбозы сосудов и синусов, артериовенозные мальформации) причин [3]. Также, по мнению некоторых авторов, кровоизлияния могут быть следствием перенесенных вирусных инфекций, в т.ч. ветряной оспы, нейроспида и острых респираторных вирусных инфекций (ОРВИ) [4, 5].
В соответствии со стандартами оказания медицинской помощи всем недоношенным новорожденным вне зависимости от наличия неврологической симптоматики проводят ультразвуковое исследование головного мозга с целью выявления поражений головного мозга, тогда как у доношенных новорожденных – только при наличии соответствующих показаний. Однако, по данным морфологов, внутримозговые гематомы являются частой случайной находкой при проведении секционных исследований доношенных новорожденных, умерших от других причин [6].
Целью работы стал анализ клинических случаев и последствий бессимптомных ВМК у доношенных новорожденных, матери которых перенесли острые вирусные инфекции во время беременности.
Клинический случай 1
Доношенная девочка С. от 1-й беременности, 1-х родов в 40 недель, родившаяся с низкой массой тела к сроку гестации (2640 г), ростом 50 см. На момент рождения возраст матери составлял 24 года. Изучение анамнеза у матери выявило наличие гипотиреоза в стадии медкомпенсации (гипотиреоз с 18 лет).
В I и II триместрах (6 и 20 недель) настоящей беременности мать перенесла ОРВИ (в 20 недель с подъемом температуры до 38,5°C), осложненную синуситом. В III триместре выявлены маловодие в 30 недель, компенсированная хроническая фетоплацентарная недостаточность (ХФПН) в 40 недель без нарушения кровообращения.
Роды на сроке 40 недель через естественные родовые пути. Длительный безводный период (13 часов 25 минут), воды светлые. В родах диагностирован хорионамнионит.
Состояние ребенка после рождения удовлетворительное. Оценка по шкале Апгар на первой минуте 7 баллов, на пятой – 8.
В родильном зале проведены рутинные мероприятия, контакт кожи к коже, к груди приложен. Крик громкий, грудь сосет, частота сердечных сокращений (ЧСС) 144 уд/мин, число дыханий – 42 в минуту, SpO2 – 90–94%, мышечный тонус, объем двигательных движений достаточные, физиологические рефлексы вызываются, нестойкие. В отделении новорожденных состояние оставалось удовлетворительным. С первых суток в точке Боткина выслушивался негрубый систолический шум. Мышечный тонус умеренно равномерно снижен, рефлексы симметричные, нестойкие.
На пятые сутки перед выпиской из родовспомогательного учреждения проведена нейросонография (НСГ), на которой было выявлено очаговое изменение в области правого таламуса в виде зоны высокой эхогенности округлой формы с четкими контурами размером 7,0×3,8 мм (эхопризнаки кровоизлияния в правый таламус). Многокамерные субэпендимальные кисты справа размером 14,5×5,7 мм, слева – 12,6×4,0 мм. Кисты в средней трети хориоидальных сплетений правого бокового желудочка диаметром 7,0 мм, левого бокового желудочка диаметром 8,7 мм (рис. 1А).
Допплерометрия сосудов головного мозга (ДСГМ): индекс резистентности передней мозговой артерии (ПМА ИР) – 0,63 см/с (нормальное периферическое сопротивление), индекс резистентности основной артерии (ОА ИР) – 0,65 см/с (нормальное периферическое сопротивление), внутренняя мозговая вена (ВМВ) – 7,7 см/с (незначительное повышение скорости кровотока в глубоких венах мозга), характер допплеровской кривой не изменен.
Так как роддом закрывался на плановую обработку, ребенок был переведен в ГДБ в детское психоневрологическое отделение на 6-е сутки и выписан через 9 суток. С учетом стабильности состояния и малых размеров данного очагового изменения мультиспиральная компьютерная томография (МСКТ), магнитно-резонансная томография (МРТ) не проводились.
Состояние при выписке удовлетворительное, ребенок активен. В весе прибавлял, не срыгивал. Периодически отмечался тремор рук. Тонус мышц переменный. Физиологические рефлексы в полном объеме. Соматический статус без особенностей. Масса тела при выписке составила 2930 г (+619 г).
Инфекционная иммунология методом иммуноферментного анализа (ИФА): через 10 дней после рождения выявлен иммуноглобулин G (IgG) к ядерному антигену вируса Эпштейна–Барр (EBVNAIgG); IgM, IgG к цитомегаловирусу (СMV), HSV (вирусу герпеса) не выявлены.
На 15-е сутки при проведении НСГ выявлены очаговое изменение правого таламуса (эхопризнаки кровоизлияния). Субэпендимальные кисты справа, слева. Киста левого хориоидального сплетения. ДСГМ: ПМА ИР – 0,78, ОА ИР – 0,84, СМА ИР – 0,78,ВМВ – 8,5 см/с, поток ламинарный. Повышение периферического сопротивления в церебральных артериях.
При катамнестическом осмотре в 3 месяца неврологом наблюдалась спонтанная двигательная активность (скованность, тремор рук). Черепно-мозговые нервы (ЧМН) – тремор языка. Мышечный тонус повышен в дистальных отделах. Сухожильные рефлексы оживлены, S=D. Физио-логические рефлексы по возрасту. Опора на нижние конечности незначительно снижена, тенденция на наружный край, носок. Опора на локти незначительно снижена. Также проведена НСГ: незначительное расширение субарахноидального пространства в задних отделах до 4,4 мм. В суб-эпендимальных зонах кисты: справа – 5×2,5 мм, слева – 4×4 мм. Умеренное повышение эхогенности в перивентрикулярных зонах. Неоднородность правого зрительного бугра за счет точечных эхогенных структур с мелкими участками разряжения. ДСГМ: ПМА ИР – 0,69 см/с, ОА ИР – 0,62, ВМВ – 11,7 см/с, характер допплеровской кривой не изменен (рис. 1Б).
Было дано следующее заключение: пирамидная недостаточность вследствие перинатальной гипоксически-геморагической энцефалопатии средней степени тяжести.
В настоящее время ребенок находится на динамическом наблюдении у невролога.
Клинический случай 2
Доношенная девочка Ф. от 3-й беременности, 1-х родов в 39,6 недели. На момент рождения ребенка возраст матери составлял 26 лет. Из анамнеза выявлены перенесенный сифилис в 2011 г. (снята с учета в 2013 г.), послеоперационный гипотиреоз в 2021 г., медикаментозно компенсированный на момент беременности. Неразвивавшаяся 1-я беременность в 20 недель в 2021 г. после резекции щитовидной железы на фоне послеоперационного гипотиреоза, 2-я беременность – внематочная (выполнена тубэктомия).
В I и III триместрах (13 и 34 недели) мать перенесла угрозу прерывания беременности (УПБ). Во II и III триместрах (20 и 29 недель) перенесла ОРВИ без подъема температуры. Также в I триместре выявлены краевая плацентация и анемия легкой степени тяжести; в III триместре – гестационный сахарный диабет в 27–28 недель.
Роды в 39,6 недели через естественные родовые пути, безводный промежуток составил 3 часа 39 минут, воды светлые. Ребенок родился с массой тела 3540 г, ростом 54 см. Оценка по шкале Апгар на первой минуте – 8 баллов, на пятой – 9.
Состояние после рождения удовлетворительное. Крик громкий, ЧСС – 142 уд/мин, частота дыханий – 42 в минуту, SpO2 – 93%, мышечный тонус, объем движений достаточный. В отделении новорожденных состояние удовлетворительное, энтеральное питание усваивал, грудь сосал хорошо. На 3-и сутки наросла желтушность кожных покровов, проведена фототерапия.
При проведении НСГ на 3-и сутки выявлено очаговое изменение правой височной области в виде участка высокой эхогенности округлой формы с четкими границами размером 15,1×13,8×9,8 мм, неоднородное по структуре, без признака кровотока при цветном допплеровском картировании (ЦДК). Дислокации срединных структур не выявлено. Обнаружены кисты левого хориоидального сплетения в нижней трети размером 4×4 и 3×3 мм. Боковые желудочки мозга щелевидные. Наружные ликворные пространства не расширены (рис. 2A).
ДСГМ: ПМА ИР – 0,64, ОА ИР – 0,65, правая СМА ИР – 0,70, ВМВ – 5,5 см/с. Незначительная асимметрия резистентности кровотока в бассейне ПМА и СМА (периферическое сопротивление в церебральных артериях не повышено). Скорость кровотока в глубоких венах мозга не изменена.
Для уточнения характера выявленных изменений проведена МСКТ на 8-е сутки жизни: МСКТ-признаки внутримозгового кровоизлияния в правой височной области (9×10×22 мм) (рис. 3).
На 15-е сутки жизни проведено повторное НСГ-исследование: размеры очагового изменения не увеличились, эхогенность незначительно снизилась, наблюдалась нечеткость контура (рис. 2Б).
ДСГМ: ПМА ИР – 0,84 см/с, ОА ИР – 0,86 см/с, ВМВ – 5 см/с. Высокое сосудистое сопротивление в бассейне ПМА, ОА. Скорость кровотока в глубоких венах мозга не изменена.
На 21-е сутки динамики очаговых изменений выявлено не было (рис. 2В).
Осмотр невролога на 5-е сутки: умеренная мышечная гипотония, норморефлексия, физиологические рефлексы нестойкие. Рефлекс опоры положительный. Сухожильные рефлексы живые, S=D.
Осмотр невролога на 10-е сутки: тремор подбородка. Поза полуфлексии. Дистония мышечного тонуса. Сухожильные рефлексы живые, S=D. Физиологические рефлексы: сосательный, хоботковый оживлены, Бабкина, Бауэра, автоматической походки, Монро, I фаза, II фаза, защиты – нестойкие. ЧМН интактны. Плечевой пояс приподнят, фиксирован.
Инфекционная иммунология методом ИФА на 15-е сутки жизни: IgG-отрицательные. Aнтитела кHSV 1-го, 2-го типов: IgM-отрицательные, IgG-положительные. Антитела к CMV: IgM-отрицательные, IgG-положительные. Повышенная авидность IgG к CMV.
При проведении НСГ в 1 месяц и 7 дней жизни обнаружено значительное уменьшение размеров, снижение эхогенности, очаговое изменение правой височной области (внутримозговой гематомы). Кисты левого хориоидального сплетения (рис. 2Г).
ДСГМ: ПМА ИР – 0,80, ОА ИР – 0,81, ВМВ – 7,7 см/с. Высокая резистентность кровотока в бассейне ПМА, ОА. Скорость кровотока в глубоких венах мозга не изменена. Тип допплеровской кривой не изменен.
Осмотр невролога в кабинете катамнеза (1 месяц и 7 дней): состояние удовлетворительное, большой палец к ладони. ЧМТ интактны. Мышечный тонус диффузно понижен, D=S. Сухожильные рефлексы средней живости, D=S. Физиологические рефлексы снижены, нестойкие. Заключение: мышечная гипотония вследствие перинатальной гипоксически геморрагической энцефалопатии, средней степени. Задержка речевого развития.
Ребенок продолжает наблюдаться у невролога.
Клинический случай 3
Девочка Т. от 2-й беременности, 2-х абдоминальных родов в 37–38 недель, родившаяся с низкой массой тела к сроку гестации (2340 г), ростом 49 см. На момент рождения возраст матери составлял 27 лет.
Из анамнеза женщины известно, что 1-я беременность окончилась родами в 30 недель. Женщина – носитель гомозиготного полиморфизма MTYFR PAI1. Изменений в коагулограмме при наблюдении у гематолога во время беременности не выявлено. По заключению гематолога в коррекции гемостаза не нуждалась. Гомоцистеин – 6,76 мкмоль/л (норма – 2,90–11,00).
В I триметре беременность протекала без патологии. Во II имелось нарушение кровообращения 1А в 25 недель. В III триместре мать перенесла ветряную оспу в 30 недель и гестационный сахарный диабет в 34–35 недель.
Абдоминальные роды на сроке 37–38 недель. Состояние ребенка после рождения удовлетворительное. Оценка по шкале Апгар на первой минуте – 8 баллов, на пятой – 8.
В родильном зале проведены рутинные мероприятия, контакт кожи к коже, к груди приложен. Крик громкий, грудь сосет, отмечается умеренное равномерное снижение мышечного тонуса, нестойкие физиологические рефлексы.
На 3-и сутки проведена НСГ: выявлены очаговые изменения в виде зон высокой эхогенности с четкими границами по кортикальным отделам теменной области, локальные расширения борозд по конвекситальным отделам с эхогенным содержимым. Субэпендимальная киста слева. Киста хориоидального сплетения слева. Повышение периферического сопротивления в церебральных артериях (рис. 4А). Ребенок переведен на второй этап выхаживания новорожденных для наблюдения и мониторинга за состоянием. При проведении контрольных сонографических исследований на 8-е сутки: нарастания очаговых изменений не выявлено (рис. 4Б).
Инфекционная иммунология методом ИФА на 12-е сутки: выявлены антитела к капсидному антигену вируса Эпштейна–Барр (Ig VCA), авидность – 87%, IgG к CMV, авидность – 81%, Ig G к вирусу простого герпеса (ВПГ), авидность –91%.
При выписке состояние удовлетворительное, сохраняется умеренная мышечная гипотония, энтеральное питание усваивает хорошо, не срыгивает, прибавка в весе +350 г. Выписана на 16-е сутки жизни.
НСГ в кабинете катамнеза:
- в 1 месяц – заключение прежнее, в динамике эхогенность описываемых очаговых изменений значительно снизилась;
- в 3 месяца – очаговых изменений не выявлено, кортикальные зоны без особенностей. Субарахноидальное пространство – 2,1–2,9 мм, межполушарная щель в передних отделах – 2,5 мм, в задних отделах – одноконтурная. Субэпендимальная киста слева. Киста хориоидального сплетения слева.
ДСГМ: ПМА ИР – 0,67, ОА ИР – 0,65, ВМВ – 10 см/с.
Сейчас ребенок 1 года и 5 месяцев: со слов мамы хорошо ходит, учится прыгать, ест ложкой, говорит 20 слов, игрушками играет, складывает в коробочку, хорошее звукоподражание, называет части тела.
Обсуждение
В данной статье представлены случаи нахождений внутримозговых кровоизлияний различных локализаций у новорожденных физиологического отделения при прохождении планового эхографического скрининга в первые 2–5 суток жизни, родившихся с хорошей оценкой по шкале Апгар и не имевших мозговой дисфункции.
Сонография новорожденным проводилась на аппаратах PHILIPS CX 50 микроконвексным датчиком с частотой 5-8МГц и LOGIQ-e линейным датчиком с частотой 10–13 МГц через естественные акустические окна: передний родничок, переднебоковой, заднебоковой роднички.
В приведенных клинических примерах имеют место кровоизлияния в подкорковые структуры (таламус), в глубокое белое вещество головного мозга (височную область правого полушария), кортикальные отделы мозга.
Дети родились от матерей молодого возраста, у которых беременность протекала на фоне перенесенной вирусной инфекции и эндокринно-метаболического синдрома (гипотиреоз, послеоперационный гипотиреоз, медикаментозно компенсированные, гестационный сахарный диабет). В разных случаях роды осложнялись хорионамнионитом и длительным безводным промежутком.
Во всех клинических случаях отсутствовали данные за травматический характер родов и наличие родовых повреждений (родовая опухоль больших размеров, чрезмерная конфигурация головки, несимметричная конфигурация головки, кожно-гемморагический синдром, а также переломы костей черепа и кефалогематомы, см. таблицу).
Таким образом, в проанализированных случаях у новорожденных не было перенесенной асфиксии в родах, отсутствовали тяжелые дыхательные расстройства, декомпенсированный или компенсированный ацидоз, значимые гемодинамические нарушения в родах или после рождения, которые могли привести к ишемическим или геморрагическим повреждениям в веществе мозга и явиться причиной мозговой сосудистой катастрофы.
После рождения и в дальнейшем общее состояние новорожденных не страдало, дети хорошо сосали и усваивали энтеральное питание. В неврологическом статусе отмечены умеренная мышечная гипотония, нестойкие физиологические рефлексы, тремор рук.
В дальнейшем при катамнестических наблюдениях детей данные очаговые изменения головного мозга или не определялись или значительно уменьшались в объеме. При динамических эхографических исследованиях порэнцефалические кисты не сформировались, но выявилась тенденция к повышению периферического сопротивления в церебральных артериях, асимметрия кровотока в артериях Виллизиева круга и незначительное расширение наружных ликворных пространств. В неврологическом статусе имели место снижение или повышение мышечного тонуса, рефлексов, умеренно выраженные признаки пирамидной недостаточности, умеренная задержка речевого развития.
По данным литературы, у 38% детей с врожденной вирусной инфекцией при нейровизуализации выявляются перивентрикулярные ВМК [7]. Патогенетическим фактором геморрагических поражений головного мозга у детей, матери которых перенесли инфекционное заболевание во время беременности, может быть тропность вирусов ко всем эпителиальным клеткам, в т.ч. к эндотелию сосудов головного мозга. Это приводит к изменению характеристик сосудистых стенок, развитию васкулита и как следствие – к ВМК [3].
Все дети в настоящее время продолжают динамическое наблюдение у невролога.
Выводы
ВМК у доношенных новорожденных могут быть бессимптомными и развиваться на фоне перенесенных инфекций у матерей во время беременности, в связи с чем для ранней диагностики необходимо внедрение в скрининг нейровизуализации у доношенных новорожденных группы риска во всех родильных домах для своевременной диагностики, раннего начала терапии и улучшения исходов в восстановительном периоде.
Лечение церебральной ишемии у новорожденных
Цель лечения – восстановить нормальное кровообращение в тканях головного мозга, не допустить патологических изменений и устранить последствия ишемии. Для болезни 1-й степени лечение обычно заключается в назначении массажа для улучшения кровообращения.
При заболеваниях 2-ой и 3-ей степени применяют медикаментозную терапию и хирургическое вмешательство для удаления тромба в сосуде и восстановления структуры сосудистого русла. В сложных случаях младенец проходит восстановительный курс интенсивной терапии.
Факторы риска
Различные сосудистые и неврологические патологии, проблемы с артериальным давлением (особенно наследственные) у матери должны насторожить врача, который ведет беременность. Также факторами риска возникновения у ребенка церебральной ишемии являются:
- возраст матери более 35 лет;
- эндокринные заболевания;
- преждевременные, затяжные роды;
- многоплодная беременность;
- поздний токсикоз;
- несоблюдение матерью здорового образа жизни;
- обострение хронических или острые заболевания у матери при вынашивании плода.
Прогноз и последствия церебральной ишемии
Гораздо эффективнее ликвидировать саму ишемию после рождения младенца, нежели лечить ее осложнения. Среди последствий церебральной ишемии 2 степени:
- нарушения сна;
- головные боли;
- раздражительность;
- замкнутость;
- гиподинамия.
- Заболевание 3 степени имеет сложнейшие последствия:
- ДЦП;
- синдром дефицита внимания;
- умственная отсталость;
- симптом Грефе и др.
Если же все действия по устранению ишемии были проведены врачами своевременно, то симптомы проходят в течение реабилитационного периода, длящегося обычно 6-12 месяцев.
Как возникает церебральная ишемия?
В 70% случаев ишемия возникает у плода еще в утробе матери и связана с образованием тромба в одном из сосудов, питающих головной мозг, или с недостаточным развитием сосуда. Чаще всего заболевание диагностируют у недоношенных детей, у которых сосудистая система еще не полностью сформирована.
В результате в жизненно важный орган поступает недостаточное количество крови, а вместе с ней – кислорода. Промедление с оказанием медицинской помощи ведет к поражению более крупных участков головного мозга, кровоизлиянию в мозг и другим тяжелым последствиям.
Церебральная ишемия 2 степени
Опасная форма заболевания. Для нее характерны:
- выраженные апноэ (остановки дыхания во сне);
- снижение хватательных, сосательных рефлексов;
- слабый мышечный тонус;
- увеличение формы головы за счет скопления жидкости;
- нарушение координации;
- потери сознания;
- изменения цвета кожи.
Чаще всего ишемия 2 степени проявляет себя в первые сутки жизни новорожденного, а симптомы могут наблюдаться в течение 2-4 недель. В это время за ребенком тщательно наблюдают врачи, он проходит курс терапии. При необходимости проводят хирургическую операцию по удалению тромба.