Генетическое заболевание Верднига-Гофмана относится к группе спинальных амиотрофий, наследуется по аутосомно-рецессивному типу.
Спинальная мышечная атрофия (СМА) характеризуется врожденными или приобретенными дегенеративными изменениями в поперечнополосатых мышцах, симметричной мышечной слабостью туловища, конечностей, отсутствием или снижением сухожильных рефлексов при сохранении чувствительности.
Морфологические исследования выявляют патологию двигательных нейронов спинного мозга, «пучковую атрофию» в скелетных мышцах с характерным чередованием пораженных волокон и здоровых.
Отмечается нарушение проводящей функции нервных волокон, снижение сократительной способности мышц. Статистика
1 из 40-50 человек является носителем мутантного гена SMN. Проявляется патология с частотой 1 : 6 000 — 10 000 новорожденных.
Как распознать СМА
Атрофия мышц у детей при диагнозе СМА (spinal muscular atrophy) может начинаться в разное время. Самая тяжелая форма мышечной атрофии у новорожденных появляется в первые шесть месяцев жизни. Малыш вялый, плохо сосет. В 3-4 месяца ребенок не переворачивается самостоятельно, не делает попыток ползти. При спинальной мышечной атрофии поза младенца напоминает «лягушку».
Существует тип болезни, который появляется после 7-18 месяцев. Атрофия мышц приводит к регрессу у ребенка усвоенных навыков. Малыш, который ползал и начинал вставать, вдруг становится малоподвижным. Со временем он перестает сидеть ровно. При атрофии спинного мозга (spinal atrophy) пропадают рефлексы с верхних и нижних конечностей.
Симптомы атрофии мышц при spinal muscular atrophy могут возникать ближе к двум годам. Пациенты уже освоили навыки стояния и ходьбы. При этом атрофия мышц приковывает их к инвалидной коляске. Интеллект, функции мочеиспускания и дефекации сохраняются. СМА после 2-х лет – это наиболее легкий тип заболевания.
Атрофия мышц (spinal muscular atrophy) имеет следующие признаки:
- Появляется в младенчестве или детском возрасте;
- Сопровождается нарушением ходьбы, бега, стояния;
- Выявляется тремор и фасцикуляции (подергивания);
- Определяется «откат» двигательных умений;
- При спинальной атрофии не выявляют нарушений интеллекта и вегетативных функций.
Если у ребенка обнаружены эти признаки, его необходимо проконсультировать со специалистами. Диагноз СМА выставляется на основании ДНК тестирования.
СПИНАЛЬНАЯ АМИОТРОФИЯ ВЕРДНИГА-ГОФМАНА
Наследуется по аутосомно-рецессивному типу. Обнаруживается недоразвитие клеток передних рогов спинного мозга, демиелинизация передних корешков, аналогичные изменения в двигательных ядрах и корешках Y, YI, YII, IX, X, XI, XII черепных нервов. В скелетных мышцах нейрогенные изменения характеризуются «пучковой атрофией», чередованием атрофированных и сохраненных пучков мышечных волокон.
КЛИНИКА
Различают три формы заболевания:
- врожденную;
- раннюю детскую;
- позднюю детскую
.
При врожденной форме
дети рождаются с вялыми парезами. С первых дней жизни выражены генерализованная мышечная гипотония и снижение либо отсутствие сухожильных рефлексов. Рано определяются бульбарные расстройства, проявляющиеся вялым сосанием, слабым криком, фибрилляциями языка, снижением глоточного рефлекса. Заболевание сочетается с костно-суставными деформациями: сколиозом, воронкообразной грудной клеткой, контрактурами суставов. Развитие статических и локомоторных функций резко замедлено. Снижен интеллект. Часто наблюдаются врожденные пороки развития: врожденная гидроцефалия, крипторхизм, гемангиома, дисплазия тазобедренных суставов, косолапость и др.
Течение быстро прогрессирующее, злокачественное. Летальный исход наступает до 9-летнего возраста. Одной из основных причин смерти являются тяжелые соматические расстройства (сердечная и дыхательная недостаточность), обусловленные слабостью мускулатуры грудной клетки и снижением участия ее в физиологии дыхания.
При ранней детской форме
первые признаки болезни возникают на втором полугодии жизни. Заболевание развивается подостро, нередко после инфекции, пищевой интоксикации. Вялые парезы первоначально локализуются в ногах, быстро распространяются на мышцы туловища и руки. Диффузные мышечные атрофии сочетаются с фасцикуляциями, фибрилляциями языка, мелким тремором пальцев, сухожильными контрактурами. Мышечный тонус, сухожильные рефлексы снижаются. В поздних стадиях возникают генерализованная мышечная гипотония, явления бульбарного паралича.
Течение злокачественное, летальный исход наступает к 14 — 15 годам жизни.
При поздней форме
признаки болезни возникают в 1,5 — 2,5 года. Заболевание начинается незаметно. Движения становятся неловкими, неуверенными. Дети часто спотыкаются, падают. Изменяется походка — они ходят, сгибая ноги в коленях (походка «заводной куклы»). Вялые парезы первоначально локализуются в проксимальных группах мышц ног, в дальнейшем сравнительно медленно переходят на проксимальные группы мышц рук, мышцы туловища; атрофии мышц обычно малозаметны вследствие хорошо развитого подкожного жирового слоя. Типичны фасцикуляции, фибрилляции языка, мелкий тремор пальцев, бульбарные симптомы — фибрилляции и атрофия языка, снижение глоточного и небного рефлексов. Сухожильные рефлексы угасают на ранних стадиях болезни. Костно-суставные деформации развиваются параллельно основному заболеванию. Наиболее выражена деформация грудной клетки.
Течение злокачественное, но мягче. Больные живут до 20 — 30 лет.
Диагностика.
Аутосомно-рецессивный тип наследования, раннее начало, наличие диффузных атрофий с преимущественной локализацией в проксимальных группах мышц, генерализованная мышечная гипотония, фасцикуляции, фибрилляции языка, отсутствие псевдогипертрофий, прогредиентное, злокачественное течение, данные электромиографии и морфологии скелетных мышц, выявляющие денервационный характер изменений.
Спинальная мышечная атрофия (амиотрофия) Верднига-Гоффмана — наследственное злокачественное заболевание, начало развития которого приходится от момента рождения до 1-1,5 года. Это одна из самых тяжелых форм мышечных атрофий. Происходит диффузное нарастание атрофии мышц по всему организму. Ребенок теряет возможность сидеть, самостоятельно передвигаться, прогрессируют парезы.
Впервые болезнь описали ученые Вердниг и Гоффман. Они доказали морфологическую сущность спинальной амиотрофии. Но они предполагали существование лишь одной формы заболевания. Позже другие ученые Веландер и Кукельберг описали другую форму спинальной атрофии мышц. Все варианты заболевания имеют одну генетическую природу. Сегодня не существует методов, которые позволяют полностью излечиться от этой патологии. Терапевтические мероприятия направлены на улучшение трофики мышц и нервной ткани.
Близкие по симптомам расстройства
Симптомы следующих заболеваний могут быть аналогичны симптомам болезни Верднига-Гоффмана. Сравнения могут быть полезны для дифференциальной диагностики:
- Синдром Прадера-Вилли — редкое генетическое заболевание, характеризующееся пониженным мышечным тонусом (гипотония), затруднениями с кормлением и неспособностью расти и набирать вес (неспособность развиваться) в младенчестве; невысоким ростом; аномалиями половых органов; умственной отсталостью. Кроме того, примерно в возрасте от 6 месяцев до 6 лет у больных может развиться избыточная масса тела (ожирение), особенно в нижних частях тела (например, в нижней части живота, бедрах, ягодицах). Прогрессирующее ожирение возникает в результате недостаточной физической активности и чрезмерного потребления пищи, что может быть связано с отсутствием чувства удовлетворения (сытости) после завершения приема пищи, одержимостью едой, необычными пищевыми ритуалами и привычками в еде, вызывающими переедание. Больные с синдромом Прадера-Вилли также могут иметь характерный внешний вид лица из-за определенных особенностей, включая миндалевидные глаза, тонкую верхнюю губу и полные щеки. Диагноз устанавливают на основании хромосомного анализа.
- Болезнь Помпе — наследственное нарушение обмена веществ, вызванное полным или частичным дефицитом фермента кислой альфа-глюкозидазы. Этот дефицит фермента вызывает накопление избыточного количества гликогена в лизосомах многих типов клеток, но преимущественно в мышечных клетках, включая клетки сердечной мышцы. Болезнь Помпе — единый континуум болезни с переменной скоростью прогрессирования. Инфантильная форма характеризуется сильной мышечной слабостью и аномально сниженным мышечным тонусом (гипотония) и обычно проявляется в течение первых нескольких месяцев жизни. Дополнительные аномалии могут включать увеличение сердца (кардиомегалия), печени (гепатомегалия) и/или языка (макроглоссия). Прогрессирующая сердечная недостаточность обычно вызывает опасные для жизни осложнения в возрасте от 12 до 18 месяцев. Детская форма обычно начинается в младенчестве или раннем детстве. Степень поражения органов может варьироваться у разных людей; однако слабость скелетных мышц обычно присутствует при минимальном поражении сердца. Лечение болезни Помпе доступно.
- Врожденная мышечная дистрофия (ВМД) — общий термин для группы генетических мышечных заболеваний, которые возникают при рождении (врожденные) или в раннем младенчестве и имеют аналогичные признаки при микроскопическом исследовании мышечной ткани. Врожденная мышечная дистрофия обычно характеризуются пониженным мышечным тонусом (гипотония); прогрессирующей слабостью и дегенерацией (атрофией) мышц; аномально фиксированными суставами, которые возникают при утолщении и укорочении ткани, например, мышечных волокон, вызывая деформации и ограничивая движение пораженной области (контрактуры); и задержки в достижении основных двигательных навыков, таких как сидение или стояние без посторонней помощи. Некоторые формы ВМД могут быть связаны со структурными дефектами головного мозга и, возможно, с умственной отсталостью. Серьезность, конкретные симптомы и прогрессирование этих расстройств сильно различаются. Почти все известные формы ВМД наследуются по аутосомно-рецессивному типу.
- Врожденные миопатии — группа нарушений мышц (миопатий), которые присутствуют при рождении (врожденные). Эти расстройства характеризуются мышечной слабостью, потерей мышечного тонуса (гипотония), снижением рефлексов и задержкой в достижении двигательных вех (например, ходьбы). При некоторых заболеваниях мышечная слабость прогрессирует и может привести к опасным для жизни осложнениям. Эта группа расстройств включает в себя заболевание центрального ядра, немалиновую миопатию центрального стержня, миопатию с гиалиновыми тельцами, центрально-ядерную миопатию, врожденную структурную миопатию с диспропорцией типов мышечных волокон. Врожденные миопатии обычно проявляются в новорожденном (неонатальном) периоде, но могут проявляться значительно позже, даже во взрослой жизни. В большинстве случаев наследование этих нарушений является либо аутосомно-рецессивным, либо аутосомно-доминантным. Диагноз устанавливается путем микроскопического исследования мышечной ткани.
Дополнительные нарушения включаются в дифференциальную диагностику мышечной атрофии позвоночника, включая множественный врожденный артрогрипоз, адренолейкодистрофию и врожденную миастению Гравис.
Лечение
Основная цель исследований, направленных на терапию спинальной мышечной амиотрофии, связана с повышением уровня белка SMN. В настоящее время лекарственные препараты проходят испытания, и официальная российская медицина их не использует.
Лечение сегодня включает лекарства, которые улучшают прохождение нервных импульсов. Назначаются ноотропные препараты, основная задача которых – улучшение работы головного мозга. Назначаются биологически активные добавки, способствующие улучшению обмена веществ. Показана витаминотерапия, в частности, прием витаминов группы Б.
Средства влияющие на нервно-мышечную проводимость:
- Альфа-липоевая кислота
- Ацетил Л-карнитин
- Альфа-глицерофосфохолин
Витамины и витаминные комплексы:
- Тиамин (B-1)
- Пиридоксин (B-6)
- B-комплекс
Важными методами лечения являются массаж, физиотерапия, нейромышечная стимуляция. Назначается ЛФК. Физические упражнения помогают поддержать силу, с другой стороны, выполнение их в обществе, походы в бассейн помогают социализироваться, общаться с другими людьми.
Больным СМА рекомендовано соблюдение диеты. Продукты питания – источник веществ, необходимых мышцам. Так, необходимые аминокислоты содержатся в зерновых, мясе, рыбе, грибах, орехах, кисломолочных продуктах. Рекомендованы блюда из овса и пшеницы, бурого риса.
Советуем изучить — Последствия удаления межпозвоночной грыжи
Естественному поддержанию и росту мышц поможет шпинат, брокколи, сельдь, лук, грейпфрут, арбуз. Для повышения тестостерона мужчинам рекомендуют принимать укроп, пастернак, женьшень, петрушку.
Терапевтические меры
В 21 веке ученые до сих пор не смогли изобрести способ для полноценного лечения описываемого недуга. В современной медицине специалисты ориентированы на улучшение метаболизма ПНС и мышечных зон, что обеспечивает оптимальный уровень торможения распространения симптоматики. Для таких мероприятий предписываются:
- Способ 1: лекарственные средства, состоящие из гидролизата свиного мозга, витаминные комплексы группы В, кислота гамма-аминомасляного характера и прочее.
- Способ 2: галантамин и другие фармацевтические препараты, направленные на облегчение нервно-мышечной передачи.
- Способ 3: метионин и множество средств, обладающих возможностью улучшать трофику.
- Способ 4: медикаменты для повышения уровня кровообращения в организме.
Помимо разнообразных видов лекарств, доктора назначают терапевтические процедуры:
- Оздоровительная гимнастика.
- Массажные сеансы.
- Ортопедическая коррекция.
Для пациентов с представленным диагнозом и облегчения жизни их родных, существует большое количество инженерных приемов, например: инвалидные коляски, транспортируемые устройства ИВЛ и прочее.
Лечение
Практический справочник пациента по правовым основам оказания медицинской помощи больным СМАВ этом справочнике представлены статьи и материалы по правовым основам оказания медицинской помощи и лекарственного обеспечения пациентов, требования к оформлению медицинской документации и ее формы, ответы на наиболее часто задаваемые вопросы. Фонд «Семьи СМА»
Интеллект при болезни СМА остается полностью сохранным, он развивается так же, как у здоровых людей. Таким образом, несмотря на физические ограничения, дети могут жить полноценной жизнью: общаться, играть, заниматься физиотерапией, гулять.
На данный момент заболевание является неизлечимым. Специалисты разных стран работают над препаратами для лечения СМА, но пока что общедоступных лекарств, способных полностью излечить болезнь, не существует.
В конце 2021 года в мире появился первый препарат для лечения СМА – Спинраза (Нузинерсен). Это лекарственное средство позволяет замедлить прогрессирование болезни, а в некоторых случаях и улучшить состояние, но все же не излечивает заболевание полностью. В данный момент Спинраза еще не зарегистрирована на территории России – это дело ближайшего будущего.
Кроме того, сейчас в разработке сразу несколько инновационных препаратов для лечения СМА, которые находятся на стадии клинических испытаний. Подробную и актуальную информацию об этом можно найти на сайте Фонда «Семьи СМА» в разделе «Исследования».
Тем не менее уже сейчас мы можем сделать многое, и с помощью симптоматической терапии и разнообразных поддерживающих методик замедлить прогрессирование болезни и в некоторых случаях предупредить развитие осложнений.
Помогающие организации
Благотворительный фонд «Семьи СМА» — единственная в России организация, специализирующаяся на помощи семьям, столкнувшимся со спинальной мышечной атрофией. Оказывается благотворительную, информационную, психологическую поддержку семьям, консультирует специалистов по вопросам заболевания и методов работы с пациентами со СМА.
Фонд помощи хосписам «Вера». Благотворительная и консультативная помощь семьям с неизлечимо больными детьми, неизлечимо больным взрослым.
ОДКБ № 1 Отделение паллиативной помощи детям, Екатеринбург, Свердловская область. Оказывается медицинскую, информационную, социальную и психологическую помощь семьям, воспитывающим ребенка-инвалида с паллиативным состоянием.
«Научно-исследовательский клинический институт педиатрии имени академика Ю.Е. Вельтищева» ФГБОУ ВО РНИМУ им.Н.И.Пирогова. Институт находится в Москве. Обращаться за медицинской помощью детям со СМА и другими нервно-мышечными заболеваниями могут жители всей России.
Клиника «Чайка». Консультации врача-пульмонолога Штабницкого Василия Андреевича для детей и взрослых со СМА.
Детский хоспис «Дом с маяком» (Москва, ближнее Подмосковье). Медицинская, психологическая, правовая, социальная, благотворительная помощь семьям с неизлечимо больными детьми и молодыми взрослыми (до 25 лет).
Марфо-Мариинский медицинский (г.Москва). Медицинская, психологическая, правовая помощь, помощь няни, мероприятия, духовная поддержка, благотворительная помощь семьям с неизлечимо больными детьми.
Более подробную информацию вы найдете на сайте благотворительного фонда «Семьи СМА» и их специального проекта о жизни со спинальной мышечной атрофией
Спецпроект предназначен тем, кто столкнулся с диагнозом СМА и хотел бы узнать все самое важное об этой болезни: к каким специалистам и куда обращаться, как ухаживать, за чем следить, о чем помнить, какая терапия существует на сегодняшний день.
К изучению Бандаж для пояснично-крестцового отдела позвоночника
Диета при спинальной амиотрофии
На данный момент еще не подтверждено, что какая-либо диета приносит пользу при СМА.
По мнению большого количества родителей, диета, включающая в себя много белка или специальные добавки к пище, могут повысить силу мышц ребенка. Но, несмотря на очевидную необходимость хорошего питания для больного ребенка, еще не доказано, что ему нужен именно определенный рацион. Причем некоторые продукты даже могут нанести вред его организму.
К примеру, аминокислотное меню порой чревато еще большими проблемами у тех детей, у которых в организме слишком мало мышечной ткани. По мнению некоторых специалистов, при недостатке мышечной ткани, та не может правильно перерабатывать аминокислоты и тогда их уровень в крови повышается слишком сильно.
Врачами не доказано, что какая-либо диета улучшит состояние больного СМА, однако правильное питание может облегчить его жизнь.
Некоторым детям полезнее питаться понемногу, причем чаще трех-четырех раз в день. Нужно просто разделить для больного все количество пищи, принимаемое здоровым сверстником больного за день, на несколько частей.
Принципы лечения спинальной амиотрофии
К сожалению, это неизлечимое наследственное заболевание. На современном этапе проводятся исследования, которые, возможно, помогут регулировать синтез белка SMN, но результатов пока нет.
Облегчить состояние больным со спинальной амиотрофией помогают:
- периодический курсовый прием препаратов, улучшающих метаболизм нервной ткани и мышц (Церебролизин, Цитофлавин, Глутаминовая кислота, АТФ, Карнитина хлорид, Метионин, Калия оротат, Токоферола ацетат и др.);
- витамины группы В (Мильгамма, Нейровитан, Комбилипен);
- анаболические стероиды (Ретаболил, Неробол);
- средства, улучшающие нервно-мышечную проводимость (Прозерин, Нейромидин, Галантамин, Дибазол);
- курсы массажа и лечебной физкультуры;
- физиотерапия (электростимуляция мышц, углекисло-сульфидные ванны);
- методы ортопедической коррекции (при развитии контрактур суставов и деформации позвоночника).
Спинальная амиотрофия Верднига–Гоффмана, как и другие формы этого заболевания, является патологией, передающейся по наследству. Появление болезни у ребенка объясняется наличием мутантного гена и у матери, и у отца. Болезнь характеризуется, в основном, мышечной слабостью, которая становится причиной обездвиженности и дыхательных нарушений. Заболевание, на сегодняшний день, неизлечимо.
Диагностика
Проявления проксимальной спинальной амиотрофии часто напоминают течение других неврологических и врожденных заболеваний, а также травматических повреждений структур спинного и головного мозга. Особенно затруднена диагностика этого заболевания у новорожденных и детей раннего возраста.
Ключевыми моментами в диагностике спинальной амиотрофии являются следующие исследования:
- Тщательный сбор анамнеза. Наличие случаев спинальной амиотрофии у родственников позволяет заподозрить это наследственное заболевание.
- Электронейромиография – специальное исследование нервно-мышечного аппарата. При этом исключается первичное поражение мышц и выявляются признаки, указывающие на патологию двигательных нейронов спинного мозга.
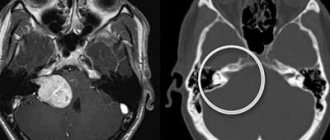
- Компьютерная и магнитно-резонансная томография. Эти методы позволяют иногда выявить атрофические изменения передних рогов спинного мозга. Однако, чаще они применяются для исключения другой патологии со стороны структур позвоночного столба и головного мозга.
- Биопсия мышц и с последующим гистологическим исследованием биоптата. Выявляются специфические изменения мышц, заключающиеся в чередовании пучковых атрофических и неизмененных мышечных волокон. Помимо этого, могут выявляться и компенсаторно гипертрофированные участки мышц, а также замещение мышечной ткани соединительной.
- Генетический анализ. Позволяет выявить точную причину заболевания: при исследовании ДНК выявляется мутация гена в пятой хромосоме.
Если в семье были случаи рождения детей со спинальной амиотрофией, при планировании последующей беременности супружеская пара направляется на консультацию к генетику. Также обязательной является дородовый анализ ДНК плода. Выявление синдрома Верднига-Гоффмана на стадии пренатальной диагностики служит показанием к прерыванию беременности.
Как диагностируют данную патологию?
Чтобы поставить правильный диагноз, невролог должен иметь информацию о том, в каком возрасте у человека появились первые симптомы, как быстро они прогрессируют. Также он должен выяснить неврологические данные. Причем здесь важнее всего информация о том, нет ли у пациента периферических двигательных нарушений вместе с полным сохранением чувствительности. Еще неврологу важно узнать, не имеет ли больной врожденных отклонений, костной деформации. Амиотрофию Верднига-Гоффмана может диагностировать и неонатолог. При помощи дифференциальной методики можно диагностировать:
- миопатию;
- развивающаяся мышечная дистрофия Дюшенна;
- боковой амиотрофический склероз;
- сирингомиелия;
- полиомиелит;
- синдром вялого ребенка;
- ДЦП;
- обменные патологии.
Чтобы подтвердить результаты диагностики, делают электронейромиографию. Так называется обследование нервно-мышечного аппарата. Оно позволяет обнаружить изменения, нужные, чтобы исключить первично-мышечный вид заболевания, а также убедиться в наличии болезни мотонейрона. Биохимического анализа крови слишком мало, чтобы выявить сколь-либо серьезное повышение уровня креатинфоскиназы, которое бывает во время развития дистрофии мышц. Сделав МРТ/КТ позвоночника, изредка можно обнаружить атрофию передних рогов спинного мозга, однако при помощи этой методики можно убедиться в том, что другого спинального заболевания нет.
Для постановки диагноза необходимо пройти тщательное обследование
Окончательно ставится диагноз «амиотрофия Верднига-Гоффмана» только когда будут получены данные биопсии мышц, а также анализа ДНК. При помощи морфологического обследования мышечного биоптата можно выявить патогномоничную пучковую атрофию мышц, перемежающуюся зонами атрофии миофибрилл и здоровой ткани, отдельными гипертрофированными миофибриллами, а также местами соединительных разрастаний. В обязательные генетические исследования входит прямая и косвенная диагностика. Прямая методика позволяет выявить гетерозиготное носительство генной аберрации, а это необходимо при генетическом консультировании родственников пациентов, а также супругов, планирующих рождение ребенка. Во всем этом важно количественное исследование генов локуса СМА.
Проведя дородовую генетическую экспертизу, можно понизить риск появления на свет малыша, болеющего амиотрофией Верднига-Гоффмана. Чтобы получить генетический материал плода, следует применять инвазивные методики диагностики плода:
- амниоцентез;
- биопсию хориона;
- кордоцентез.
Кордоцентез
Обнаружив у плода амиотрофию Верднига-Гоффмана, следует поставить вопрос об аборте.
Спинальная амиотрофия Верднига-Гоффмана – лечится ли эта болезнь?
Спинальной амиотрофией Верднига-Гоффмана называется наследственная патология нервов, которая поражает тот их участок, что контролирует скелетные мышцы. Ее характеризует слабость сразу всех мышц в организме. Более половины нервных клеток, которые контролируют мышцы, располагаются в спинном мозге.
Именно потому заболевание названо «спинальным». «Мышечным» оно также названо из-за пагубного влияния на мышцы: те не получают от этих самых нервов никаких сигналов. «Атрофия» является медицинским термином, который обозначает истощение или усыхание того, что не используется. Здесь это касается недействующих мышц.
Человек с подобной болезнью не имеет никакой возможности ни сидеть, ни передвигаться, ни даже обслуживать себя. Вылечить это невозможно. Проведя дородовую диагностику, можно предотвратить рождение малыша с таким заболеванием.
Здесь мы поговорим, как эта патология наследуется, каковы ее проявления, а также о том, как можно помочь больному человеку.
Советуем изучить — Радикулит шейного отдела: симптомы
Спинальная амиотрофия Верднига-Гоффмана названа в честь двоих ученых, первыми ее описавших. Во второй половине XIX столетия они доказали морфологическую сущность болезни. Сначала оба ученых считали, что у данной патологии только одна форма.
Но уже в XX столетии ученые Кукельберг и Веландер открыли другую ее клиническую форму, с генетической причиной, схожей с той, которая и у открытой Верднигом и Гоффманом. Сейчас известно несколько клинических форм спинальной амиотрофии.
Их объединяет общий наследственный дефект.
Эта патология наследственная. Она основана на мутации в пятой хромосоме. Мутирует тот ген, благодаря которому синтезируется белок SMN. Данный белок необходим для того, чтобы двигательные нейроны развивались именно так, как нужно.
Стоит пятой хромосоме мутировать, и это негативно скажется на двигательных нейронах, помешав их развитию, а то и вовсе их разрушив. В результате мышца не может получать управляющие сигналы от нервов, а значит, не может и функционировать.
Получается, не выполняется ни одно связанное с ней движение.
У мутировавшего гена аутосомно-рецессивный тип наследования. Фраза расшифровывается так: для развития спинальной амиотрофии нужно, чтобы у обоих родителей был мутантный ген.
Если проще, то заболевание не разовьется, если хоть один из родителей не был носителем мутировавшего гена. В то же время они сами не болеют: у людей гены парные, а у отца и у матери ребенка доминирует здоровый ген.
В таком случае больной малыш рождается примерно в четверти случаев. Ученые подсчитали, что около 2% живующих людей — носители гена с такой мутацией.
Классификация
Известны три разновидности данной патологии.
- Самая тяжелая, проявляющаяся раньше остальных.
- Среднетяжелая.
- Самая легкая, проявляющаяся в самом позднем возрасте.
По мнению некоторых врачей, существует еще одна разновидность: умеренная/мягкая СМА, которая проявляется уже у взрослого человека.
Стоит отметить, что кроме спинальной амиотрофии Верднига-Гоффмана существуют и другие типы СМА, которые отличаются симптомами и типами наследования. Они указаны в таблице ниже.
| SMAX1 | Х -сцепленный рецессивный | Наблюдается в основном y пожилых, поражает бульбарные нервы чepeпa, вызывает нисходящий паралич. |
| SMAХ2 | Х — сцепл. рецессивный | Врождённая агрессивная форма, приводящая к смерти до 3 — х мес. Вызывает слабость, арефлексию, контрактуры и переломы. |
| SMAX3 | Х — сцепл. рецессивный | Поражает в основном мальчиков. Атрофия всех дистальных мышц. Медленное нарастание симптомов. |
| Дистальная ДCMA1 | Аутосомно — рецессивный | Врождённая, поражаются в основном руки, возможны тяжелее дыхательные нарушения. |
| Дистальные формы ДCMA2 — ДCMA5 | Аутосомно — рецессивный | Все четыре формы отличаются медленным прогрессированием, ДCMA5 диагностируется y молодых. |
| Ювенильная SMA (тип HMN1) | Аутосомно-доминантный | Встречается в юности |
| Врождённая спинальная aмиoтpoфия | Аутосомно-доминантный |
Симптомы патологии
Врожденная разновидность заболевания (СМА I) начинает проявляться до того, как малышу исполнится полгода. До этого такой ребенок может вяло двигаться. Не так уж редко спинальную амиотрофию у малыша можно заметить еще в самом начале постэмбрионального периода его жизни — у него угасают глубокие рефлексы:
- у малыша недостаточно громкий крик;
- ему трудно сосать;
- он не может держать головку.
Определить такую патологию у младенца можно с первых дней жизни
Если подобное становится заметно позже, что происходит редко, малыш может научиться держать головку, а то и сидеть, однако патология быстро сводит такие умения к нулю. Характерно и следующее:
- ранние проблемы с речью;
- ухудшение глоточного рефлекса;
- фасцикулярные подергивания языка.
Этот вид патологии может прилагаться к олигофрении, а также к патологиям развития скелета:
- деформациям грудной клетки (воронкообразной/килевидной ее форме);
- искривлению позвоночника (сколиозу);
- суставным контрактурам.
Нередки и другие врожденные заболевания. Например:
- гемангиомы;
- гидроцефалия;
- косолапость;
- дисплазия тазобедренных суставов;
- крипторхизм.
СМА I самая «вредная»: ее сопровождают развивающийся паралич, а также парез мускулатуры, отвечающей за дыхание. Из-за последнего развивается дыхательная недостаточность, из-за которой больной даже может погибнуть. А нарушение глотания может оказаться причиной попадания пищи в дыхательные пути и развития аспирационной пневмонии. Она тоже может привести к смерти.
СМА II начинает проявляться после того, как малышу исполняется полгода. В таком возрасте малыш уже удовлетворительно развит, он может стоять, держать головку, садиться, переворачиваться. Однако почти никогда больной малыш не успевает овладеть навыками ходьбы. В большей части случает данное заболевание проявляется после того, как малыш перенесет какую-либо острую инфекционную патологию. Например, пищевую токсикоинфекцию.
Когда СМА II только начинает проявляться, у малыша в ножках появляются периферические парезы, которые потом быстро оказываются в ручках, в туловище. Проявляется диффузная гипотония мышц, начинают исчезать глубокие рефлексы. Можно заметить и следующее:
- контрактуры сухожилий;
- тремор пальцев;
- фасцикуляции (непроизвольное дерганье) языка.
Важно! Позже начинает проявляться бульбарный синдром, развивается дыхательная недостаточность. Благодаря замедленному, если сравнивать с врожденной формой, развитию этой разновидности СМА, больной человек обычно доживает до пятнадцати лет.
СМА III, она же амиотрофия Кугельберга-Веландера — наименее вредная разновидность спинальной амиотрофии. Начинает проявляться, когда ребенку исполняется два года. Иногда может протекать бессимптомно даже до 30 лет. Впрочем, в этом случае пациент уже далеко не ребенок, что, однако, не делает его здоровее. При СМА III не задерживается развитие психики, пациент долго может двигаться без посторонней помощи. У него даже есть шансы и в глубокой старости иметь возможность самостоятельно себя обслуживать.
СМА IV, она же взрослая форма спинальной амиотрофии, представляет собой медленно развивающуюся патологию. Она обычно начинается после того, как человеку исполняется 35 лет. Такая форма если и сокращает жизнь, то незначительно. С другой стороны, у больного наблюдаются следующая картина:
- слабые проксимальные мышцы;
- фасцикуляции;
- ухудшение сухожильных рефлексов;
- потеря способности к ходьбе.
Третий тип патологии можно обнаружить значительно позже – бывает, что болезнь не проявляет себя десятки лет
Электромиограмма показывает «ритм частокола» — спонтанную ритмическую активность. Так можно выявить патологию передних спинномозговых рогов. Если провести морфологическое исследование биоптатов мышц, можно заметить атро- и гипертрофированные волокна первого и второго типов. Также скапливаются мелкие круглые волокна, которые перемежаются с волокнами гипертрофированными — это «пучковая» атрофия. Если провести патоморфологическое исследование, становится заметно набухание/сморщивание/атрофия мотонейронов спинномозговых передних рогов, а довольно часто — еще и ядер нервов, которые выходят из головного мозга.
Что такое СМА?
СМА (спинальная мышечная атрофия) ― генетическое нервно-мышечное заболевание, поражающее двигательные нейроны спинного мозга и приводящее к нарастающей мышечной слабости. Заболевание носит прогрессирующий характер, слабость начинается с мышц ног и всего тела и с развитием заболевания доходит до мышц, отвечающих за глотание и дыхание. При этом интеллект больных СМА абсолютно сохранен.
В зависимости от тяжести симптомов выделяют 3 основных типа проксимальной СМА: СМА 1, СМА 2, СМА 3. Чем раньше проявляются первые признаки болезни, тем ярче выражены симптомы, тем они тяжелее и тем быстрее прогрессирует заболевание.
СМА I (БОЛЕЗНЬ ВЕРДНИГА-ГОФФМАНА)
Наиболее тяжелая форма. Возраст проявления болезни: до 6 месяцев.
Описание
- Выраженная мышечная гипотония; синдром «вялого ребенка»; не держит голову; не достигает способности сидеть и переворачиваться; обвисшее тело при удерживании подвешенным на животе;
- Ослабленные кашлевой, сосательный и глотательные рефлексы; поперхивание; дыхательные нарушения;
- В анамнезе может быть сниженная внутриутробная активность плода. Может наблюдаться деформация суставов и конечностей из-за внутриутробной гипотонии.
Течение
- Грубая задержка моторного развития;
- Быстрое развитие контрактур и деформаций грудной клетки;
- Прогрессирование бульбарных и дыхательных нарушений, проблемы с глотанием еды и слюны, отхождением мокроты;
- Высокий риск развития аспирационных пневмоний;
- Быстрое нарастание дыхательной недостаточности, особенно при присоединении инфекции.
Прогноз
- Наиболее тяжелая форма: при отсутствии респираторной поддержки большинство детей не доживают до 2 лет;
- Смерть наступает, как правило, из-за нарастания дыхательной недостаточности и развития пневмоний;
- Своевременная респираторная поддержка может увеличить продолжительность жизни ребенка;
- Такие дети нуждаются в паллиативном наблюдении.
СМА II (БОЛЕЗНЬ ДУБОВИЦА)
Возраст проявления болезни: 6-18 месяцев.
Описание
- Отставание в моторном развитии;
- Способность сидеть без поддержки, иногда ― ползать или стоять, но эти возможности редуцируются по мере взросления;
- Может наблюдаться тремор пальцев;
- Мышечные и скелетные деформации;
- Нарушения дыхания.
Течение
- Задержка моторного развития, его остановка и регресс;
- Слабость межреберных мышц, поверхностное диафрагмальное дыхание, ослабление кашлевой функции, со временем развитие дыхательной недостаточности;
- Повышенный риск осложнений после респираторной инфекции;
- Деформации грудной клетки, контрактуры, сколиоз.
Прогноз
Своевременная помощь и респираторная поддержка увеличивают продолжительность жизни.
Юлия Самойлова. Самый известный в России человек со СМА. Фото: https://www.instagram.com/jsvok/
СМА III (БОЛЕЗНЬ КУГЕЛЬБЕРГА-ВЕЛАНДЕРА)
Возраст проявления болезни: после 18 месяцев
Описание
- Способность ходить самостоятельно (со временем теряется);
- Сложности с комплексными моторными навыками (например, подъем по лестнице, бег);
- По мере прогрессирования болезни могут отмечаться трудности с жеванием и глотанием, а также дыхательные проблемы и проблемы с откашливанием.
Течение
- Прогрессирует медленно;
- К подростковому возрасту большинство больных садятся в коляску, но у некоторых способность самостоятельно ходить может сохраниться до взрослого возраста;
- Со временем появляются выраженные контрактуры и сколиоз;
- Риск осложнений после респираторной инфекции.
Прогноз
При надлежащем уходе имеют обычную продолжительность жизни.
III тип
Болезнь Кугельберга-Веландера – вариант поздней амиотрофии. При данной форме диагноза первые признаки возникают после двух лет, либо во взрослом возрасте. Дети, которые уже умеют ходить, внезапно становятся неловкими, жалуются на боль в ногах при хождении. Они слишком часто падают, неуверенно ходят и практически перестают бегать. Многие родители замечают изменения походки и внезапно появившуюся неуклюжесть. Вначале развития патологии поражаются мышцы ног, затем атрофируются мышцы верхних конечностей и других частей тела. Из-за снижения объема мышц также отмечается снижение веса.
У некоторых больных может наступить период ремиссии, в который прекращается прогрессирование диагноза. Этот период может продлиться от нескольких недель, до нескольких десятков лет.
Нарушение дыхательной функции наиболее опасное проявление атрофии мускулатуры.
Со стороны психики и умственного развития нарушения не выявляются.
Диагностика
На раннем развитии заболевание бывает тяжело поставить точный диагноз, так как признаки похожи с другими болезнями. Первым делом ребенок должен пройти консультацию у невропатолога. Если у малыша заболевание при рождении, то примерный диагноз могут поставить в роддоме. Специалист проводит осмотр и проверяет нарушения двигательной системы.
Проводятся следующие исследования:
Магнитно-резонансная томография назначается для проверки позвоночника. Она обязательно используется при спинальной амиотрофии, потому как позволяет понять, в каком состоянии находится интересующая область. Процедура считается безопасной, потому как она не ухудшает состояние здоровья человека. Более того, она рекомендована даже для детей, у которых имеется амиотрофия Верднига. Если специалисты и родители понимают, что несовершеннолетний не сможет неподвижно лежать около часа, тогда может возникнуть вопрос о применении наркоза. В любом случае, от МРТ не стоит отказываться, она позволит узнать немало полезной информации о состоянии здоровья и о развитии амиотрофии Верднига.
Советуем изучить — Рак позвоночника симптомы и проявлениеЭлектронейромиогафия помогает изучить состояние нервных и мышечных окончаний. Это тоже требуется для того, чтобы понять, насколько тяжело проходит заболевание.
Если у человека спинальная амиотрофия, тогда важно как можно больше собрать информации о состоянии организма. В частности придётся проходить данное обследование.
Генетическая диагностика дает возможность выявить мутацию гена. Это актуально для тех случаев, когда имеется амиотрофия Верднига. Конечно, обследование не самое простое, и не во всех клиниках его могут провести. При этом оно является обязательным для тех людей, которые столкнулись со спинальной амиотрофией.
Найти врожденную патологию можно еще до рождения малыша. Проводится диагностика в том случае, если у девушки наблюдается слабое шевеление плода. Тогда беременная должна лечь в больницу для полного обследования.
ЛФК
По мнению большинства врачей, комфортная физическая активность, если только не впадать в крайности, весьма полезна для самочувствия и здоровья больного СМА.
Суставам необходимо обеспечивать подвижность, а не подвергать их риску повреждений. При этом следует сохранять объем движений, чтобы сохранять суставы эластичными. При этом нужно поддерживать циркуляцию крови. Также, что важнее всего для детей, надо поддерживать мобильность высокой, чтобы исследовать окружающее.
Важно! Лучше всего проводить занятия в бассейне, наполненном водой, имеющей температуру 30-32 градуса тепла. Но, во-первых, человек, больной СМА, не должен заниматься плаванием сам, а во-вторых, нужно соблюдать определенные меры безопасности.
По мнению некоторых врачей, уделять массу внимания постепенному понижению в организме и без того недостаточного числа мотонейронов не так уж и нужно. Для определения, следует ли это учитывать, разрабатывая комплекс ЛФК, нужны исследования. Мнения профессионалов расходятся: одни считают, что перегрузить организм упражнениями невозможно, другие же — что, делая гимнастический комплекс «до посинения», можно форсировать отмирание оставшихся мотонейронов. Так что при ЛФК требуется аккуратность и гимнастику необходимо прекратить, не доводя себя до изнеможения.
Программы трудо- и физиотерапии полезны для людей любого возраста, если те хотят научиться максимально рационально использовать оставшиеся мышечные функции, а также разобраться, как лучше всего справляться с повседневными задачами.
Физическая активность очень полезна для пациентов с СМА
Сейчас можно найти приспособления, которые полезны даже малышам – для изучения окружающего пространства. Маленьким детям может помочь все, что только придумал для решения этой задачи человеческий гений, начиная от ходунков и заканчивая ортезами.
Более того, есть семьи, которые самостоятельно придумывают и изготавливают свои приспособления, снабженные особыми функциями. К примеру, такие, у которых можно менять высоту, чтобы ребенок мог хоть ползать на полу, хоть сидеть на столе.
Человеку любого возраста, если у него СМА, ощутимо полезны приспособления для решения повседневных задач, не вызывающих затруднений у здоровых людей.
Болезнь Фацио-Лонде
Это особый вариант проявления атрофии. Патология начинает развиваться, как правило, к трем годам жизни, и в некоторых случаях в подростковом возрасте. Для недуга характерна слабость мышц лица, в том числе жевательной мускулатуры. Отмечается затруднение глотания и изменения голоса. Патология сопровождается атрофией языка, в некоторых случаях может появиться офтальмоплегия. Прогрессирует болезнь очень быстро. Спустя 6-12 месяцев наступает смерть. К бульбарным нарушениям могут добавиться параличи и парезы в конечностях. В некоторых случаях эти симптомы не успевают даже развиться. Тем не менее, при вскрытии всегда выявляется поражение в клетках передних спинномозговых рогов на всем протяжении.
Причины и факторы возникновения болезни
Почему появляется спинальная амиотрофия? Какие факторы риска можно выделить? Какова главная причина недуга? Болезнь носит генетический характер и передается аутосомно-рецессивным путем. При этом дефектный ген должен быть у обоих родителей. В этом случае спинальная атрофия у ребенка возникает в 25% случаев.
Как гены влияют на развитие болезни? Спинальная амиотрофия появляется при дефиците или при полном отсутствии белка SMN. Он обеспечивает выживаемость двигательных нейронов. Его недостаток – главная причина атрофии мышц при СМА. Клетки мозга умирают, и от них не идет сигнал к мышцам.
При делеции длинного плеча 5-ой хромосомы, на которой расположен ген SMN 1, белок не вырабатывается. Развивается спинальная амиотрофия.
Факторы риска:
- Семейный анамнез отягощен по мертворождениям;
- Болезнь выявлена у близких родственников;
- Семейные случаи младенческой смертности;
- Спинальная амиотрофия у старшего ребенка.
Вероятность возникновения мышечной атрофии у младших детей 1:4.
Причины заболевания
Основной причиной спинальной амиотрофии Верднига Гоффмана является мутация гена SMN (от англ. survival motor neuron). Располагается ген выживания мотонейрона на 5 хромосоме, представлен двумя копиями:
- SMNt — теломерная копия, функционально активная;
- SMNc — центромерная копия гена, частично активная.
Продуктом этого гена является белок SMN, участвующий в образовании и регенерации РНК.
Нехватка белка вызывает патологии двигательного нейрона.
В 95% случаев болезни Верднига-Гофмана наблюдается делеция (выпадение) SMNt, что вызывает дефицит белка SMN. Копия SMNc лишь частично компенсирует отсутствие теломерной копии.
Количество копий SMNc составляет от 1 до 5. Чем больше число центромерных копий, тем полнее воспроизводится белок и менее выражена патология нейрона.
Кроме количества копий SMNc, тяжесть заболевания определяется длиной участка делеции и генными конверсиями еще 3 генов: NAIP, H4F5, GTF2H2. Участием дополнительных модифицирующих факторов объясняется клиническое разнообразие симптомов.
Виды спинальных амиотрофий
Спинальная мышечная атрофия – одно из самых опасных генетически обусловленных заболеваний, которое обнаруживается у младенцев, подростков, взрослых.
Страшно узнать, что малыш никогда не будет сидеть, стоять, бегать. Еще страшнее видеть, как нормально растущий и развивающийся ребенок вдруг начинает медленно угасать, постоянно падать, через несколько месяцев не может подняться по лестнице, а однажды теряет способность просто встать.
Условно различают проксимальные и дистальные формы СМА. 80% всех видов спинальных амиотрофий относятся к проксимальной форме.
К ним относятся, кроме заболевания Верднига-Гофмана:
- СМА 3 или болезнь Кульдберга-Веландер — заболевают в возрасте от 2 лет до 20, первыми страдают мышцы таза. Отмечается тремор кистей, лордоз.
- Летальная X-сцепленная форма — описана в 1994 году Baumbach, наследуется по рецессивному признаку, наблюдаются преимущественно поражения мышц таза и плечевого пояса.
- Инфантильная дегенерация — нарушаются рефлексы сосания, глотания, дыхание. Смерть может последовать в возрасте до 5 месяцев.
- СПА Рюкю — ген сцепливания не выявлен, наблюдается отсутствие рефлексов, мышечная слабость конечностей после рождения.
К дистальным спинальным амиотрофиям относится прогрессирующий детский паралич Фацио-Лонде, болезнь Брауна-Виалетта-ван Лэре, СМА с параличом диафрагмы, эпилепсией и глазодвигательными нарушениями.
Клиническая картина
Признаки СМА 1 и СМА 2 сильно различаются. Проявления СМА 1 нередко выявляют ещё во время беременности, так как плод в утробе матери неактивно и очень редко шевелится. После рождения у ребёнка отмечается дыхательная недостаточность, нередко он не может сам дышать, отсутствуют и другие врождённые рефлексы. Основными проявлениями болезни можно считать:
- Пониженный мышечный тонус.
- Отставание в физическом развитие.
- Неспособность удерживать голову в вертикальном положении.
- Не может самостоятельно перевернуться на бок, на живот или на спину.
- Слабо выраженный паралич конечностей.
- Отсутствие рефлексов глотания.
- Отсутствие рефлекса сосания.
Ребёнок принимает характерную позу, в которой находится практически постоянно. При этом в большинстве случаев может отмечаться и паралич диафрагмы. Всё это со временем приводит к нарушению развития скелета, появляется сколиоз, нередко отмечается наличие горба, изменяется форма грудной клетки. Только 12% таких детей доживают до 5 лет.