По поводу причин возникновения этого заболевания мнения специалистов расходятся. У неврологов преобладают две точки зрения на обстоятельства, которые предшествуют возникновению патологии.
- Наследственный фактор (доброкачественная эпилепсия младенчества возникает как раз по причине генетической предрасположенности детского организма).
- Нарушение развития коры головного мозга (отставание развития нервных клеток) — последние исследования склоняют неврологов к этой позиции, которая косвенно подтверждается прекращением болезни при достижении подросткового возраста.
В чем ученые сходятся, так это в причине выздоровления детей по достижении половой зрелости: очаги эпилепсии исчезают при снижении возбудимости нервных тканей, что и случается по мере созревания.
Причины возникновения доброкачественной роландической эпилепсии
Точные причины заболевания неизвестны. Тем не менее, существует гипотеза, которая подтверждает наследственный характер патологии. Заболевание может возникнуть из-за патологического нарушения созревания коры мозга в центрально-височной области.
Что касается доброкачественной эпилепсии, доказана ее зависимость от возраста пациента, так как ее диагностируют зачастую у детей. Обусловлена патология может быть повышенной возбудимостью детского мозга. Произойти это может по самым разным причинам:
- преобладание возбуждающих нейротрансмиттеров;
- структурные и функциональные особенности эпилептогенных областей (гиппокампа, неокортекса, амигдалы);
- низкое содержание ГАМК;
- увеличенное количество возбуждающих возвратных синапсов;
- незрелость ГАМК-рецепторов.
По мере того, как созревает детский мозг, его возбудимость снижается, а очаги патологии постепенно исчезают. Обычно после достижения детьми пубертатного периода количество приступов становится меньше вплоть до полного их исчезновения.
Причины
Этиология в настоящий момент окончательно не установлена. У 20–60% пациентов есть близкие кровные родственники, страдавшие тем же заболеванием, но прямая аутосомно-доминантная или аутосомно-рецессивная передача отсутствует. С учетом этого, исследователи полагают, что патология передается по наследству не одним, а двумя разными генами.
Механизм развития пока тоже точно не выяснен. Наиболее популярная общепризнанная теория – обусловленность припадков нарушениями созревания височной коры и повышенной возбудимостью церебральных структур у детей. По мере взросления возбудимость мозга снижается, очаги перестают проявлять эпилептогенную активность, эпиприступы становятся более редкими, а затем исчезают.
Симптомы доброкачественной роландической эпилепсии
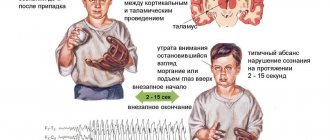
При роландической эпилепсии у пациентов периодически возникают приступы, которые носят умеренный характер. При этом приступ протекает без утраты пациентом сознания. Зачастую перед ним больной испытывает сенсорную ауру, для которой характерны такие ощущения, как покалывания, пощипывания, онемение на деснах, лице, глотке, языке и губах. Затем возникают сильные тонические и мышечные сокращения.
Если у пациента случается гемифациальный приступ, у него наблюдаются судороги в мышцах одной половины лица. При фарингооральном приступе случаются односторонние судороги языка, губ, гортани и глотки, которые неизбежно сопровождаются нарушением речи. Из-за судорожных сокращений мышц гортани появляются горловые звуки, которые напоминают булькание или полоскание горла.
Приступы у пациентов происходят в основном в ночное время. Нередко они наблюдаются в период засыпания или пробуждения. В редких случаях наблюдаются и дневные, и ночные приступы. На 20% всех случаев заболевания приходятся брахиофациальные приступы, для которых характерно распространение судорог лицевой области на гомолатеральную руку. У пациентов могут также наблюдаться более тяжелые формы приступов, при которых судороги охватывают все мышцы тела. Обычно из-за таких обширных судорог пациент теряет сознание.
Симптомы и признаки эпилепсии
Эпилепсию классифицируют по месту распространения электрического разряда. Это может быть отдельная область в головном мозге, или же разряд охватывает сразу два полушария (генерализованные приступы).
? Когда задействован сразу весь мозг принято говорить о первично-генерализованных приступах:
- Тонико-клонические приступы. Это эпилепсия в ее “классическом” представлении: припадки с потерей сознания, выключением, падением, судорогами, выкатыванием глаз, закусыванием языка и пр. Человек, страдающий эпилепсией, после генерализованного приступа не помнит о происходящем и чувствует сильную усталость, может погрузиться в сон.
- Абсансы. Короткие выключения сознания на от 10 секунд до 2 минут без конвульсий. После приступа состояние неизменное, часто абсансы принимаются за рассеянность ребенка.
? Когда нервные клетки повреждены в какой-то одной области, судорожный очаг находится в одной зоне, но потом может распространятся и на оба полушария.
Это фокальные (парциальные) приступы эпилепсии. Они являются наиболее распространенными среди всех случаев эпилепсии, подразделяются на:
Простые — приступы без выключения и изменения сознаний. Проявления простых фокальных эпилептических приступов различны:
- моторные признаки: подергивания, тики, непроизвольные движения в одной части тела, “марш”, другие неконтролируемые телодвижения и мимика
- изменения сенсорного восприятия: галлюцинации, кажущиеся посторонние звуки, странный привкус во рту, головокружение
- потливость, покраснение лица, изменение зрачков
- вокализации: человек может бесконтрольно выкрикивать разные слова
Сложные — меняется или выключается сознание, человек может не помнить о произошедшем. Сложные фокальные приступы эпилепсии могут переходить в генерализованные.
Для них характерно измененное поведение:
- двигательные автоматизмы
- моторные нарушения
- нарушения сознания
- сложные галлюцинации
- злоба, фобии
- деменция (состояние де-жа-вю, уже увиденного или пережитого события) и др.
? Вторично-генерализованные эпилептические приступы — начинаются в одной области и в последующем распространяются на оба полушария. Начинаются в виде судорог или нарушения сознания и переходят в сильный эпилептический припадок с задействованием всех групп мышц.
Среди видов эпилепсии выделяют разные формы:
- Доброкачественная эпилепсия (семейные, идиопатические, миоклонические судороги). Проходит сама, не трансформируется в другие формы;
- Фебрильные судороги (при повышении температуры, могут быть единичным случаем эпилептического припадка);
- Абсансная эпилепсия – дебют в детском возрасте, характеризуется выключением сознания;
- Неонатальные судороги (с дебютом 1-12 месяцев) – синдром Веста, Синдром Оттахара – тяжелая патология, влечет за собой инвалидность, чаще всего переходит в другую форму эпилепсии);
- Генерализованная эпилепсия с тонико-клоническими приступами и другие.
Течение доброкачественной роландической эпилепсии
Для доброкачественной роландической эпилепсии характерны кратковременные приступы, продолжительность которых составляет около 2-3 минут. Обычно такие приступы единичные и наблюдаются по несколько раз за год. В начале развития болезни эпилептические припадки могут встречаться часто, однако со временем они происходят гораздо реже. Важно отметить, что данная разновидность эпилепсии не будет опасной для детей, поскольку не провоцирует задержку их психомоторного развития и олигофрению. Тем не менее, в редких случаях происходят неврологические нарушения.
Общие сведения
Если рассматривать все доброкачественные фокальные эпилепсии, то роландическая является самой часто встречаемой среди пациентов в области педиатрии. По статистическим данным она занимает 15% от числа заболеваний детей до 15 лет и примерно 20% проявлением судорог у них же.
На 100 000 детей заболевание будет проявляться, как минимум у 21 человека. Периодом, в который возможно появление данного расстройства, составляет примерно 12 лет: от 2 до 14. Очевидно, что основной промежуток, в который заболевает около 85% людей, приходится на возраст от 4 лет до 10.
Отличительным признаком болезни является полное исчезновение болей, судорог и эпиприступов к 15-18 годам, а также полное отсутствие каких-либо опасных воздействий на психофизическое здоровье.
Диагностика доброкачественной роландической эпилепсии
Диагностировать заболевание максимально точно удается с помощью электроэнцефалографии (ЭЭГ). Эта методика применяется для исследования функциональной активности мозга и выявления в ней патологических нарушений. Однако стоит отметить, что у некоторых пациентов можно заметить изменения в ЭЭГ только во время сна. Именно поэтому врач может дополнительно назначить проведение ночной ЭЭГ или полисомнографии.
Поставить диагноз невролог может в случае обнаружения следующей патологии: выявление высокоамплитудных острых волн или пиков, которые локализованы в центрально-височных отведениях. При этом функциональная активность мозга находится в норме. Результаты ЭЭГ в таком случае показывают, что после пиков или острых волн сразу же следуют медленные волны, которые вместе составляют «роландический комплекс». Этот симптом может иметь как двусторонний, так и односторонний характер.
Диагностика
В пользу роландической эпилепсии свидетельствует типичный возраст появления симптомов, наличие родственников с аналогичными проявлениями, редкие приступы и их преимущественно ночной характер. Основным объективным методом исследования, позволяющим подтвердить диагноз, является электроэнцефалография. Следует учитывать, что при записи в межприступный период изменения нередко отсутствуют. Для получения достоверных данных требуется полисомнография или ЭЭГ-видеомониторинг.
«Роландический комплекс» на энцефалограммах имеет продолжительность до 30 миллисекунд, представлен острыми пиками с последующими медленными волнами в височных отведениях. Чаще выявляется на стороне, контрлатеральной по отношению к зоне возникновения судорог, иногда определяется с двух сторон. Отличительной особенностью считается непостоянство комплексов при нескольких последовательных записях, разделенных временным промежутком.
Важной частью диагностических мероприятий является исключение других заболеваний, способных стать причиной появления похожих проявлений. Болезнь дифференцируют с симптоматической фокальной эпилепсией вследствие энцефалита, менингоэнцефалита, абсцесса мозга, ЧМТ, внутримозговых новообразований. В пользу роландического варианта свидетельствует отсутствие неврологического дефицита и поведенческих расстройств, полностью сохранный интеллект, типичная картина на ЭЭГ. В сомнительных случаях дополнительно назначают МРТ.
Серьезные затруднения могут возникать при дифференцировке роландической и ночной разновидностей эпилепсии, что связано со сложностью различения нарушений речи и сознания во время ночных пароксизмов. При постановке окончательного диагноза опираются на данные электроэнцефалограммы.
Дифференциальная диагностика доброкачественной роландической эпилепсии
Симптомы доброкачественной роландической эпилепсии схожи с проявлениями других неврологических патологий. Прежде всего это заболевание стоит дифференцировать от других разновидностей эпилепсии, спровоцированных черепно-мозговыми травмами, новообразованиями, воспалительными поражениями мозга при энцефалите, менингите, абсцессе. Главным отличительным признаком патологии считается отсутствие в клинической картине расстройств поведения и серьезных изменений неврологического статуса, а также нормальная активность при ЭЭГ и полная сохранность интеллекта. Более точную дифференциальную диагностику можно провести с помощью МРТ мозга.
Неврологи отмечают, что сложнее всего дифференцировать доброкачественную роландическую эпилепсию от ночной эпилепсии. В этом случае вполне типичные для патологии нарушения речи часто интерпретируются как расстройства сознания. Поэтому для постановки правильного и корректного диагноза крайне важно провести ЭЭГ. Если у больного есть височная или лобная эпилепсия, результаты покажут наличие очаговых изменений активности мозга.
Нередко у неврологов возникают трудности с дифференциацией доброкачественной роландической эпилепсии и синдрома псевдоленнокса. Наиболее выраженными признаками, при которых у больного диагностируют синдром псевдоленнокса, будут: комплекс атипичных абсансов с типичными роландическими эпиприступами, наличие интеллектуально-мнестических нарушений, обнаружение во время ЭЭГ медленных комплексов или диффузной пиковой активности.
Роландическая эпилепсия
К.Ю. Мухин, П.А. Темин, Е.А. Рыкова
Луиджо Роландо (1773-1831 г.), итальянский врач и анатом, дал классическое топографическое описание центральной борозды коры головного мозга. При идиопатической парциальной эпилепсии детского возраста, характеризующейся короткими гемифациальными моторными ночными приступами, часто с предшествующей соматосенсорной аурой и типичными изменениями ЭЭГ (полифазные спайки с локализацией в центральной и срединной височной областях) [14], эпилептогенной зоной являются нижние отделы роландической борозды. Изучение этой разновидности идиопатической парциальной эпилепсии начато более 40 лет назад. Первоначально были описаны специфические изменения ЭЭГ у определенной группы детей. В 1952 г. H.Gastaut [25] впервые обратил внимание на особые эпилептические изменения ЭЭГ у некоторых детей: полифазные спайки со строгой локализацией в перироландической области. Первое клиническое описание симптомов эпилепсии с роландическими спайками (1958 г.) принадлежит Р.Nayras и М.Веаussart [40]. В последующем Е.Gibbs и F.Gibbs [27], С.Lombroso [36], Р.Loisea и соавт. [35] провели клинический анализ симптомов при эпилепсии с роландическими спайками и предложили называть данную форму эпилепсии роландической. Авторы отметили ее благоприятный прогноз и отсутствие симптомов органического поражения центральной нервной системы.
Частота
Роландическая эпилепсия (РЭ) — одна из наиболее частых форм эпилепсии детского возраста. Распространенность ее составляет 21 на 100 тыс. здорового детского населения [29]. Частота РЭ среди всех форм эпилепсии с дебютом до 13 лет варьирует по разным данным от 11,5% [15] до 25% [5]. Из 360больных эпилепсией детей, наблюдавшихся Р.Lerman [34],у 14,4% была диагностирована роландическая эпилепсия. Для сравнения заметим, что одна из наиболее частых форм эпилепсии детского возраста — пикнолепсия — была диагностирована лишь у 10,5% пациентов. Не исключено, что истинная частота роландической эпилепсии в популяции значительно выше, так как у многих больных отмечаются единичные ночные приступы, часто остающиеся без внимания родителей и врачей [34].
Большинство авторов отмечают преобладание мальчиков среди больных роландической эпилепсии [3]. Соотношение мальчиков и девочек в среднем составляет 6:4 [11].Среди 100 бальных, наблюдавшихся Р.Lerman [34], было 62 мальчика и 38 девочек.
Клиника
Дебют роландической эпилепсии варьирует в возрастном интервале 2 — 14 лет. В 83% случаев РЭ дебютирует в возрасте 4 — 10 лет[5]. У подавляющего большинства пациентов приступы начинаются между 5-м и 10-м годом жизни с максимумом в возрасте 9 лет [9]. Средний возраст появления приступов — 9,9 года [33]. Начало заболевания в возрасте до 2 лет отмечается не чаще чем в 8% случаев [15]. Имеются единичные описания начала РЭ на 1-м году жизни [17], однако отнесение данных случаев к РЭ дискутируется [21].Начало заболевания после 11 лет также является редкостью, а после 14 лет такие случаи не наблюдаются [9].
Клиническая симптоматика приступов при роландической эпилепсии, как правило, типична. Наблюдаются простые парциальные (моторные, сенсорные, вегетативные), сложные парциальные (моторные) и вторично генерализованныс приступы. Наиболее типичны простые парциальные моторные и/или сенсорные пароксизмы [2].
Простые парциальные приступы составляют «ядро» роландической эпилепсии и наблюдаются у 70 — 80% больных. Наиболее типично начало приступа с соматосенсорной ауры: ощущение покалывания, онемения, «прохождения электрического тока» унилатерально в области глотки, языка, десны. Вслед за аурой развивается парциальный приступ. Возможны следующие варианты: гемифациальные приступы; унилатеральные тонические, клонические или тонико-клонические судороги мышц лица; фарингооральные приступы; унилатеральные судороги губы, языка, глотки, гортани, часто сочетающиеся с анартрией и гиперсаливацией. Гемифациальные приступы имеютместо у 37% больных, фарингооральные — у 53% [91. Часто во сне больные издают своеобразные горловыезвуки типа «бульканья», «хрюканья», «полоскания горла». Истинную частоту соматосенсорных приступов (щечная парестезия по терминологии J.Aicardi [5]) определить сложно, так как дети, особенно маленькие, затрудняются описать свои ощущения во время приступов.
У 20% больных судороги могут распространяться с мышц лица на гомолатеральную руку (брахиофациальные приступы) и примерно в 8%случаев вовлекать и ногу (унилатеральные приступы). По мере развития заболевания приступы могут менять сторонность. Вторично генерализованные судорожные приступы отмечаются у 20-25% больных роландической эпилепсии. Они наиболее характерны для младших детей, и возникновение генeрализованных приступов «жестко» приурочено ко сну. Наличие у пациентов длительное время только генерализованных судорожных приступов нехарактерно для РЭ, как и наличие абсансов, психомоторных приступов и приступов с психическими симптомами [5].
Продолжительность приступов при роландической эпилепсии, как правило, небольшая [5] от нескольких-секунд до 2-3мин. У 11% [16] — 22% [5] больных продолжительность пароксизмов превышает 10-15 мин, у 16% [5] отмечаются тяжелые продолжительные приступы ,заканчивающиеся постприступным гемипарезом (паралич Тодда). Частота приступов при РЭ обычно невысока — в среднем 2 в год [5]. В первые 1-2 года с момента дебюта заболевания приступы могут быть более частыми, однако с течением времени они возникают все реже. После 13-16 лет возможно полное исчезновение приступов. У 10-40% детей наблюдается единичный приступ за все время болезни, даже если они не получают антиконвульсантов [41].Еженедельные и более частые, ежедневные приступы наблюдаются лишь в 6% [35] — 20% [34] случаев. Серийные приступы и повторные в течение одной ночи редки и наблюдались в 3% случаев, описанных Т . Deonna и со авт.[17].
В редких публикациях [15,16,23,34] сообщается о развитии эпилептического статуса при РЭ. Часто та его при РЭ составляет около 11% [16]. Подробное описание эпилептического статуса у больных РЭ представлено в работе N . Fejerman и А.Di Blasi [23]. Авторы наблюдали 2 мальчиков 8 лет с дебютом РЭ в 3 года, у которых возник длительный статус гемифациальных приступов. Сознание было сохранено, однако констатировались анартрия и выраженное слюнотечение. Пероральное назначение антиконвульсантов в высоких дозах, как и парентеральное введение диазепама или лоразепама, не оказало влияния на эпилептический статус. Лишь назначение гормональных препаратов(дексаметазон) полностью купировало судороги.Вызывает сомнение, однако, отнесение данныхслучаев к роландической эпилепсии. У одного из этих пациентов наблюдались типичные абсансы, у другого -приступы с джексоновским маршем; у обоих приступы были резистeнтны к антиконвульсантам . Возможно, данные случаи представляют собой атипичную форму РЭ. Е.Roulet и соавт. [42] описал иэпилептический статус у мальчика 6 лет с роландической эпилепсии. Единственным его проявлением было длительное слюнотечение в сочетании с оролингвомоторной диспраксией. На ЭЭГ во время слюнотечения регистрировались спайк-волновые комплексы ,включая роландические. При увеличении дозы карбамазепина слюнотечение прекратилось. По мнению авторов, длительное перманентное слюнотечение у больных роландической эпилепсии может быть единственным симптомом эпилептического статуса.
Пароксизмы РЭ связаны с ритмом сон -бодрствование. Наиболее типичны ночные приступы ,возникающие преимущественно при засыпании и пробуждении. При ночных приступах пароксизмы возникают в период пробуждения (35%), реже — все редине ночи (25%) и при засыпании (20%). У 25-30%больных приступы наблюдаются как во сне, так и всостоянии бодрствования [5]. Лишь у 5-25% пациентов они возникают исключительно со время бодрствования [5,34]. Имеется некоторое различие картины приступов в зависимости от ритма сон — бодрствование. Дневные приступы практически всегда простые парциальные, чаще гемифациальные ,короткие, ночные, как правило, более тяжелые, продолжительные, обычно унилатеральные или вторично генерализованные. Провести оценку сознания у пациентов с ночными приступами сложно; феномен анартрии часто симулируетклинику выключения сознания. Сложные парциальные приступы при роландической эпилепсии редки и составляют лишь около 5% всех случаев [15]. Возможно, на протяжении приступа у некоторых больных имеет место «флюктуация» уровня нарушения со знания.
J.Aicatdi и J.Сhevrie [4] была выделена группа больных сосвоеобразным эпилептическим синдромом ,клиническая симптоматика которого была схожа с роландической эпилепсией. У больных отмечались простые парциальные гемифациальные и гемиклонические приступы,однако в сочетании с миоклонически-астатическими, атоническими приступами и в ряде случаев с абсансами. Данная группа наблюдений классифицирована какатипичный вариант РЭ. Частота его, согласно Т.Deonnaи соавт. [16], составляет 5% среди всех больных РЭ.Таксономическое положение данного синдрома спорно. По мнению J.Aicatdi и J.Сhevrie [5], данная форма эпилепсии является нозологически самостоятельным синдромом с четко очерченными клиникой, изменениями ЭЭГ и прогнозом. Другие авторы предполагают наличие атипичного варианта в рамках РЭ [17]. Подробное описание данного синдрома представлено Т.Deonna и соавт. [16] на примере 6 пациентов. Среди обследованных больных преобладали мальчики. Приступы дебютировали в возрастном интервале от 2 до 7 лет у неврологически нормальных детей с сохранным интеллектом. Клинические симптомы включали различные виды приступов. Характерными были ночные простые парциальные приступы, подобные таковым при РЭ, миоклонически-астатические и атонические приступы. У ряда больных отмечались атипичные абсансы. Приступы во всех случаях были частыми, ежедневными и приводили к многократным падениям пациентов и тяжелым ушибам. На ЭЭГ типичные роландические спайки сочетались с медленными комплексами пик-волна, характерными для синдрома Леннокса — Гасто. Отмечалось нарастание эпилептической активности в фазе медленного сна.
Клиническая симптоматика атипичной роландической эпилепсии носит черты целого ряда эпилептических синдромов: РЭ (простые парциальные ночные приступы в сочетаниис типичными роландическими спайками), синдрома Леннокса — Гасто (частые атонически-астатические приступы, атипичные абсансы в сочетании с медленными комплексами пик-волна) и эпилепсии смиоклонически-астатическими приступами,описанной Н.Doose [19]. Однако кардинальным отличием атипичной роландической эпилепсии от синдрома Леннокса — Гасто и эпилепсии с миоклоничeски-астатическими приступами являются отсутствие у пациентов нарушений интеллекта и хороший прогноз. Р.Loisea и соавт. [35] провели катамнестическое исследование13 пациентов с атипичной РЭ в течение не менее 9лет. Спустя разный промежуток времени во всех случаях была достигнута полная ремиссия, при этом большая часть пациентов (10) не применяли регулярной противоэпилептической терапии. Авторы не отметили ни отставания в психическом развитии, ни серьезных нарушений поведения как в наиболее активный период заболевания, так и в период ремиссии, что сближает данные случаи с типичной РЭ. По мнению авторов, при данном синдроме следует избегать «агрессивной» противоэпилептической терапии ввиду хорошего прогноза.
O.Dulac и соавт. [21] проанализировали случаи парциальной эпилепсии с ранним дебютом — между 8днями и 3 годами жизни. Среди 442 больных выявлено 17с парциальной эпилепсией с ранним дебютом .Приступы характеризовались как простые парциальные с частой вторичной генерализацией. По мнению авторов, данные случаи являются переходной формой между доброкачественной эпилепсией новорожденных и РЭ. В отличие от двух указанных синдромов прогноз был неблагоприятными приступы не поддавались медикаментозной терапии. Последующие исследования покажут, являются ли случаи парциальной эпилепсии с дебютом в первые 3 года жизни нозологически самостоятельным синдромом или еще одним» атипичным вариантом» РЭ.
Неврологический статус
Неврологический статус у детей, страдающих роландической эпилепсии, изучен достаточно подробно. Роландическая эпилепсия относится к идиопатическим формам эпилепсии, при которых отсутствуют признаки органического поражения головного мозга, что подтверждается большинством публикаций. Более того, по мнению А. Веаumanoir и соавт. [8] наличие таких симптомов противоречит критериям диагноза роландической эпилепсии. Однако в последние годы благодаря внедрению в клиническую практику высокоэффективных нейрорадиологических методов исследования(компьютерная томография, ядерно-магнитный резонанс, позитронная эмиссионная томография) появились единичные сообщения об обнаружении структурных изменений в головном мозге у больных РЭ.
Из 100 больных, наблюдавшихся Р.Lerman и S.Kivity [33], у 4 констатированы симптомы органического поражения центральной нервной системы: детский церебральный паралич (гемипаретическая и тетраплегическая формы), микроцефалия, умеренная задержка умственного развития. Во всех этих случаях диагноз РЭ не вызывал сомнения и был подтвержден как клинически, так и нейрофизиологически. Пневмоэнцефалография не выявила нарушений у данных больных. S.Blom и J.Heijbet [11]в 3 (7,5%) из 40 случаев РЭ обнаружили у больных центральный гемипарез. E.Roulet и соавт. [42] отметили проявления оролингвомоторной диспраксии у больного РЭ. Такие симптомы, как микроцефалия, косоглазие, мозжечковая недостаточность, задержка психического и речевого развития, констатировали у ряда больных РЭ Р.Santanelli и соавт.[43]. Синдром гиперактивности был обнаружен у 16,7%больных РЭ [34].
Генетика
Р.Вrау и W.Wiser [13] первыми констатировали наличие семейных случаев роландической эпилепсии и предположили аутосомно-доминантную модель наследования с неполной пенетрантностью и возрастной зависимостью. В последние десятилетия проведены многочисленные клинико-генеалогические исследования при роландической эпилепсии, подтверждающие правомерность данной концепции. Согласно обобщенным данным литературы, 8,9% [35] — 68% [29]больных РЭ имеют родственников, страдающих эпилепсией или имеющих приступы в анамнезе, и до 30% [13] — родственников с наличием на ЭЭГ роландических спайков при отсутствии приступов. Частота обнаружения спайков у сибсов пробандов и детей, родители которых страдали РЭ, составляет25-36% (в популяции здорового населения — 1,4-5% [З7]).Однако лишь у малой части из них (12% в исследовании Р.Вrау и W.Wiser [13]) отмечались приступы: остальные были клинически здоровы. Характер приступов у родственников больных роландической эпилепсии может быть различным. Типичные приступы, характерные для РЭ, констатируются у 13%родственников, абсансная эпилепсия — у 10%, гснсрализованные судорожные приступы — у 3%,фокальная эпилепсия — у 1% [9].
В ряде исследований изучена конкордантность монозиготных близнецов по РЭ. Обнаружена высочайшая конкордантность по наличию на ЭЭГ роландических спайков, но не по развитию самой РЭ. T.Kajitani и соавт. [30] изучили 3 пары монозиготных близнецов в возрасте 5-11 лет, в которых один из сибсов страдал РЭ. Во всех случаях констатирована типичная роландическая эпилептическая активность на ЭЭГ, но ни у одного из здоровых сибсов не было никаких проявлений РЭ.
В последние годы была выдвинута гипотеза о мультифакторном наследовании роландической эпилепсии [29]. Она основывается на том факте, что лишь у небольшой части детей, имеющих на ЭЭГ роландические спайки, в дальнейшем развивается РЭ. Предполагается, что роландические спайки и развитие РЭ детерминированы двумя различными, но сцепленными генами. В 1982 г. O.Eeg-Olofsson и соавт. [22] обнаружили, что у родителей, сибсов и других родственников детей, больных РЭ, низкая встречаемость гаплотипа А1В8 антигенов лейкоцитарной гистосовместимости. Частота его в общей популяции крайне высока [22]- Возможно, что данный гаплотип играет роль протектора или ингибирующего фактора, препятствующего развитию РЭ.
Интересны исследования, раскрывающие взаимосвязь РЭ с фебрильными судорогами. E.Frantzen и соавт. [24] сообщили, что у 20% детей с фебрильными судорогами в дальнейшем на ЭЭГ появляется фокальная эпилептическая активность, идентичная роландическим спайкам. Ни у одного из этих пациентов не отмечалось в дальнейшем эпилептических приступов. Исследования на монозиготных близнецах также показали возможное генетическое сцепление между РЭ и фебрильными судорогами. M.Lennox-Buchthul [32] изучила 24 пары монозиготных близнецов, в которых по крайней мере у 1 из пары имелись фебрильные судороги, и выявила, что 20% их сибсов имели редкие ночные приступы. У 2 из 24 обнаружено сочетание ночных приступов с фебрильными судорогами. К сожалению, автор не идентифицировала данные ночные приступы, однако по характеру их течения и возрасту дебюта можно предположить, что это случаи РЭ. В исследовании T.Kajitani и соавт. [31] среди 3 пар монозиготных близнецов 3 имели РЭ и 5 — фебрильные судороги. Данные работы могут свидетельствовать о генетическом сцеплении РЭ и фебрильных судорог. Подтверждением этой гипотезы служит и клиническая схожесть двух данных синдромов: высокая генетическая детерминированность, «жесткий» возрастзависимый дебют, доброкачественный прогноз [1] .
Остается неясной роль экзогенных, средовых факторов в развитии роландической эпилепсии. H.Doose и W.Baier [18] предположили, что генетические факторы при РЭ детерминируют низкий порог судорожной готовности головного мозга. При этом здоровых детей, имеющих на ЭЭГ роландические спайки, они расценили как субклинических носителей с низким судорожным порогом. По мнению авторов, воздействие различных экзогенных факторов в онтогенезе, а также сцепление с другими генами может способствовать у таких пациентов клинической манифестации заболевания и оказывать некоторое влияние на его течение. Т.Каjitani и соавт. [30] описали 3 родных сибсов, у каждого из которых на ЭЭГ имелись типичные роландические спайки. У одного из сибсов РЭ дебютировала в 4 года во время лихорадочного заболевания, у другого отмечался единственный приступ в возрасте 10 лет при просмотре телепередач, третий миновал «критический период» для дебюта и был здоров. Данное наблюдение иллюстрирует полиморфизм клинических проявлений заболевания, что может зависеть от различных экзогенных воздействий.
Факторами, трансформирующими субклиническое носительство в РЭ, могут быть патология беременности и родов, травмы головы, нейроинфекции и пр. [5]. Однако более чем у половины детей, страдающих РЭ, указание на наличие данных факторов в анамнезе отсутствует[15].
Электроэнцефалография
Необходимым исследованием для объективизации диагноза РЭ является электроэнцефалография [14].На ЭЭГ в межприступном периоде при РЭ обнаруживаются характерные, типичные «роландические» или «жестко» локализованы: центральная и центровисочная области. Роландические комплексы могут наблюдаться как унилатерально (обычно контралатерально гемифациальным приступам) — 60% больных, так и билатерально — 40% [29].Эпилептические комплексы, как правило, независимы друг от друга, лишь в редких случаях наблюдается их билатерально-синхронное распространение с амплитудным преобладанием с одной стороны [26,34].
D.Gregory и Р.Wong [28] провели изучение точной локализации роландических спайков, используя метод компьютеризированного топографического картирования. Авторы обнаружили, что максимум «позитивности» электрического диполя при РЭ находится в центрально-височной области, а максимум «негативности» — в лобной. Предположено, что специфические ЭЭГ-паттерны при РЭ исходят из зоны, расположенной в нижних отделах роландической борозды, на границе с сильвиевой бороздой. Типичной особенностью изменений ЭЭГ при РЭ является нестойкость паттернов, их вариабельность от одной записи к другой. Роландические спайки могут исчезать, а затем появляться вновь, менять стройность, конфигурацию даже при двух последующих записях ЭЭГ через короткий промежуток времени. Нестойкость ЭЭГ-паттернов при РЭ свидетельствует, по мнению J.Aicardi [5], об отсутствии органических изменений в головном мозге при РЭ. В связи с этим отсутствие роландических спайков при однократном злектроэнцефалографическом исследовании не может считаться убедительным аргументом для исключения диагноза РЭ при наличии типичной картины приступов [15]. Крайне важным для подтверждения диагноза РЭ является исследование ЭЭГ во время сна. Около 30% детей, страдающих РЭ, имеют роландические спайки исключительно во время сна [29]. Во время дремоты и на всех стадиях сна отмечается тенденция к переходу унилатеральных роландических комплексов в билатеральные [34].
Интересной находкой при РЭ является обнаружение на ЭЭГ наряду с типичными роландическими комплексами и других эпилептических паттернов. От 10 до 20% детей с РЭ имеют на ЭЭГ пик-волновые комплексы в других зонах коры, главным образом в затылочной области [41]. Морфология «затылочных комплексов «близка к роландическим и к наблюдаемым при доброкачественной фокальной эпилепсии с затылочными пароксизмами [10]. По мнению J.Aicardi [5],частота «затылочных комплексов» при Рэо братно пропорциональна возрасту ребенка и является нередкой у больных до 3 лет жизни. От 7% [34]до 20% [5] пациентов с РЭ демонстрируют на ЭЭГ типичную генерализованную пик-волновую активность с частотой 3-4 Гц, нередко возникающую при гипервентиляции. У отдельных больных возможно появление медленных пик-волновых комплексов. Большинство авторов придерживаются однозначного мнения об отсутствии корреляции между частотой и выраженностью пик- волновыхкомплексов на ЭЭГ и особенностями течения заболевания.
Исследование ЭЭГ во время приступа представляется довольно сложным ввиду низкой частоты приступов при РЭ. B.Dalla-Bernardina и соавт. [15]описали во время ночного приступа появление на ЭЭГ низкоамплитудной быстрой активности в центрально-височной области, переходящей в роландические комплексы с распространением на всю гемисферу и с последующим охватом всего полушария.
Нейрорадиологическое исследование
Сведения о нeйрорадиологическом исследовании у больных РЭ единичны. H.Gastaut [25] одним из первых изучил данные компьютерной томографии у 15 больных РЭ и не нашел патологических изменений ни в одном случае. В последующем при нейрорадиологическом исследовании у больных РЭ были обнаружены некоторые структурные изменения в головном мозге: расширение сильвиевой щели, наличие полости прозрачной перегородки (2 из 13случаев) [39], вентрикуломегалия, арахноидальные кисты (3 из 17 случаев) [38]. Р.Santanelli и соавт. [43] представили подробное клиническое и нейрорадиологическое описание 3 случаев РЭ, сочетающейся со структурными изменениями головного мозга. У одного больного была выявлена липома мозолистого тела, у другого (соспондилоторакальной дисплазией) — агенезия мозолистого тела с вентрикуломегалией, у третьего — множество церебральных, преимущественно перивентрикулярных, кальцификатов (врожденный токсоплазмоз). У всех этих больных наблюдались типичная клиническая картина РЭ и роландические спайки на ЭЭГ.
Обнаруженные при нейрорадиологическом исследовании у единичных больных РЭ органические симптомы поражения головного мозга трудно интерпретировать однозначно. Не исключено, что эти нарушения не имеют непосредственной причинно-следственной связи с РЭ и могут быть вызваны сочетанием РЭ с другими заболеваниями — детским церебральным параличом, микроцефалией, токсоплазмозом, эктомезодермальными дисплазиями. Как и в популяции в целом, у больных РЭ могут наблюдаться перинатальное поражение центральной нервной системы, постнатальные черепно-мозговые травмы. Частота перинатальных поражений центральной нервной системы среди больных РЭ составляет 6% [16]- 13% [34], сотрясения головного мозга — 4 — 5% [34], что не превышает статистических данных в популяции здоровых детей. Принципиально важный и до конца не решенный вопрос — влияют ли данные экзогенные факторы на возникновение и течение РЭ. По мнению J.Aicardi [5], нарушения, обнаруженные в головном мозге у больных РЭ, не могут быть причиной эпилепсии, а являются случайными находками. С другой стороны, нельзя игнорировать тот факт, что у ряда больных РЭ структурные изменения с головном мозге локализуются в нижних отделах роландической борозды [43], а это не исключает полностью возможность существования «симптоматической» формы эпилепсии.
Лечение
За последние годы в лечении РЭ апробирован целый ряд противоэпилептических препаратов. Большинство авторов рекомендуют применять препараты, преимущественно воздействующие на парциальные формы эпилепсии: карбамазепин (финлепсин, тегретол) и дифенин (фенитоин). При лечении РЭ необходимо избегать политерапии, а также на значения противосудорожных препаратов в высоких дозах. Доброкачественное течение РЭ, отсутствие интеллектуально-мнестических нарушений у пациентов не дают оснований рекомендовать «агрессивную» антиконвульсантную политерапию для лечения данной формы эпилепсии ввиду возможности развития тяжелых побочных эффектов.
По мнению P.Lerman [34], а также В. Dalla-Bermardina и соавт.[15], одним из препаратов выбора влечении РЭ является фенитоин в низких и средних дозах. При возникновении приступов исключительно в ночное время или в период пробуждения рекомендован однократный прием фенитоина на ночь. Во всех наблюдавшихся авторами случаях применение средних терапевтических доз фенитоина приводило к полной клинической ремиссии приступов. Согласно данным P.Lerman и S.Kivity [33], эффективность фенитоина в лечении РЭ превышает таковую карбамазепина и фенобарбитала.
Карбамазепин также высокоэффективен в лечении РЭ [41] и отличается от дифенина минимальной выраженностью побочных эффектов терапии.
Сультиам (осполот) эффективен и хорошо переносится больными РЭ [19]. Применение барбитуратов (фенобарбитал, бензонал) лимитировано частым и тяжелым побочным влиянием на интеллектуально-мнестическис функции и поведение детей [5] и не может быть рекомендовано для лечения РЭ.
В последние годы появились публикации, свидетельствующие об эффективности препаратов вальпроевой кислоты (депакин, конувулекс) при РЭ[6,15,29]. Важной особенностью их является позитивное влияние на интеллектуально-мнестические функции пациентов и хорошая переносимость [12]. Однако, катамнестические исследования эффективности применения вальпроатов при РЭ отсутствуют.
Большинство авторов считают, что продолжительность применения антиконвульсантов при РЭ не должна превышать 2 лет с момента последнего приступа [35]. В среднем продолжительность медикаментозного лечения при РЭ составляет 3,2 года [33]. Однако в случае раннего дебюта приступов (2-3 года) лечение должно быть продолжено до 10-летнего возраста, независимо от длительности ремиссии [4]. Лечение рекомендуется назначать только после повторного приступа. Сохранение на ЭЭГ типичной эпилептической активности не может являться причиной продолжения антиконвульсантной терапии, если у больного имеется длительная ремиссия.
Прогноз
Особенностью РЭ является хороший прогноз заболевания [20]. По данным P.Loisea и соавт. [35], после 13лет приступы РЭ исчезли у 93,5% из 168 обследованных больных, а после 16 лет — у 98,8%. P.Loisea и соавт. [35] подробно исследовали влияние отдельных клинических симптомов РЭ на прогноз заболевания. В качестве возможных факторов, влияющих на прогноз, были проанализированы пол пациентов, возраст дебюта эпилепсии, частота и характер приступов, их суточное распределение, особенности неврологического статуса. У всех 168 пациентов с РЭ прослежен катамнез в течение не менее 4 лет с момента последнего приступа. Выделены факторы, влияющие на прогноз РЭ: возраст дебюта и частота приступов. Обнаружено, что лишь возраст дебюта эпилепсии статистически достоверно коррелирует с прогнозом РЭ. Установлено, что продолжительность заболевания и резистентность к терапии увеличиваются при раннем (до 4 лет) и позднем (после 10 лет) дебюте эпилепсии. Все остальные факторы существенно не влияют на прогноз РЭ.
Длительное наблюдение больных в катамнезе обнаружило возможность рецидивов приступов при РЭ после продолжительной ремиссии. Частота рецидивов приступов во взрослом возрасте при РЭ невысока — от 1,8% [35] до 4% [34]. Рецидив приступов чаще наблюдается у женщин в период гормональной перестройки, через 3 — 10 лет с момента наступления ремиссии, и не связан с приемом антиконвульсантов [35]. В большинстве случаев появляются генерализованные судорожные приступы, единичные или редкие. Важной особенностью является отсутствие на ЭЭГ типичных роландических спайков; по мнению P.Loisea и соавт. [35], ЭЭГ у данных пациентов обычно в пределах нормы.
Учитывая генерализованный характер приступов, появление их спустя длительное время после наступления ремиссии, отсутствие роландических спайков на ЭЭГ, P.Lerman [34] предположил, что данные случаи не имеют отношения к РЭ и представляют собой возникновение эпилепсии de novo. Противоречит данной концепции тот факт, что частота рецидивов при РЭ (2-4%) значительно превышает популяционную частоту эпилепсии (0,8%). Возможно, в возникновении приступов во взрослом возрасте при РЭ играет роль взаимодействие экзогенных факторов с генетически детерминированным снижением порога судорожной готовности. Одним из «разрешающих» факторов может явиться нарушение гормонального баланса в организме.
Другой возможной причиной рецидивов приступов может быть существование стойких структурных изменений в головном мозге с локализацией в нижних отделах роландической или сильвиевой борозды. G.Ambrosetto и соавт. [6] описали рецидив типичных «роландических» приступов у больного в возрасте 21 года. Пациент страдал РЭ с 10 лет: ночные простые парциальные и вторичногенерализованные приступы. С 13 лет наступила ремиссия, с 16 детой прекратил прием антиконвульсантов. В 21 год без видимой причины у больного развились точно такие же парциальные и вторично генерализованные приступы в ночное время с частотой 1-4 в месяц. При компьютернойтомографии патологии не выявлено. На ЭЭГ в 21 год ив 30 лет (в динамике) — правосторонний фокустипичной роландической активности. Уникальностьданного наблюдения состоит в том, что у больного РЭ приступы вновь возникли спустя 8 лет после наступления ремиссии и носили типичный для РЭ характер, являясь, однако, резистентными к антиконвульсантам. По мнению авторов, в данном случае имеется высокая вероятность наличия у больного структурных изменений в роландической области, что может быть выявлено при более тщательном нейрорадиологическом обследовании (ядерно-магнитный резонанс, позитронная эмиссионная томография).
Дальнейшие исследования покажут соотношение генетических и экзогенных факторов в детерминации РЭ и возможность существования «симптоматических» форм РЭ, обусловленных структурными изменениями, локализованными в роландической области. Необходимо также проведение молекулярно-генетических исследований с целью поиска генов, ответственных за развитие РЭ. Это позволит определить взаимосвязь РЭ с другими формами идиопатической эпилепсии, такими как доброкачественная затылочная эпилепсия Гасто, детская абсанс-эпилепсия и др.
ЛИТЕРАТУРА
I. Бадалян Л.О., Темин П.А., Мухин К.Ю. Фебрильныесудороги. Методические рекомендации. М. 1987; 24.
2. Карлов В.А. Эпилепсия. М. 1990; 219 — 223.
3. Сараджишвили П.М., Геладзе Т.Ш. Там же 1977, 148 — 149.
4. Aicardi .J., Chevrie J.-J. Dev Med Child Neurol 1982, 24: 281 — 292.
5. Aicardi J. Epilepsy in children 1986; 4.
6. Ambrosetto G., Tenuper P., Baruzzi A. J Neural Neurosurg Psychiat 1985; 48: 90.
7. Bancaund J., Collomb D., Dell M.B. Rev Neurol 1958; 99: 206 — 209.
8. Beaumanoir A., BallisT.,Varfis G., Ansai K. Epilepsia l974; 15: 301 — 315.
9. Beaussart M., Favou R. Ibid 1978; 19: 337 — 342.
10. Beydoun A»index.html» Garofalo E.A»index.html» Drury I. Ibid 1992; 33: 1091 — 1096.
11. Blom S., Heijbel J. Ibid 1982: 23: 629 — 631.
12. Bourgeois B.F.D. Ibid 1994. 35: 2: 18 — 23.
13. Bray P.P., Wiser W.C. Pediatrics 1965; 36: 207 — 211.
14. Comissionon Classification and Terminology of the ILAE. Epilepsia 1989; 30: 389 -399.
15. Dalla-Bermardina В., Sgro V., Fontana E. Epileptic syndromes in infancy, childhoodand adolescence. Paris 1992; 173 — 186.
16. DeonnaTh., ZieglevA-L., Despland P.-A. Neuropediatrics 1986; 17: 144 — 151.
17. Deonna Th., Zieglev A.-L., Despland P.-A. Guyvan Меllе. Epilepsia 1986; 27: 241- 247.
18. Doose Н., Baier W.K. Еuгор J Pediatr 1989; 149: 152 — 158.
19. Doose H. Epileptic syndromes in enfancy, childhood and adolescence. Paris 1992; 103- 114.
20. Dreifuss F.E. Epilepsia 1994; 35: 2: 30 — 34.
21. Dulac O., Cusmai R., Olivera K.de. Ibid 1989; 30: 798 — 801.
22. Eeg-Olofsson O., Safwenbery J., Wigrtz A. Ibid 1982; 23: 27 — 34.
23. Fejerman N., Di Blasi A.M. Ibid 1987; 28: 351 — 355.
24. Frantzen E., Lennox-Buchthal M., Nygaakt A. Electroen-cephalogr Clin Neurophysiol1968; 24: 197 — 212.
25. Gastaut H. Rev Neurol 1952; 87: 488 — 490.
26. Gastaut H., Gastaut J.L. Epilepsia 1976; 17: 325 — 326.
27. Gibbs E.L., Gibbs F.A. Ibid 1960; 1: 448 — 453.
28. Gregory D.L., Wong P.K. Ibid 1984, 25: 705 — 711.
29. Heijbel J. Pediatric Epilepsy. Helsinky 1989.
30. Kajitani Т., Nakaltmra M., Llcaka K., Kobuchi S. Advances in Epileptology 1980; 4:171 — 175.
31. Kajitani Т., Kimura Т., Sumita M., Kaneco M. Brain Dev 1992; 14: 230 — 234.
32. Lennox-Buchthul M. Epilepsia 1971, 12: 197 — 212. 33. Lerman P., Kivity S. ArchNeural 1975; 32: 261 — 264.
34. Lerman P. Epileptic syndromes in infancy, childhood and adolescence. Paris 1992;173 — 186.
35. Loisea P., Duche В., Cordova S. et al. Epilepsia 1988; 29: 229 — 235.
36. Lombroso C.T. Arch Neurol 1967; 17: 52 — 59.
37. Luders Н.O., Lesser R.P., Dinner D.S., Morris H.H. Epilepsy — electroclinicalsyndromes. Berlin 1987; 303 — 346.
38. Mambelli M., Moscano F., Maroni P. et al. Bulll. Liga Int. Epilepsy 1985; 51/52: 79- 80.
39. Morikawa Т., Osawa Т., Ishihara O., Seino M. Brain Dev 1979; 1: 303 — 346.
40. Nayrac P., Beaussart M. Rev Neurol 1958; 99: 201 — 206.
41. Panayiotopoulos С.Р. J Neurol Neurosurg Psychiat 1993; 56: 2 — 5.
42. Roulet E., Deonna Th., Despland P.A. Epilepsia 1989; 30. 564 — 568.
43. Santanelli P., Вureau M., Magaudda A. et al. Ibid 1989; 30: 182 — 188.
Лечение доброкачественной роландической эпилепсии
В неврологии вопрос лечения доброкачественной роландической эпилепсии остается спорным. Обусловлено это тем, что у детей с возрастом все симптомы заболевания исчезают без дополнительного медицинского вмешательства. Поэтому некоторые врачи отстаивают мнение о нецелесообразности назначения антиэпилептической терапии. Противоположное мнение основано на сложности дифференциальной диагностики заболевания. Может случиться так, что диагноз будет поставлен неправильно или же патология перейдет в стадию псевдоленнокса. Чтобы предотвратить возможные осложнения, врачи могут все же назначить пациенту антиэпилептическую терапию.
При лечении детей с доброкачественной роландической эпилепсией используется принцип монотерапии — им назначается всего один препарат. Обычно лечение детей начинается с назначения им вальпроевой кислоты (депакина, конвульсофина, конвулекса). Если лечение оказывается неэффективным или у ребенка наблюдается непереносимость этого препарата, его заменяют топамаксом или леветирацетамом. Детям старше семи лет могут назначить прием карбомазепина.
Родители нередко не сразу замечают единичные или редкие эпилептические приступы у детей, поскольку в большинстве случаев они возникают ночью. Однако сразу после обнаружения эпилептических приступов ребенка необходимо показать врачу-неврологу. Диагностика и лечение патологии подбираются для каждого случая индивидуально. Наиболее пристального наблюдения требуют больные до трех лет, у которых из-за незрелости нервных клеток может наблюдаться учащение приступов.
Родителям больного ребенка, у которого случился приступ, также необходимо знать, что они смогут сделать самостоятельно до приезда скорой. Если у малыша возник сложный припадок, который сопровождается серьезными моторными нарушениями (тонические судороги или мышечные подергивания лица, языка, гортани и глотки), его нужно немного приподнять и успокоить. Крайне важно сделать это, если приступ случился во время питья, еды или сна. Для предотвращения западания языка необходимо положить голову ребенка набок, после чего вложить ему в рот носовой платок или какой-либо мягкий предмет. Если у ребенка наблюдается длительный судорожный приступ, необходимо срочно вызвать скорую помощь.
Эпилепсия у детей
Эпилепсия – одно из самых распространенных неврологических заболеваний в мире. Ему подвержены люди всех возрастов, однако у детей разные эпилептические проявления встречаются в три раза чаще. Первый эпилептический припадок в 78% появляется в детском возрасте.
Выделяют около 60 видов эпилепсии. Ребенок с диагнозом эпилепсия может ничем не отличаться от сверстников, не иметь никаких припадков, играть и развиваться по возрасту. Но плохо учиться в школе, из-за того, что “засматривается” в одну точку на 15 секунд и пропускает информацию на уроке (абсансы). Или же грудной ребенок с синдромом Веста с судорогами, которые сложно отличить от обычной двигательной активности новорожденного.
Такие судороги могут повторяться до 100 раз в сутки, и каждый раз электрический разряд будет разрушать формирующийся мозг малыша. Хотя внешне эти припадки не кажутся ничем серьезным, ребенок просто разводит ручки в стороны. Такой ребенок не развивается, даже не может держать головку. Это приводит к пожизненной инвалидизации малыша с последующим летальным исходом. Поэтому неверно говорить об эпилепсии как об одном заболевании, и подходы к ее лечению будут различны.
Рекомендации при эпилептических приступах
Существует ряд рекомендаций врачей, соблюдение которых поможет предотвратить эпилептический приступ. Прежде всего нужно строго придерживаться режима сна и бодрствования. Ребенок обязательно должен хорошо высыпаться, поскольку проблемы со сном могут спровоцировать сильный приступ. В большинстве случаев эпилептические приступы случаются у ребенка во сне. При этом заметить приступ можно далеко не всегда (обычно это становится понятно только, если больной прикусит язык во время приступа). Поэтому если малыш спит в отдельной комнате, желательно использовать радионяню — прибор, позволяющий услышать звуки в соседней комнате.
У больных роландической эпилепсией нередко наблюдается бессонница ночью и сонливость днем. Что касается сонливости, то она возникает преимущественно из-за употребления медикаментов. Бессонница может быть спровоцирована нарушением гигиены сна: больной не должен спать в душном помещении, при включенном телевизоре, не пить и не переедать перед сном. Ложиться спать ребенок должен в установленное время. Если все эти рекомендации не помогли и приступы повторяются регулярно, нужно обратиться за консультацией к неврологу.
Диагностика эпилепсии
Эпилепсия диагностируется посредством ЭЭГ (Электроэнцефалограмма), на картине наблюдаются скачки Тета волн, дизритмия. Расшифровкой ЭЭГ должен заниматься опытный невролог-эпилептолог. Золотой стандарт эпилептологии – проведение ночного 12-часового видеомониторинга сна ребенка.
Только в этом случае можно с достоверностью 90% определить характер приступа, область распространения разряда, и его наличие в принципе. Во время дневного рутинного ЭЭГ за пол часа можно выявить наличие эпилепсии только в 30% случаев, и того меньше, если диагностика проводится грудному ребенку.
В случае выявления у детей эпилептической активности, врач назначает МРТ головного мозга. Магнитно-резонансная поможет определиться, имеются ли у ребенка органические поражения головного мозга, опухоли, кисты и другие аномалии, которые порождают электрический разряд.
Также необходимо провести анализ крови на дефицит микроэлементов и витаминов (особенно – магния, цинка, омега-3). Клинически доказана взаимосвязь витаминодефицита и эпилептических припадков у детей.
Хирургическое лечение эпилепсии
Применяется в случаях с очаговой формой эпилепсии при органических поражениях головного мозга или новообразованиях. Лечение эпилепсии хирургическим путем применяется либо для удаления новообразования в головном мозге, либо для удаления части мозга, в котором появляется электрический разряд.
Хирургическое вмешательство – крайняя мера, однако результативность достигается в 85% случаев. Только 20% больным, страдающим от эпилептических припадков показано хирургическое вмешательство. Лечение эпилепсии проводится посредством следующих методов:
- Субпиальные рассечения
- Лобэктомия
- Имплантация нейростимулятора
- Гемисферотомия функциональная
- Удаление патологического образования (2)
Медикаментозное лечение эпилепсии
Традиционно спектр препаратов, применяемый для лечения эпилепсии направлен на:
- обезболивание судорог
- снижение длительности эпилептического приступа
- уменьшение частоты приступов
- прекращение появления новых случаев эпилепсии
При эпилепсии ПЭП во многих случаях приходится принимать всю жизнь. У одной трети (примерно 30%) людей с эпилепсией, припадки продолжаются несмотря на применение различных комбинаций основных противоэпилептических препаратов.
Для лечения эпилепсии используют:
- Психотропы – действуют на ЦНС и изменяют сознание и психическую активность, высшие мозговые функции
- Нейротропы — активизируют или тормозят передачу импульсов между нейронами
- Рацетамы – сравнительно новый подкласс ноотропных средств, активно исследуется и считается перспективным в лечении эпилепсии
Подбор ПЭП может занимать долгое время. Для лечения эпилепсии в некоторых случаях приходится менять препарат каждый месяц.
Действующие вещества в антиконвульсантах:
- барбитураты
- фенитоин
- карбамазепин
- ламотриджин
- леветирацетам
- этосуксимид
- вальпроевая кислота
К сожалению, для каждого препарата есть большой ряд побочных эффектов, особенно негативно такое лечение сказывается на детях, страдающих эпилепсией.
О побочных эффекты от медикаментозного лечения эпилепсии у детей:
- гиперактивность
- раздражительность
- нарушение структуры сна
- наркотическая зависимость
- атаксия
- дискенезия
- поражение печени
- апластическая анемия
- изменения соединительной ткани (приводит к огрублению черт лица, тугоподвижности суставов)
- анорексия, снижение массы тела
- рвота
- акне
- гиперплазия десен
- остеопороз
- общая интоксикация
- атрофия мозжечка
- грубая задержка развития
- системная красная волчанка
- дипрессия
- снижение памяти
- психозы
- необратимое концентрическое сужение полей зрения и др. (1)
Кетогенная диета для лечения эпилепсии у детей
В нашем центре мы выступаем за использование пациентами с эпилепсией кетогенной диеты. Формат курса (2-3 недели) не позволяет нам посадить ребенка на диету. Однако, мы очень советуем родителям проконсультироваться с врачом по приезду домой и начать процесс лечения эпилепсии диетой. В 10-15% случаев дети с фармакологической резистентностью достигают ремиссии за 2 года.
Кетогенная диета – это не просто режим питания при эпилепсии, это – лечение. Любое небольшое отступление от диеты, даже использование зубной пасты, в которой содержится сахар – влияет на ее эффективность. Диета назначается врачом, сопровождается на протяжении всего лечения эпилепсии (обычно это 2 года) диетологом, и начинается в стационаре с 24 часового голода.
Диета была разработана в 1920-м году для облегчения течения эпилептических припадков у детей. Она почти исключает углеводы, основа рациона – жиры и умеренное количество белковой пищи. Соотношение жиров к белкам + углеводам составляет 4 к 1.
Кетогенная диета при лечении эпилепсии действует в 50% всех случаев, 34% детей имеют хорошие, устойчивые результаты после ее применения. Почти у всех детей (более 90%) наблюдается выраженное улучшение состояния за 6 – 24 месяцев применения диеты. (3, 4)