Эпилепсия — это хроническое заболевание центральной нервной системы, характеризующееся возникновением двух или более эпилептических приступов, которые начинаются внезапно и непроизвольно, длятся обычно короткий промежуток времени, иногда могут быть вызваны яркими и мерцающими вспышками света. Эпилепсия занимает третье место в структуре неврологических заболеваний и является патологией, которая может возникать как и у детей, так и взрослых. В 1981 году Международная лига по борьбе с эпилепсией создала единую классификацию эпилептических приступов, согласно которой существуют парциальные (фокальные, локальные) и генерализованные приступы (ГП). В данной статье мы разберем, что такое генерализованная эпилепсия (ГЭ).
ГЭ — вид эпилепсии, сопровождаемый признаками первично-диффузного вовлечения церебральных тканей с выраженным усилением психической и двигательной активности. Выделяют следующие типы генерализованных приступов:
- абсансные (типичные petit mal и атипичные);
- миоклонические;
- клонические;
- тонические;
- тонико-клонические (grand mal);
- атонические.
Суть классификации заключается в том, что она учитывает тонкую нейронную организацию мозга со специфическими функциями, которые локализуются в определенных областях. ГП характеризуются отсутствием определенного места возникновения патологического очага возбуждения, он может генерироваться в обоих полушариях.
В дополнение к этой классификации генерализованные приступы делятся на:
- идиопатические генерализованные (связанные с возрастными особенностями);
- генерализованные криптогенные и/или симптоматические;
- генерализованные симптоматические неспецифической этиологии (связанные с возрастными особенностями);
- специфические эпилептические синдромы.
Также существуют такие парциальные (имеющие конкретное место возникновения очага возбуждения в мозге, например, височная эпилепсия или теменная) приступы, которые могут преобразоваться во вторично-генерализованные (возбуждение переходит на оба полушария).
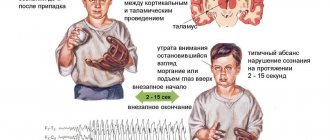
ГП могут быть судорожными и бессудорожными (абсансные и атонические). Абсансы наиболее характерны для детей 4-8 лет. Во время приступа, который длится максимум 10-20 секунд, у них отсутствует сознание, любая начатая деятельность прерывается, ребенок становится похож на статую с пустым взглядом, он не реагирует на обращение к нему. Простые абсансы могут повторяться большое количество раз за день, но помнить о них больной не будет — они никак не ощущаются им. Существуют также сложные абсансы — представляют собой простые абсансы с добавлением двусторонних двигательных феноменов (подергивание, напряжение мимических мышц, кивание головой, отведение глаз в сторону и др.). Атонический приступ наступает внезапно с потерей постурального мышечного тонуса, в результате чего больной падает, судороги отсутствуют.
Судорожные припадки в свою очередь делятся на тонические, клонические, миоклонические и тонико-клонические.
Тонические приступы характеризуются спазмом мышц лица, туловища, сопровождаются сгибанием рук и разгибанием ног, нарушением сознания, падением. Приступ внезапно начинается и также внезапно завершается, после чего больной короткое время пребывает в спутанном сознании.
Клонические приступы — повторные билатеральные подергивания конечностей, как правило, нерегулярные. Припадок тоже неожиданно начинается и завершается, ближе к концу частота сокращений уменьшается.
Миоклонические приступы представляют собой внезапные, молниеносные непроизвольные мышечные сокращения (моргание, кивки головой) без потери сознания. Могут быть генерализованными (вовлекаются мышцы туловища и конечностей) или ограниченными (в области лица или в одной конечности).
Тонико-клонические припадки — это то состояние больного, которое наиболее часто показывают в фильмах или сериалах, они являются наиболее пугающими для свидетелей. Генерализованный тонико-клонический приступ обладает характерными признаками, не присущими другим видам, что облегчает диагностику. Его возникновение неожиданное, больной теряет сознание, издает «эпилептический крик» (вследствие сокращения мышц диафрагмы и грудной мускулатуры). После этого наступает тоническая фаза с напряжением всего тела, следом — клоническая с генерализованными подергиваниями и выделением красноватой пены изо рта в результате прикусывания щеки или языка. Сопровождается это цианозом лица, выраженной тахикардией и повышением артериального давления. Между перечисленными фазами бывает фаза релаксации, во время которой нередко возникает непроизвольная дефекация или мочеиспускание. Приступ длится до 2-х минут, но без сознания больной может находиться до 15 минут. На протяжении долгого времени после припадка его будут мучать головные боли, тошнота и спутанность сознания.
Причины ГЭ
Эпилепсия является полиэтиологическим заболеванием, к возникновению которого может привести любое заболевание или травма ЦНС. Каждое структурное повреждение головного мозга вызывает дисбаланс тормозных и возбуждающих нейромедиаторов. Из-за этого мембрана нейронов становится более проницаемой для ионов Na+ и Ca2+, а количество каналов для K+ и Cl-, наоборот, уменьшается. В результате этого нейроны становятся гиперчувствительными к разрядам других нейронов, что ведет к образованию эпилептического очага.
Структурные нарушения мозга могут возникнуть в результате следующих причин:
- перинатальные — вирусные инфекции матери во время беременности (краснуха, герпес), употребление матерью токсических средств и лекарственных препаратов, запрещенных для приема беременными, родовые травмы;
- постнатальные — сотрясения мозга и другие травмы, инфекции ЦНС (менингит или энцефалит), опухоли и кровоизлияния.
Если эпилепсия есть у одного из родителей, то риск возникновения ее у ребенка не более 10%.
По причине появления эпилепсию подразделяют на идиопатическую, симптоматическую и криптогенную. Идиопатическая — эпилепсия с известной или возможной генетической предрасположенностью. У таких больных нет в анамнезе травм головы, при обследовании не обнаруживаются повреждения мозга и до возникновения приступа отсутствуют какие-либо нарушения психики. Симптоматическая — припадки возникают в результате экзогенных факторов, приводящих к повреждениям мозга (травмы, инфекции, кровоизлияние, ишемия и т.д.) с проявлением. Криптогенная характеризуется отсутствием какой-либо причины, эпилептический синдром возникает спонтанно.
Мнение эксперта
Автор: Ольга Владимировна Бойко
Врач-невролог, доктор медицинских наук
По последним данным ВОЗ, от эпилепсии страдает 4-10 человек на 1000 населения. В настоящий момент врачи регистрируют прирост заболеваемости. Это связано с разными провоцирующими факторами. Доказано, что эпилептические припадки чаще возникают у жителей стран с низким или средним уровнем развития, тем не менее в России на долю болезни приходится 2,5% случаев неврологической патологии. Эпилепсия занимает первые места в структуре инвалидизации: 30% пациентов становятся инвалидами 1 или 2 группы.
Эпилепсия может проявляться на фоне других заболеваний — такой вид патологии называется симптоматической. Врачи Юсуповской больницы выполняют тщательную диагностику для установления причин судорожного синдрома. Это необходимо для назначения корректной терапии. Обследование проводится при помощи европейского оборудования. Диагноз выставляется на основании данных МРТ, КТ, ЭЭГ. В условиях современной лаборатории осуществляется диагностика крови. Симптоматическая эпилепсия требует индивидуального подхода к лечению. Неврологи Юсуповской больницы разрабатывают персональный план терапии, включающий новые лекарственные средства, обладающие доказанной эффективностью.
Эпидемиология детской эпилепсии за рубежом
Фебрильные судороги возникают у 2-4% детей младшей возрастной группы в США, Южной Америке и Западной Европе. Их частота в азиатских странах выше. В ряде обширных проспективных исследований было определено, что приблизительно в 20% случаев первые фебрильные судороги были комплексными (продолжались более 15 минут, были фокальными или возникали, по меньшей мере, 2 раза в течение 24 часов). Чаще всего они возникают в течение второго года жизни. ФС несколько чаще встречаются у мальчиков [28,44,45,47].
Многолетние исследования показывают, что частота встречаемости конкретного типа эпилептических припадков также зависит от возраста. Так, миоклонические припадки чаще наблюдаются на первом году жизни — 10-15/100000. Частота встречаемости генерализованных тонико-клонических припадков на первом году жизни составляет 15 на 100000, в 10-65 лет – 10 на 100000, после 65 лет – 20 на 100000 [29,32]. Парциальные (фокальные) припадки наблюдаются с частотой 20 на 100000 от 1 до 65 лет, в более старшем возрасте их частота увеличивается до 40 на 100000. Абсансы имеют четкую зависимость от возраста и встречаются, главным образом, до 10 лет с частотой 11 на 100000 [36].
По данным департамента биостатистики и эпидемиологии США, в штате Оклахома, средняя заболеваемость эпилепсией составляет 5-7 случаев на 10000 детей в год в возрасте от рождения до 15 лет [25].
По данным исследований эпидемиологии инфантильных спазмов (синдрома Веста) у детей в Атланте (США), заболеваемость составила 2,9 на 10000 живорожденных, у 50% детей этиологию установить не удалось (криптогенные формы). Среди 10-ти летних детей распространенность эпилепсии была несколько ниже — 2,0 на 10000, из них 83% детей имели неврологическую патологию и имели среднюю умственную отсталость (IQ < 70), а 56% — имели глубокую умственную отсталость (IQ < 20). Инфантильные спазмы довольно редко регистрировались в общей популяции, и чаще встречались у детей с неврологической патологией [26].
Исследования, проведенные во Франции (2004-2005 гг.) показали, что распространенность детской эпилепсии составила 115,4 на 100000 [95% ДИ 106,7-124,0], первичная заболеваемость — 99,5 на 100000 в возрастной группе 0-14 лет [39].
Исследования, проведенные в Италии (1968-1973 гг.) среди детей школьного возраста, выявили высокую частоту встречаемости эпилепсии — 4,91%, из них генерализованые формы — 30,8%, роландическая эпилепсия — 23,9%, другие виды фокальных эпилепсий — 42,1%, синдром Леннокса-Гасто — 3,2%. За 4— летний период наблюдения полного выздоровления достигли 55% больных детей, у 24% — наблюдалась положительная динамика (урежение частоты приступов более, чем на 50%) [24].
На территории Финляндии распространенность детской эпилепсии составила 3,94 на 1000 детского населения. По данным исследователей, генерализованный характер припадков был характерен для детей в возрасте 0-6 лет, а фокальный — для 6-15 летнего возраста [33].
В Испании ежегодно регистрируется 62,1 случай различных форм детской эпилепсии на 100000 детского населения. Самый высокий показатель регистрации заболевания отмечен на первом году жизни (103,9 на 100000). В раннем детском возрасте симптоматические формы эпилепсии составили 21,3%, а криптогенные — 25,5%. В младшем и старшем школьных возрастах идиопатические эпилепсии составили 25,6%, а криптогенные — 20,5%. В подростковом возрасте криптогенные эпилепсии составили 21,1%, а идиопатические — 18,4% [29].
По данным эпидемиологических исследований в Памплоне (Испания) (2002 — 2005 гг.), распространенность эпилепсии среди детского населения составила 62,6 на 100000, с пиком (95,3 на 100000) в течение первого года жизни. Идиопатические формы составили 45,5%, криптогенные — 29,0%, а симптоматические — 25,5%. Фокальные припадки были отмечены у 52,9% больных, а генерализованные — у 43,5%. Среди детей грудного возраста синдром Веста составил 45,5%, его симптоматические формы 13,6%. В раннем детстве преобладали симптоматические (22,7%) и криптогенные формы (21,2%) эпилепсии и синдром Дузе (13,6%). Среди детей школьного возраста чаще встречались идиопатические доброкачественные (27,8%), и криптогенные формы (18,5%) эпилепсии. В подростковом возрасте — криптогенные формы (26,6%), и идиопатические (23,4%) [30].
Аналогичные исследования были проведены и в провинции Наварра (Испания): первичная заболеваемость эпилепсией среди детского населения составила 62,6 случаев на 100000 [95% ДИ 62,3-62,9]. Заболеваемость среди детей первого года жизни (95,3 на 100000) и постепенно снижалась к подростковому возрасту (48,7 на 100000). Фокальная эпилепсия зарегистрирована в 55% случаях, генерализованные формы — в 42,9%. У младенцев наиболее распространенными формами были синдром Веста (45,5%), симптоматические (27,5%) и криптогенные (13,6%) эпилепсии. В раннем детстве преобладали симптоматические (22,7%) и криптогенные (21,2%) эпилепсии, а синдром Дузе составил 13,6%. У детей школьного возраста преобладали идиопатические (27,8%) и криптогенные (18,5%) эпилепсии. У подростков чаще регистрировались криптогенные (27,6%) и идиопатические (18,4%) эпилепсии [31].
По данным реестра заболеваемости в Стокгольме (Швеция), первичная заболеваемость эпилепсией составила 33,9 на 100000, причем на первом году жизни этот показатель составил 77,1 на 100000 [18].
Распространенность детской эпилепсии в Норвегии в 1995 году составила 5,1 на 1000 детского населения, симптоматические и криптогенные формы преобладали у мальчиков. Симптоматическая эпилепсия составила 46%, из них 81% случаев были фармакорезистентными [48].
В прибрежной провинции Камеруна распространенность эпилепсии составляет 105 на 1000 детского населения: генерализованные формы — 35,3%, фокальные — 64,7% [41].
Эпидемиологические исследования, проведенные в префектуре Окаяма (Япония) в 1999 году, показали, что среди детей до 13 лет 2220 больны эпилепсией (из общей детской популяции 250997 детей). Самыми распространенными типами припадков были генерализованные тонико-клонические (40,7%) и инфантильные спазмы (21,0%) [19]. Заболеваемость инфантильными спазмами составила 0,25-0,42 на 1000 живорожденных в год. Среди детей младше 10 лет заболеваемость варьировала от 0,14 до 0,19 на 1000. Пик возникновения инфантильных спазмов приходился на возраст от 4 до 6 месяцев, с большей частотой среди мальчиков [27].
В Сингапуре заболеваемость детской эпилепсии составила 3,8 на 1000 детского населения, смертность — достигает 0,5 на 100000 детей [42].
Эпидемиология детской эпилепсии в популяции китайских детей (Гонконг, 2001г.) сходная: распространенность составила 4,5 на 1000 детей в возрасте до 19 лет. Идиопатические эпилепсии наблюдались у 42% детей, криптогенные — 16,8%, симптоматические — 40,8%. Частота фокальных приступов составила 48,5%, а генерализованных — 46,9%. Причем генерализованные приступы встречались чаще у детей младшей возрастной группы (до 5 лет) [38].
Исследования проведенные в Южной Индии (1989 – 1994 гг.) выявили 2531 случай эпилепсии среди детей, из которых криптогенные формы составили 48%, симптоматические — 62,9%, а идиопатические — 0,7% [40].
Распространенность эпилепсией в Пакистане составляет 9,99 на 1000 человек, самый высокий показатель — среди населения моложе 30 лет, чаще в сельских территориях. У детей преобладали идиопатические эпилепсии (76% случаев) [37].
Интересные эпидемиологические исследования детской эпилепсии в арабских странах, где проживает 724500 людей, страдающих эпилепсией. Распространенность эпилепсии в 2 раза выше у детей и подростков. В Катаре распространенность составила в сравнении с средними показателями 174 случая на 100000 детского населения, в Судане — 0,9 на 1000 и 6,5 на 1000 в Саудовской Аравии. Идиопатические формы эпилепсии составили 73,5-83,6% случаев. Основные причины симптоматической детской эпилепсии: детский церебральный паралич (ДЦП) и умственная отсталость. В Судане одной из основных причин симптоматической эпилепсии были инфекционные заболевания центральной нервной системы [23].
Исследования, проведенные в республике Танзания (Восточное побережье Африки) выявили распространенность детской эпилепсии 11,2 на 1000 [95% ДИ 8,3-13,9 на 1000], впервые выявленная эпилепсия составила 8,7 на 1000 [95% ДИ 6,7-11 на 1000] [27].
Распространенность эпилепсией в Тунисе составила 4,04 на 1000, у детей и подростков показатели оказались самыми высокими. В 93% случаев регистрировались генерализованные припадки, а основным этиологическим фактором были ДЦП и умственная отсталость [21].
Проводя сравнительные исследования эпидемиологии эпилепсии в Пакистане и Турции, исследователи показали, что распространенность эпилепсии в Пакистане составляет 9,98 на 1000 (14,8 на 1000 — в сельской местности, 7,4 на 1000 — в городах) и 7,0 на 1000 в Турции (8,8 на 1000 — в сельской местности, 4,5 на 1000 — в городах). Средний возраст дебюта эпилепсии в Пакистане составил 13,3 года, а в Турции — 12,9 лет. Распределение по типу припадков в Пакистане и Турции составило соответственно: генерализованные тонико-клонические припадки (ГТКП) — 80,5 и 65,4%, фокальные — 5 и 7,4%, тонические и атонические — 5,8 и 3,7%, миоклонические — 5,8 и 1,2% [22].
Ежегодная заболеваемость эпилепсии среди детской популяции в Эфиопии составляет 64 на 100000 [95% ДИ 44-84]. Частота ГТКП составляет — 69%, фокальные – 20%. В 22% случаев отмечена отягощенная наследственность по эпилепсии [46].
Первые признаки ГЭ
Приступы генерализованной эпилепсии совершенно внезапны, их невозможно предугадать. Но есть некоторые признаки, которые имеют схожие с эпилепсией проявления, но не являющиеся ею. Они являются следствием действия какого-либо экзогенного фактора, пагубно влияющего на работу ЦНС.
- Непроизвольные подергивания мышц, в том числе и те, которые иногда возникают при засыпании (так называемые физиологические вздрагивания). Обычно в этот момент снится, что вы спотыкаетесь или падаете с небольшой высоты, после чего резко просыпаетесь, иногда даже вскрикивая.
- Нарушения сна — кошмары, хождение во сне (лунатизм) или сноговорение.
- Мигрень и сопровождающие ее симптомы. Она может начинаться с ауры, во время которой возникают различные нарушения восприятия: искажения зрения (мерцательные скотомы, вспышки, искажение предметов, фотопсия, сужение полей зрения, временная слепота и т.п.), извращение обоняния и вкуса (могут ощущаться запахи, которых на самом деле нет, появляется металлический привкус во рту без видимого кровотечения слизистых полости рта), слуховые галлюцинации, тошнота, онемение/покалывание конечностей.
- Характерные проявления панической атаки — чувство страха, ощущение приближающейся смерти, тахикардия, тяжелое учащенное дыхание и чувство того, что вы наблюдаете за происходящим как будто со стороны.
- Атриовентрикулярная блокада может осложниться возникновением синдрома Морганьи-Адамса-Стокса — обморок, вызванный резким снижением сердечного выброса и гипоксией мозга, в результате чего возникают нарушения дыхания и судороги.
- Следующие признаки являются характерными для эпилепсии — непроизвольное мочеиспускание и прикушенный язык во время сна. Не исключено, что самый первый припадок генерализованной эпилепсии возник именно во сне.
Эпидемиология детской эпилепсии в России
Эпидемиологические исследования проводимые в Москве (1980 – 1981 гг.) показали, что у 4,4% детей прослеживалось наличие хотя бы одного судорожного эпизода, в 5,4% случаев эпилепсия сопровождалась задержкой психического развития и умственной отсталостью. Дебют заболевания в 29,3% случаев у детей приходится на возраст до 3 лет, в том числе до 1 года – 20,3%. При злокачественном течении заболевания у больных с умственной отсталостью припадки в возрасте до 3 лет возникали в 44,9% случаев (до 1 года – 37,3%). В 95,78% случаев ФС наблюдались у детей первых 5 лет жизни, из них 41,4% приходился на возраст до 1 года [14].
Заболеваемость эпилепсией в Санкт–Петербурге составила 1,56 на 1000 детского населения. У детей с эпилепсией в 81,9% случаев установлена генетическая природа заболевания [6].
В Новосибирской области показана высокая заболеваемость эпилепсии среди детей младшего и среднего школьного возраста: 14,8 на 1000 детского населения в возрасте от 7 до 13 лет. Частота встречаемости среди мальчиков, превалировала над девочками (61,1% против 38,9%). Заболеваемость идиопатическими эпилепсиями составила 3,4 на 1000 детского населения. ФС зарегистрированы у 7,5% детей, чаще у мальчиков. Отмечено превалирование криптогенных и симптоматических форм [4].
Распространенность детской эпилепсии в г. Саратове составила 2,7 на 1000 детского населения. Фокальные формы эпилепсии диагностированы в 55% случаев, генерализованные – в 45% случаев. Среди симптоматических фокальных форм преобладали височная (23,8%) и лобная (16,7%) эпилепсии. Среди идиопатических фокальных – роландическая эпилепсия (60%). Ведущими факторами риска эпилепсии у детей являлись: наследственная отягощенность, перинатальное гипоксически-ишемическое поражение, церебральные дисгенезии. Криптогенные формы составили 57,3% [7].
Распространенность эпилепсии в сельских районах Волгоградской области составила 2,84 на 1000 детского населения (среди лиц мужского пола — 3,4 на 1000, среди лиц женского пола — 2,36 на 1000). Этиологические факторы: перинатальная патология (46%), черепно-мозговая травма (20,7%), отягощенная наследственность по эпилепсии (11,%), нейроинфекции (6,7%). Фокальные припадки регистрировались в 56,0% случаев, генерализованные — 39,4% [3].
Заболеваемость эпилепсией в Республике Татарстан составила 1,0 на 1000 населения детей от 0 до 14 лет и 1,1 на 1000 подростков от 15 до 18 лет. Распространенность эпилепсии составила среди детей от 0 до 14 лет 5,4 на 1000 населения соответствующего возраста и 7,0 среди подростков. В структуре эпилепсии и эпилептических синдромов преобладали фокальные — 55,5%; генерализованные — 43%, неклассифицированные формы эпилепсии – 1,5%. Идиопатические эпилепсии зарегистрированы в 21,25%, симптоматические — 32,0%, криптогенные — 46,75 % [13].
В Красноярском крае распространенность эпилепсии составляет – 2,8 случая на 1000 населения: среди детей – 5,1 на 1000, подростков – 6,1 на 1000, а среди взрослых – 2,3 на 1000. Этиологические формы эпилепсии: криптогенная эпилепсия (46,2%), симптоматическая (42,5%), и идиопатическая (7,4%) эпилепсии [15].
По результатам научно-исследовательской работы проведенной в Республике Тыва, которая относится к зоне с высокой распространенностью эпилепсии и эпилептических синдромов у детей и подростков, выявлено, что частота случаев дебюта эпилептических припадков приходилось в основном, на возраст от новорожденности до 5 лет. Средняя стандартизированная распространенность эпилепсии среди детского населения Республики Тыва составила – 3,2 ± 2,9 [95% ДИ: 0,96 – 4,63] на 1000. Среди факторов риска детской эпилепсии наиболее значимыми были: перинатальная патология, отягощенная наследственность, нейроинфекции [17].
Симптомы генерализованной эпилепсии
На основе описанных ранее видов ГЭ можно выделить следующие характерные симптомы:
- судороги различной амплитуды и частоты (от простого моргания до спазма всего тела с последующим подергиванием конечностей, с прикусыванием языка и травмами головы из-за неконтролируемых сокращений мышц шеи);
- абсансы (отключение сознания);
- расстройство сознания и памяти — при простых припадках некоторые больные могут описать свои ощущения во время приступа, в остальных же случаях они не помнят их. Чем чаще возникают приступы, тем быстрее наступит деменция;
- вегетативные проявления — покраснение лица, учащение дыхания и повышение артериального давления;
- возникновение ауры по типу мигренозной, как описано ранее (что более характерно для вторично-генерализованных эпилептических припадков).
Диагностика генерализованной эпилепсии
Юсуповская больница обладает комплексом современного оборудования для полного и глубокого обследования каждого больного, обратившегося к нашим специалистам с неврологическими патологиями. В начале диагностического поиска неврологи больницы тщательно соберут анамнез, чтобы определить причины и характер приступа. Единожды возникший приступ еще не является эпилепсией, но его наличие повышает риск заболевания эпилепсией. На протяжении всей жизни у 11% людей был хотя бы один эпизод, но болеют эпилепсией лишь 2-3%. У пациента уточняют, были ли травмы мозга, инфекции, отравления, судороги или рак. Важно знать, страдали ли эпилепсией или другими неврологическими нарушениями близкие родственники. Врач задает вопросы о случаях появления первых симптомов, описанных выше. Крайне важным методом инструментальной диагностики является электроэнцефалография (ЭЭГ), благодаря которой можно выявить эпилептическую активность. Наиболее частые варианты их отображения:
- острые волны;
- пики (спайки);
- комплексы «пик– медленная волна» и «острая волна– медленная волна».
Высокоамплитудные комплексы «пик– волна» частотой 3 Гц довольно часто регистрируют при абсансах. ЭЭГ делается в межприступный период и, если есть возможность, в момент приступа.
Ценность в диагностике представляет магнитно-резонансная томография (МРТ), благодаря которой можно увидеть очаги поражения головного мозга, вызывающие появление приступа эпилепсии. Это могут быть опухоли, аневризма или участки склероза.
Институт детской неврологии и эпилепсии
Проблемы, связанные с диагностикой и лечением идиопатической генерализованной эпилепсии (ИГЭ) у взрослых, были исследованы у 114 пациентов взрослогo возраста. ИГЭ составила 9,5% от всех форм эпилепсии взрослых. Структура ИГЭ включала следующие формы эпилепсии: юношеская миоклоническая эпилепсия (ЮМЭ) — 42% (п = 48), юношеская абсансная эпилепсия — 12% (п = 14), детская абсансная эпилепсия (ДАЭ) — 8% (п = 9), ИГЭ с неизвестным фенотипом — 38% (п = 43). Поздняя диагностика ИГЭ (максимально 68 лет) отмечена у 1/3 (п = 32) пациентов. Основными причинами поздней диагностики ИГЭ были игнорирование абсансов и миоклонических приступов (п = 21), ошибочная диагностика фокальной эпилепсии (п = 16). Большинство больных исследуемой группы получали лечение карбамазепином. В этом заключалась основная причина неэффективногo лечения и тяжелого течения ИГЭ. Фармакорезистентная эпилепсия диагностирована у 10% больных. 75% больных находились в ремиссии эпилепсии продолжительностью 5-13 лет, но продолжали принимать антиэпилептическую терапию. Отмена лечения предпринята у 46 больных. Наилучшие результаты получены у больных ДАЭ (рецидив приступов у одного из 6 больных). Наименее благоприятные результаты получены у больных ИГЭ с неустановленным фенотипом (рецидив приступов — 60%). Удовлетворительные результаты лечения у взрослых больных ИГЭ (достижение клинической ремиссии) получены в 70% случаев, однако прекращение лечения у этих пациентов остается серьезной проблемой.
Ключевые слова: идиопатическая генерализованная эпилепсия, взрослые, диагностика, лечение.
The study of idiopathic generalised epilepsies (IGЕ) included 114 adult patients. The share of IGЕ cases was 9.5% of аll forms of adult epilepsy. The structure of IGЕ was as follows: juvenile myoclonic epilepsy (JМЕ) — 42% (п= 48), juvenile absence epilepsy (JАЕ) — 12 (п= 14), childhood absence epilepsy (САЕ) — 8% (п= 9), IGE with indefinite phenotype -38% (п= 43). Late diagnosis IGE (тах. — 68 years old) was identified for 1/3 (п= 32) of patients. The main causes of late diagnosis IGE were а failure to recognize absences and myoclonic seizures (п= 21) or missed diagnosis of fосаl epilepsy (п= 16). The main cause of noneffective therapy or severe seizures was therapy bу carbamazepine. Pharmacoresistant epilepsy was diagnosed in 10% of patients. Remission of 5 to 13 years was detected in 75% of patients, though those patients had still bееп taking drugs (AED). The therapy was discontinued for 46 patients and best results were achieved in patients with САЕ (seizures relapse appeared in 1 of 6 patients). The worst results were observed in patients with IGE indefinite phenotype (seizures relapse in 60% of cases). In general, satisfactory results of AED therapy (seizure remission) were achieved in 70% adult patients. However, discontinuation of AED therapy for those patients with IGE remains а problem.
Кеу words: idiopathic generalised epilepsy, adults, diagnostics, treatment.
По мере увеличения возраста в популяции пациентов с эпилепсией уменьшается доля больных идиопатическими генерализованными эпилепсиями (ИГЭ), абсолютное большинство которых характеризуется возрастзависимым дебютом; одновременно возрастает доля лиц, страдающих парциальными симптоматическими и криптогенными формами эпилепсии (СПЭ). Большинство форм ИГЭ отличает благоприятный прогноз и высокая эффективность препаратов вальпроевой кислоты [1, 4, 5, 7, 8]. Именно поэтому соотношение ИГЭ / СПЭ, составляющее в детской популяции больных 40/60, во взрослой популяции изменяется в пользу последних, составляя по различным данным 10-20/80-90, что, возможно, объясняется большей резистентностью парциальных приступов к лечению, т.е. меньшей вероятностью достижения ремиссии [2]. Однако определенный круг проблем, связанных с ИГЭ, часто не решенных своевременно, сохраняется на долгие годы, иногда на всю жизнь.
В соответствие с данными, полученными в процессе работы эпилептологического кабинета КДО МОНИКИ, доля пациентов с ИГЭ от общего числа больных эпилепсией для взрослого населения Московской области составляет 9,5%: всего 114 человек (48 женщин и 66 мужчин) в возрасте от 18 до 68 лет с длительностью заболевания от 1,5 до 60 лет (в среднем -16 лет). Активная эпилепсия наблюдается у 30% (о = 38) из них, остальные пациенты имеют медикаментозную ремиссию разной продолжительности. Соотношение форм ИГЭ выглядит следующим образом: ЮМЭ составляет 42% (о = 48), ДАЭ — 8 (о = 9), юношеская абсансная эпилепсия — 12 (о = 14), ИГЭ с неустановленным (вариабельным) фенотипом — 38% (о = 43). Наиболее часто встречающиеся проблемы в этой когорте пациентов: необычно поздний дебют ИГЭ, неадекватная диагностика формы эпилепсии в детском возрасте, длительная неадекватная терапия, фармакорезистентность приступов, рецидивы заболевания после отмены терапии, дифференциальная диагностика с неэпилептическими состояниями.
Необычно поздняя диагностика детских и ювенильных форм эпилепсии после 20 и даже 30 и более лет отмечена более чем у 30% наблюдавшихся пациентов. У части из них имел место по сути рецидив недиагностированного ранее заболевания после длительной спонтанной ремиссии, продолжавшейся более 5 лет (n = 11).
Клинический пpимep
Больной А., 30 лет. Жалобы на повторяющиеся в течение одного года с частотой 1-2 раза в месяц приступы в виде потери сознания и судорог, возникающие в утренние часы после пробуждения; приступу судорог обычно предшествует вздрагивание рук. В анамнезе короткие редкие эпизоды вздрагивания рук в возрасте 19-20 лет во время службы в армии, которые спонтанно прекратились без лечения. При проведении видео-ЭЭГ мониторинга сна выявлены типичные изменения, характерные для ЮМЭ при засыпании и пробуждении в фоне появляются генерализованные высокоамплитудные вспышки пик- и полипик-волновых комплексов с преобладанием слева продолжительностью от 1,5 до 3 с. Назначенная терапия депакином хроно в дозе 25 мг/кг привела к устойчивой электро-клинической ремиссии, наблюдаемой в течение 1 года. Возможно, в этом и аналогичных наблюдениях длительная клиническая ремиссия не была истинной, поскольку продолжительный период жизни наблюдение за больным не проводилось, в том числе ЭЭГ не регистрировалась. По мнению Panayiotopolus et al. (1991), несмотря на четко разработанные критерии ЮМЭ, процент диагностических ошибок остается высоким вследствие недостаточного внимания со стороны больного и врачей к миоклониям и вариабельности ЭЭГ-паттернов этого заболевания. Неспецифичность изменений ЭЭГ при ЮМЭ во многих случаях и характерное выявление фокальных изменений подчеркивается многими исследователями [1, 2, 5, 8].
Другая часть пациентов с поздно диагностированной ИГЭ (о = 32) — это те случаи, когда активная эпилепсия протекала многие годы и даже десятилетия под маской другой формы заболевания. В частности, нередко типичные генерализованные приступы (абсансы и миоклонические пароксизмы) расценивались и лечились как парциальные. Основной причиной тому было отсутствие в истории болезни пациентов, длительно страдающих ИГЭ, дифференциации на формы эпилепсии и типы приступов, доминирование формулировок «эпилепсия» или «эписиндром», «приступы по типу абсансов». Наиболее игнорируемым как больными, так и врачами типом приступов были миоклонические приступы: миоклонии рук (n = 16) и миоклонии век (n = 5) в рамках ЮМЭ и синдрома Дживонса. Практически все истории заболевания содержали дефекты записи и интерпретации ЭЭГ, либо ЭЭГ-исследование вообще не проводилось, либо записи ЭЭГ были утеряны. У большинства пациентов этой группы лечение осуществлялось препаратами карбамазепина в монотерапии или политерапии, что не только не оправданно, но способно провоцировать приступы при ИГЭ [1, 5, 8]. Все это объясняет неоправданно позднюю диагностику ИГЭ, отсутствие дифференцированного подхода к антиэпилептической терапии, ее неадекватность и, как следствие, длительное персистирование и формирование труднокурабельных приступов.
Клинический пpимep
Больная П., 31 год. Дебют эпилепсии в возрасте 13 лет с генерализованного судорожного приступа (ГСП), развившегося внезапно, после пробуждения. При обращении к врачу был сразу установлен диагноз «эпилепсия» И назначена терапия финлепсином, которая проводилась постоянно до 31 года с периодической коррекцией дозы препарата (максимальная доза составила 600 мг в сутки). Стереотипные ГСП повторялись исключительно после пробуждения с постепенным учащением во времени: от 1 раза в месяц в дебюте заболевания до десятков в месяц, а периодически — до ежедневных приступов к 29 годам, когда пациентка обратилась в КДО МОНИКИ. При осмотре нарушений в психическом, соматическом и неврологическом статусе не отмечено. Представленные ЭЭГ — несколько непродолжительных рутинных записей (не более 5 мин) — типичных паттернов эпилептиформной активности не содержали. Картина МРТ головного мозга соответствовала варианту нормы. При проведении видео-ЭЭГ мониторинга во время ночного сна регистрировалась нормальная фоновая активность в сочетание с единичными короткими генерализованными высокоамплитудными разрядами пик-, даблпик- и полипик-медленная волна, в утренние часы формирующимися в более регулярные и продолжительные вспышки до 1,5 с частотой 3 Гц. На 1-й и 2-й мин. гипервентиляции синхронно со вспышками зарегистрировано 2 эпизода заведения вверх глазных яблок с учащенным морганием (паттерн типичного абсанса с миоклоническим компонентом) (рис. 1) На 20-й мин после пробуждения развился генерализованный судорожный приступ ГСП синхронно с ЭЭГ-паттерном ГСП.
Рис. 1. ЭЭГ больной П., 29 лет. На неизмененном фоне регистрируются периодически возникающие вспышки генерализованной билатерально-синхронной активности пик-медленная волна с частотой 3-3,5 Гц, амплитудой 250-300 мкВ и длительностью 3-5 с — паттерн типичного абсанса.
Таким образом, клиническая картина и характеристики ЭЭГ соответствовали диагнозу ЮАЭ, которая проявлялась ГСП и типичными абсансами; о наличии последних пациентка не знала. На протяжении 16 лет проводилась терапия финлепсином, что привело к формированию тяжелой, труднокурабельной эпилепсии. На фоне терапии, проводимой в течение двух лет (сначала депакин хроно в дозе до 3000 мг/сут в режиме монотерапии, затем депакин хроно 3000 мг/сут в комбинации с топираматом 300 мг/сут) устойчивой ремиссии добиться не удалось. На фоне последней комбинации АЭП (депакин хроно в сочетание с топираматом) сохраняются редкие ГСП, абсансы не наблюдаются.
К категории труднокурабельных или медикаментозно резистентных ИГЭ нами было отнесено 13 (10%) наблюдений (ЮАЭ — 2, ЮМЭ — 3, ИГЭ с неустановленным фенотипом — 8). Как известно, особенностью ИГЭ является высокая чувствительность приступов при всех без исключения формах эпилепсии к препаратам вальпроевой кислоты, при лечении которыми ремиссия достигается в 70-75% и значительное улучшение — в 20% случаев у больных детского и подросткового возраста [1, 3, 4, 5, 6]. Для лечения труднокурабельной эпилепсии при недостаточной клинической эффективности препаратов вальпроевой кислоты, используемых в максимальной дозе, мы применяли комбинированную терапию, включающую вальпроаты и топирамат (в дозе 200-400 мг/сут у 8 пациентов), вальпроаты и леветирацетам (в дозе ~ 3000 мг/сут у 5 пациентов). Первая комбинация позволила эффективно контролировать резистентные миоклонические и герализованные судорожные приступы, вторая — все три типа приступов. Следует отметить, что достижение клинической ремиссии у 7 пациентов обеих групп не коррелировало с электрической ремиссией, что при большинстве форм ИГЭ нередко ассоциируется с неблагоприятным прогнозом и высокой вероятностью рецидива приступов после отмены противоэпилептической терапии [1, 2, 8]. У троих больных отмечено значительное урежение приступов, однако полной ремиссии достигнуть не удалось. Большинство пациентов с ИГЭ (n = 75), обратившихся к эпилептологу, имели длительную клиническую медикаментозную ремиссию (более 5 лет, максимально13 лет), продолжая постоянно принимать назначенную терапию. Попытка отмены лечения была предпринята у большинства из них. Снижение дозы вальпроатов производилось не быстрее 250-300 мг раз в месяц под контролем рутинной записи ЭЭГ. К сожалению, не во всех случаях было возможно проведение видео-ЭЭГ-мониторинга перед отменой терапии. С этим мы связываем рецидив приступов у части пациентов, по-видимому, неимевших электро-клинической ремиссии. Достоверной зависимости между устойчивостью клинической ремиссии после отмены терапии и длительностью медикаментозной ремиссии при различных формах ИГЭ отмечено не было. Наилучшие показатели констатированы у пациентов с ДАЭ. Рецидив ГСП возник у одного из 6 пациентов при снижении дозы вальпроатов на 50% исходной. Из 8 пациентов с ЮАЭ у двух приступы возобновились в первые 6 мес., у одного — через 14 мес. после отмены лечения. У остальных пациентов с установленным диагнозом ЮМЭ и ИГЭ с неопределенным фенотипом в 60% случаев полной отмены АЭП достигнуть не удалось из-за возобновления приступов или появления эпилептиформной активности на ЭЭГ, регистрируемой уже в процессе отмены лечения или в первые месяцы после его завершения. В среднем наилучшие результаты были достигнуты у пациентов, у которых наличие электро-клинической ремиссии было подтверждено при многочасовом мониторировании ЭЭГ. Наш опыт подтверждает, что отмена противоэпилептической терапии у взрослых пациентов с ИГЭ требует более тщательного контроля ЭЭГ с поэтапным проведением ЭЭГ мониторинга как в процессе выбора терапии, так и при принятии решения о прекращении терапии и при постепенной отмене препаратов. Иногда возникала необходимость дифференциальной диагностики ИГЭ с соматическими заболеваниями.
Клинический пpимep
Больная с., 68 лет. Диагноз: детская абсансная эпилепсия. Статусное течение абсансов. Из анамнеза известно, что в возрасте 8-9 лет дебютировали генерализованные судорожные приступы, которые в дальнейшем доминировали в клинической картине заболевания на протяжении всей жизни. Указаний на наличие абсансов в анамнезе не было (возможно, пациентка о них не помнила). Частота приступов во взрослом возрасте была высокой — до 7 и более приступов в месяц. Многие годы пациентка получала лечение дифенином (300 мг/сут) и фенобарбиталом (300 мг/сут). После 60 лет появились побочные эффекты (по мнению больной) антиэпилептической терапии в форме нарушений со стороны желудочно-кишечного тракта, в связи с чем доза принимаемых АЭП была снижена вдвое и к лечению добавлен карбамазепин в дозе 300 мг/сут. Частота ГСП с возрастом постепенно снижалась до 1-2 в год (возможно, приступы возникали чаще, но поскольку больная жила одна, они могли оставаться незамеченными). Однако появились состояния, во время которых пациентка на несколько дней (от 3 до 7) становилась вялой, заторможенной, практически не вставала с постели, не принимала пищу, контакт с ней был затруднен. Состояния были расценены как проявления дисциркуляторной энцефалопатии. Назначаемая сосудистая терапия оказалась неэффективной. Состояния прерывались внезапно, как и развивались. После обращения пациентки к эпилептологу КДО МОНИКИ было проведено электроэнцефалографическое исследование, при котором обнаружена практически непрерывная генерализованная билатерально-синхронная высокоамплитудная пик-волновая активность с частотой 3 Гц — паттерн статуса типичных абсансов (рис. 2). Ремиссия абсансов была достигнута на фоне терапии депакином хроно в дозе 20 мг/кг/сут.
Рис. 2. ЭЭГ больной С., 68 лет. На протяжении всей эпохи записи в фоне регистрируются частые и практически непрерывные (через 3-5 секунд) вспышки генерализованной билатерально-синхронной активности пик-медленная волна счастотой 3-3,5 Гц — паттерн статуса типичных абсансов.
В целом терапия ИГЭ у взрослых пациентов, несмотря на преходящие сложности и недочеты предшествующего лечения, может быть оценена как высокоэффективная. Удовлетворительный контроль приступов достигается в 70% случаев, однако прогноз в отношении перспективы отмены терапии в большинстве случаев остается довольно серьезным.
Библиография
1. Мухин К.Ю., Петрухин А.С Идиопатические генерализованные эпилепсии: систематика, диагностика, терапия. – М.: Арт-Бизнес-Центр, 2000. — С 285-318. 2. Мухин К.Ю., Петрухин А.С., Глухова Л.Ю. Эпилепсия. Атлас электро-клинической диагностики — М.: Альварес Паблишинг, 2004. – С.202-240. 3. Петрухин А.С. Эпилептология детского возраста: руководство для врачей. — М.: Медицина, 2000. – С. 44-62. 4. Janc D. Juvenile myoclonic epilepsy // In: Dаm М., Gram L. (eds). Comprehensive epileptology — New York: Raven Press, 1991. — Р.171-185. 5. Loiseau Р. Childhood absence epilepsy // In: Roger J. et аt (eds) Epileptic syndromes in infancy, childhood and adolescence — London: Libbey, 1992. — Р. 135 -150. 6. Panayiotopolus С.Р., Tahan R., Obeid Т. Juvenile myoclonic epilepsy: Factors of еrror involved in the diagnosis and treatment // Epilepsia — 1991. — Vol. 32. — Р. 672-676. 7. Panayiotopolus С.Р. The epilepsies. Seizures, syndromes and Management. — Blandon Medical Publishing, 2005. - Р.271-349. 8. Thomas Р. Genton Р. Wolf Р. // In: J. Roger et al. (eds) Epileptic sуndrоmеs in infancy, childhood and adolescence — London: Libbey, 2002. — Р. 335-355.
Прогноз генерализованной эпилепсии
Эпилепсия до сих пор является особо важной патологией, в корне меняющей жизнь человека, у которого ее диагностируют. При нашем уровне медицины еще не найден способ излечения от данного заболевания, на больного накладывается ряд ограничений: ему нельзя управлять транспортным средством, следует избегать мест с неожиданными вспышками света. Трудоспособность данных лиц зависит от частоты и времени приступов. Запрещается работа у огня, на высоте, в горящих цехах, у движущихся механизмов, а также деятельность, требующая быстроты реакции и внимания.
Не менее важной является проблема стигматизации. Верная терапия противоэпилептическими препаратами увеличивает межприступный период. Прогноз зависит от формы ГЭ. Идиопатическая наиболее благоприятна, так как не сопровождается психическими нарушениями. Симптоматическая полностью зависит от заболевания, вызвавшего ее. Но при правильно подобранной терапии возможно значительно улучшить качество жизни пациента и свести к минимуму количество припадков.
Юсуповская больница имеет многолетний опыт в лечении данного заболевания, что поможет подобрать индивидуальный подход к каждому пациенту с эпилепсией, чтобы он мог вести нормальный образ жизни даже с таким недугом. Необходимо следовать всем указаниям лечащего врача и не пропускать прием лекарств, чтобы избежать ухудшения состояния.