Краткая история, частота заболевания
Джеймс Паркинсон — врач, который впервые подробно описал симптомы этого тяжёлого заболевания в своём произведении «Эссе о дрожательном параличе». Дрожательным параличом болезнь была названа на основании одного из тяжёлых и типичных для неё симптомов: постоянного тремора конечностей, из-за которого пациенты часто не могут полноценно себя обслуживать.
Доктор Паркинсон описал шесть человек, имевших похожие проявления. Сегодня есть четыре объективных признака, позволяющих правильно поставить диагноз. Из них Паркинсон в эссе точно описал три:
- тремор (дрожание конечностей) в спокойном состоянии;
- гипокинезию (уменьшение двигательной активности и ограничение движений);
- постуральную неустойчивость (постепенная потеря равновесия).
Немного позже знаменитый французский невропатолог и психиатр Жан-Мартен Шарко выделил четвёртый основной критерий диагностики, прибавив к трём имеющимся ригидность (скованность движений в мышцах) и назвав заболевание именем Джеймса Паркинсона.
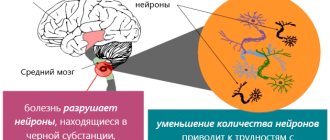
В 1912 году доктор Ф. Леви описал ряд внутриклеточных включений в ЦНС, являющиеся одной из особенностей патологии. В 1919 году российским врачом и исследователем К.Н. Третьяковым было установлено, что главная «цель» (или мишень) всех нейродегенеративных изменений при БП — это средний мозг, в частности, его чёрная субстанция.
60-е годы прошлого столетия стали решающим этапом в поиске методов лечения болезни Паркинсона. Именно тогда появился препарат Леводопа, который специалисты применяют и по сей день.
Заболевание распространено исходя из 100 — 200 зафиксированных клинических случаев на 100 000 человек. Главный критерий заболеваемости — средний или пожилой возраст (молодые люди болеют редко). Среди пациентов от 60 лет и старше уровень заболеваемости иногда достигает от 1 до 2%. Некоторые специалисты полагают, что БП встречается чаще у представителей мужского пола.
Механизмы развития БП
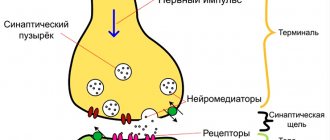
Это синуклеинопатия. При возникновении нейродегенеративных процессов внутри клеток постепенно накапливается альфа-синуклеиновый белок. Он получил название телец Леви. В начале заболевания тельца Леви можно обнаружить только в отделах периферической нервной системы. Они локализуются в сплетениях Мейснера и Ауэрбаха, расположенных в желудочно-кишечном тракте. При дальнейшем прогрессировании патологии тельца Леви «захватывают» ядра мозгового ствола и чёрную субстанцию продолговатого мозга.
Тяжёлые формы болезни Паркинсона характеризуются тем, что тельца Леви нарушают нормальные функции коры мозговых полушарий. При этом можно судить о топическом распространении нейродегенеративных изменений: пока чёрная субстанция не поражена, в клинической картине будут преобладать симптомы немоторного характера. По мере распространения патологии начинают гибнуть нигральные нейроны, что сопровождается появлением моторной симптоматики.
Применение препарата прамипексола с длительным высвобождением на ранней стадии БП
Разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их длительное высвобождение и допускающих однократный прием в течение дня, не просто делает лечение более удобным, но и, улучшая приверженность пациентов лечению, повышает долгосрочную эффективность терапии. Кроме того, при медленном высвобождении препарата в течение суток достигается более стабильная его концентрация в крови, что может обеспечить его лучшую переносимость и эффективный контроль симптомов заболевания в течение всего дня (как в дневное, так и в ночное время).
Новая лекарственная форма прамипексола с длительным (контролируемым) высвобождением, предполагающая однократный прием в течение дня, применяется в европейских странах и США с 2009 года, а в нашей стране – с 2012 года. Она представляет собой матриксную таблетку, в которой активное вещество равномерно распределено в полимерном матриксе. В желудочно-кишечном тракте матрикс впитывает жидкость и превращается в гель, который равномерно высвобождает прамипексол в течение 24 ч. Поскольку прамипексол хорошо растворяется в жидкой среде, независимо от ее pH, активное вещество высвобождается из матрикса и всасывается на протяжении всего кишечника. Скорость опорожнения желудка и моторика кишечника не оказывают существенного влияния на действие препарата. Параметры всасывания не зависят также от того, принимается препарат натощак или после еды [2].
При разработке новой лекарственной формы была учтена возможность простого, одномоментного перехода от традиционной формы препарата к новой. Условием этого является то, что равные суточные дозы препарата с немедленным высвобождением (принимаемым 3 раза в день) и длительным высвобождение (принимаемым 1 раз в день) оказывают одинаковое противопаркинсоническое действие. Различие между новой и традиционной лекарственными формами прамипексола заключается лишь в скорости высвобождения активного вещества. Период полужизни прамипексола при применении обеих форм один и тот же, но благодаря контролируемому высвобождению обеспечивается более длительное поддержание терапевтической концентрации препарата в крови [5].
Эквивалентность действия равных суточных доз препаратов прамипексола с немедленным и длительным высвобождением была подтверждена в целом ряде клинических испытаний.
Следует подчеркнуть особое удобство новой лекарственной формы прамипексола, которую достаточно принимать один раз в день, для пациентов с ранней стадией БП, продолжающих работать. Во избежание побочного действия препарат назначается путем медленного титрования – по той же схеме, что и препарат с немедленным высвобождением. Для этого таблетки прамипексола с длительным высвобождением выпускаются в нескольких дозировках: 0,375, 0,75, 1,5, 3 и 4,5 мг. Лечение начинают с дозы 0,375 мг 1 раз в день, далее при условии хорошей переносимости каждые 7 дней переходят на следующий уровень дозы до достижения оптимального эффекта, максимально до 4,5 мг/сут (таблица 3). После достижения дозы 1,5 мг/сут титрование иногда целесообразно проводить медленнее, так как развитие полного лечебного эффекта может требовать нескольких недель. Рекомендуемая доза для поддерживающей терапии (как на ранней, так и на развернутой или поздней стадиях заболевания) может колебаться от 0,375 до 4,5 мг/сут. Наиболее часто применяемая доза – 3 мг/сут.
Таблица 3. Схема титрования прамипексола с длительным высвобождением.
| Неделя | Доза |
| 1-я | 0,375 мг 1 раз в день |
| 2-я | 0,75 мг 1 раз в день |
| 3-я | 1,5 мг 1 раз в день |
| 4-я | 2,25 мг 1 раз в день |
| 5-я | 3 мг 1 раз в день |
| 6-я | 3,75 мг 1 раз в день |
| 7-я | 4,5 мг 1 раз в день |
Методы консервативной терапии
Двигательные патологии, проявляющиеся при БП, подлежат постоянной медикаментозной терапии. Сейчас не существует лекарственных средств, которые можно было бы использовать в качестве нейропротекторов, поэтом любое лечение приобретает симптоматический характер. Ряд тяжёлых случаев заболевания требуют хирургического вмешательства.
К группам препаратов, применяемых при лечении БП, относят:
- леводопу и её производные;
- АДР (антагонисты дофамина);
- производные амантадина;
- МАО-В;
- антихолинергетики.
Леводопа и её производные и по сей день являются главными препаратами в лечении паркинсонизма, несмотря на ряд побочных явлений. Длительная терапия иногда чревата осложнениями. В ходе клинических и объективных исследований выяснилось, что при использовании монотерапии данными препаратами лечение оказывается более результативным, чем монотерапия антагонистами дофамина.
В широкую практику вошло применение леводопы в комплексе с другими лекарственными средствами против болезни Паркинсона. Такая тактика позволяет постоянно контролировать симптоматику и своевременно вносить в терапию необходимые коррективы.
Леводопа характеризуется максимально коротким периодом полувыведения из организма. По этой причине в начале болезни её всегда назначают три раза в день, осторожно увеличивая дозу по мере прогрессирования болезни. Механизм действия препарата заключается в том, что она восполняет в организме человека дефицит дофамина, возникающий в результате гибели большого количества нигостриарных нервных клеток.
Дофамин — вещество, которое не может самостоятельно миновать ГЭБ. Леводопа в химическом плане является предшественником дофамина. После того, как она попадает в кровь, начинается её постепенное превращение в дофамин. В фармакологической практике этот процесс получил название декарбоксилирования.
Для повышения концентрации леводопы в мозге при её приёме также используют карбидопу или бенсаразид. Поскольку она имеет разные свойства метаболизма, иногда совместный приём с толкапоном или энткапоном увеличивает её биодоступность.
В нашей стране часто применяют такую комбинацию препаратов:
- леводопа;
- энткапон;
- карбидопа.
При этом дозировок леводопы несколько. Известно, что для применения чаще всего используют стандартные лекарственные формы препарата, однако иногда практикуют применение разновидности леводопы, которая не так быстро выводится из организма и действует намного дольше. Такой препарат подходит для больных, имеющих выраженные моторные нарушения.
Кроме леводопы, в терапии болезни Паркинсона используют АДР (или антагонисты дофамина). Они воздействуют на Д-2-дофаминовые рецепторы и используются вместе с леводопой и другими лекарственными средствами. Поскольку заболевание иногда встречается и у пациентов молодого возраста, именно такие схемы лечения являются для них наиболее предпочтительными. К современным лекарствам этой группы относят ряд неэрголиновых агонистов:
- прамипексол;
- ропинирол;
- пирибедил.
Эти лекарства предназначены для внутреннего применения. Есть ещё ротиготин, выпускаемый в форме лейкопластыря. Он хорошо подходит для людей, у которых по тем или иным причинам наблюдается непереносимость пероральных препаратов. В скором времени на фармакологическом рынке появится препарат апоморфин, предназначенный для введения под кожу пациента.
АДР могут иметь ряд нежелательных побочных эффектов в виде тошноты, рвоты, снижения артериального давления, отёчности конечностей. В тяжёлых случаях могут возникнуть психические нарушения, начиная от сильной сонливости днём и заканчивая галлюцинаторными явлениями.
Двигательную симптоматику болезни Паркинсона, вместе с препаратами леводопы, корректируют производными амантадина (сульфатами или хлоридами). Амантадин демонстрирует мягкий лечебный эффект, поэтому его всегда рекомендуется назначать совместно с другими группами препаратов. Его функция состоит в том, что он высвобождает дофамин, которого не хватает организму, и не допускает его обратного захвата. Есть форма амантадина, предназначенная для экстренных случаев: в виде внутривенных инъекций, когда у больного наблюдается сильное обострение с выраженными дисфагическими явлениями.
Бесплатная консультация по вопросам обучения
Наши консультанты всегда готовы рассказать о всех деталях!
Побочных действий у препаратов амантадиновой группы немного. В некоторых случаях могут появиться тошнота, жажда и слабо выраженные отёки конечностей. Имеются и противопоказания к его применению: препарат нельзя назначать пациентам, страдающим деменцией и галлюцинаторным синдромом.
МАО-В, или ингибиторы моноаминоксидазы, повышают концентрацию дофамина в организме. К этим препаратам относят:
- разагилин;
- селегилин.
Их применяют, когда заболевание только начинается и его симптоматика неярко выражена. Если сравнивать действие МАО-В с другими лекарствами, назначаемыми при болезни Паркинсона, их эффект гораздо менее выражен, поэтому прописывать их следует как дополнительные средства. В последнее время чаще всего назначают разагилин, так как он имеет минимум побочных действий.
Из антихолинергетиков пациентам с БП показаны препараты, уменьшающие тремор конечностей и обладающие резистентностью к другим видам терапии. Как правило, врачи используют тригексинифенидил или бипериден. Вещества, содержащихся в них, могут вызвать побочные действия: задержку мочеиспускания, расстройства мышления и восприятия. Из противопоказаний следует отметить глаукому, деменцию и любые психические расстройства, сопровождающиеся галлюцинаторными явлениями.
Диагностика
Диагноз БП проводится в 2 этапа. На первом (синдромальном) этапе синдром паркинсонизма требуется отличить от других состояний, имитирующих его (таблица 1).
Таблица 1. Состояния, требующие дифференциальной диагностики с паркинсонизмом.
| При наличии тремора | В отсутствие тремора |
| Усиленный физиологический тремор Эссенциальный тремор Дистонический тремор Гепатолентикулярная дегенерации | Апатико-абулический синдром Депрессия Лобная дисбазия Плечелопаточная периартропатия Гипотиреоз Шейный остехондроз Деменция с феноменом паратонии (противодержания) Кататония |
Ключевое значение в дифференциальной диагностике имеет выявление признаков гипокинезии. Начальные симптомы гипокинезии могут характеризоваться затруднениями при письме, нажатии кнопок на пульте, чистке зубов, печатании на клавиатуре, доставании мелких предметов, например, монет из сумки или кармана, надевании тапочек и т.д. Иногда уже на ранней стадии проявляется слабость и отставание одной из ног при ходьбе с изменением привычного рисунка походки. Характерно ослабление содружественных движений рук при ходьбе (ахейрокинез), нарушение подзарядки часов («симптом ролекса»). Могут обратить внимание ослабление голоса, замедление, ослабление интонирования или нечеткость речи (особенно при быстром произнесении морфологически сложных слов). При осмотре для выявления гипокинезии пациента просят выполнить определённые движения в течение примерно 20 секунд в максимально быстром темпе и с максимальной амплитудой. При этом врачу следует обращать внимание на замедленную инициацию движения, асимметрию движений, но главное – на особую форму истощаемости движений (декремент), которые по мере повторения все более замедляются, уменьшаются по амплитуде, требуют от пациента все больших усилий. Феномен истощаемости может выявляться при всех оцениваемых движениях, но иногда отмечается только в одном из тестов. Следует учитывать, что замедленность и неловкость движений, характерные для пациентов с паркинсонизмом, на ранней стадии можно спутать с проявлениями пирамидной и мозжечковой недостаточности, а также тяжелой депрессии, однако для этих состояний не характерен декремент движений по мере их повторения. Следует учитывать, что гипокинезию бывает трудно выявить на фоне грубого тремора в конечности, однако и в этом случае важно не пропустить диагностически значимый феномен: при паркинсонизме после выполнения теста на гипокинезию пациент часто держит руку в фиксированной напряженной позе и не способен быстро расслабиться.
Ригидность мышц проявляется устойчивым (в отличие от спастичности) сопротивлением пассивным движениям в лучезапястных, локтевых, плечевых, коленных суставах, а также в шее, а субъективно – скованностью и неприятными болезненными ощущениями в конечностях. У части пациентов при проверке тонуса выявляется феномен «зубчатого колеса». Следует отличать ригидность от феномена противодержания (gegenhalten), характерного для пациентов с деменцией и поражением лобных долей. Противодержание быстро меняется в зависимости от направления и скорости пассивного движения.
Медленный (3–4 Гц) тремор покоя в одной руке или ноге – одно из частых начальных проявлений паркинсонизма. Наличие классического тремора покоя по типу «скатывания пилюль» или «счета монет» наиболее характерно для БП. Для выявления латентного тремора пациента просят совершать движения другой рукой, походить, выполнить задачу на отвлечение (например, отнимать от 100 по 7). Для выявления тремора в ноге нужно осмотреть пациента в положении сидя или лежа. Вместе с тем, в отсутствие гипокинезии тремор покоя не позволяет диагностировать ни паркинсонизм, ни БП. Следует учитывать, что, с одной стороны, в покое может наблюдаться эссенциальный и дистонический тремор, с другой стороны, при БП часто наблюдается постуральный и кинетический тремор.
Начальным проявлением БП, особенно у лиц молодого возраста, может быть дистония стопы, появляющаяся или усиливающаяся при ходьбе, значительно реже – дистония иной локализации.
Ранние немоторные нарушения. Начиная с самой ранней (продромальной) стадии заболевания пациента могут беспокоить эмоциональная угнетенность, повышенная раздражительность, быстрая утомляемость или ощущение постоянной усталости, а также такие вегетативные нарушения, как расстройства потоотделения («дефектный термостат»), например, профузное потоотделение в холодную погоду, а также склонность к запорам, учащенные и/или императивные мочеиспускания, усиленное слюнотечение в ночное время (симптом «мокрой подушки»), эректильная дисфункция. Гипоосмия часто возникает уже на премоторной стадии БП, однако редко привлекает внимание самого пациента, и для ее выявления необходимо формализованное исследование (с помощью специальных методик, например, обонятельного теста Пенсильванского университета – UPSIT). Важное диагностическое значение может иметь выявление признаков синдрома нарушения поведения во сне с быстрыми движениями глаз (тревожные сновидения, вокализации, сноговорение, движения, отражающие содержание сновидений), которые могут опережать другие проявления заболевания на многие годы. Указанные немоторные проявления могут повышать точность диагноза, основывающегося на ранних моторных симптомах болезни.
Дебютными проявлениями БП бывают также хронические болевые синдромы, чаще всего в спине и плечелопаточной области, связанные с повышенным мышечным тонусом, ограничением мобильности и постуральными нарушениями.
Уже на ранней стадии могут выявляться признаки умеренного когнитивного расстройства, в частности неустойчивость внимания и замедленность мышления, трудности поиска слов (феномен «кончика языка»).
«Красные флажки». Второй этап – этап нозологической диагностики – сводится к дифференциальной диагностике БП с другими нозологическими формами паркинсонизма. Он требует клинической оценки анамнестических данных и данных, выявляемых при неврологическом осмотре. Важное значение имеет выяснение лекарственного анамнеза. Такие препараты, как метоклопрамид, вальпроат натрия, циннаризин, амиодарон, могут быть причиной лекарственного паркинсонизма. Отмена препарата, спровоцировавшего развитие паркинсонизма, может не приводить к немедленному регрессу симптомов. Иногда после о препарата и кратковременного улучшения состояние вновь ухудшается, что указывает на скрыто развивающийся дегенеративный процесс, который был «демаскирован» побочным действием лекарственных средств.
При неврологическом осмотре могут выявляться симптомы, атипичные для БП, требующие исключения иных заболеваний, вызывающих синдром паркинсонизма. Среди них можно выделить: симметричность, быстрое прогрессирование симптоматики с ранней утратой способности к передвижению в течние 5 лет, раннее развитие постуральной неустойчивости с падениями, отсутствие стойкого положительного эффекта адекватных доз препаратов леводопы, раннее развитие вегетативной недостаточности, быстрое присоединение деменции (в течении 1-го года), ограничение подвижности глазных яблок (особенно парез взора вниз), раннее развитие тяжелых псевдобульбарных синдромов, аксиальная дистония, пирамидные и мозжечковые знаки, наличие очаговых нарушений корковых функций.
Правила назначения и побочные эффекты препаратов противопаркинсонического действия
Поскольку речь идёт о специфических препаратах и их комбинациях, важно учитывать несколько моментов:
- клиническое течение и степень тяжести симптоматики;
- степень эффективности каждого лекарства при приёме у конкретного пациента;
- наличие или отсутствие побочных действий.
Если болезнь Паркинсона началась в относительно молодом возрасте (до 50-летнего рубежа), первый препарат, который стоит рассматривать для назначения, — это антагонист дофаминовых рецепторов. При позднем развитии заболевания (в возрасте от 70 лет и старше) предпочтение нужно отдавать препаратам леводопы.
Безусловно, леводопу необходимо рассматривать в качестве некого «золотого стандарта», но, к сожалению, она всегда даёт ряд осложнений в виде колебаний её эффекта и расстройств моторики. Вначале больной ощущает, как заканчивается действие препарата, а позже у него появляются феномены «включения-выключения». При появлении моторных флюктуаций у больных могут возникнуть побочные явления со стороны психической, вегетативной и сенсорной сфер. Также следует учитывать и феномен так называемой лекарственной дискинезии, когда у человека наблюдается ряд странных насильственных движений, которые он не может контролировать. Как правило, этот феномен возникает на поздних стадиях болезни и означает пик действия лекарственного препарата.
При тяжёлых осложнениях, связанных с использованием леводопы, рекомендуется прибегать к способам, которые позволяют стимулировать рецепторы дофамина в организме. Речь идёт о введении геля на основе леводопы путём гастростомы. Также допускается подкожное введение апоморфина.
Если приходится прибегать к интрадуоденальному введению препарата, нужно периодически показывать больного хирургу, чтобы избежать типичных осложнений. Введение апоморфина подкожно является более щадящим вариантом терапии, хотя побочные эффекты есть и в данном случае.
Дополнительные методы исследования
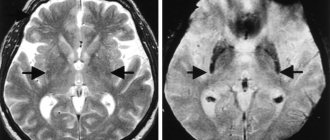
В настоящий момент нет методов лабораторного или инструментального исследования, которые были бы обязательны у каждого пациента с подозрением на БП. В последние годы больным с БП часто проводят КТ или МРТ головного мозга, однако чаще всего в этом нет необходимости, и в большинстве случаев диагноз может быть установлен на основе клинических данных. Тем не менее, если клиническая картина у больного с синдромом паркинсонизма отклоняется от классического варианта, свойственного БП, в частности, отсутствует типичная реакция на дофаминергические средства, – необходимо проведение нейровизуализации.
При начале заболевания до 50 лет важно исключить гепатолентикулярную дегенерацию, о которой могут свидетельствовать роговичное кольцо Кайзера–Флейшера, низкий уровень церулоплазмина, повышение интенсивности сигнала от базальных ганглиев и мозжечка на Т2-взвешенных МРТ изображениях, повышенная экскреция меди с мочой.
Диагностическую значимость может иметь и транскраниальная сонография глубинных структур мозга, выявляющее при БП гиперэхогенные изменения в проекции черной субстанции, связанные с накоплением железа и установленные в 92% случаев клинически вероятной БП, однако его результаты можно интерпретировать лишь в клиническом контексте.
Из практически важных, но пока отсутствующих в нашей стране, методов диагностики следует упомянуть позитронно-эмиссионную томографию (ПЭТ) и однофотонную эмиссионную компьютерную томографию (ОФЭКТ), позволяющие изучить синаптическую передачу на всех уровнях, а также проводить мониторинг патологического процесса. При выявлении снижение накопления F18-флюородопы при ПЭТ и β-CIT при ОФЭКТ в полосатом теле можно говорить о вовлечении в патологический процесс пресинаптических нигростриарных терминалей (первичный паркинсонизм). Определение снижение накопления 11С-раклоприда (лиганд D2рецепторов) при ПЭТ будет указывать на уменьшение количества дофаминовых рецепторов в полосатом теле (паркинсонизм «плюс»).
Хирургическое лечение, применяемое при БП
При лечении БП не исключено и применение нейрохирургических методов. Они являются целесообразными в случаях:
- если используемые лекарственные препараты не дают улучшений;
- если тремор в покое не прекращается даже при приёме сильнодействующих средств;
- если терапия эффективна, но её проведению мешают другие серьёзные заболевания или побочные эффекты лекарств.
При нейрохирургических вмешательствах в случае болезни Паркинсона применяют два способа:
- деструкцию (с проникновением в определённые отделы мозга, в частности — в таламус);
- стимуляцию. В данном случае хирург проводит глубокую стимуляцию мозга пациента, без применения деструкции.
Любую деструктивную операцию при подобных вмешательствах проводят в одностороннем порядке — по причине высокого риска послеоперационных осложнений. Одно из типичных осложнений в данном случае — псевдобульбарный синдром, характеризующийся центральным мышечным параличом. Если такое случается, у больного возникают затруднения в речи, нарушены функции глотания и жевания. Обычно риск возникновения подобных явлений составляет около 30%.
При стимулирующих хирургических вмешательствах в качестве «мишени» выбирают три участка головного мозга:
- два ядра таламуса (субталамическое и вентролатеральное);
- участок «бледного шара».
Стимуляцию вентролатерального ядра проводят, если больной страдает постоянным тремором конечностей и не может себя обслуживать. Внутренний участок «бледного шара» в мозге стимулируют, когда у пациента наблюдается лекарственная дискинезия.
Процесс отбора кандидатов на проведение хирургической операции должен быть тщательным и серьёзным. Одно из главных условий проведения вмешательства — установленный диагноз болезни Паркинсона, длящейся, как минимум, пять лет. Также нужно предварительно понять, насколько эффективным оказалось лечение леводопой, так как эффект от операции, в случае её успешного завершения, будет примерно таким же.
Безусловно, перед проведением оперативного вмешательства необходимо убедиться в том, что пациент не страдает серьёзными нарушениями психики и деменцией.
Риск послеоперационных осложнений обычно невелик, и если больные отобраны правильно, им не стоит отказываться от шанса улучшить своё состояние.
Общие принципы начала лечения
Поскольку на данный момент способность замедлять процесс дегенерации за счет нейропротективного эффекта (возможность защищать интактные клетки от повреждения) или нейрорепаративного эффекта (возможность восстанавливать активность частично поврежденных клеток) ни у одного из применяющихся средств убедительно не доказана, лечение основывается пока на симптоматическом действии. Тем не менее потенциальная возможность нейропротективного эффекта, подтверждаемая экспериментальными или клиническими данными, должна учитываться при назначении лечения.
В настоящее время широкое распространение получила концепция, подчеркивающая важность раннего назначения дофаминергической терапии – немедленно после установления диагноза – с тем, чтобы быстрее скорректировать нейрохимический дисбаланс в мозге и поддержать процессы компенсации.
Если ранее подчеркивалась необходимость возможно более длительного сохранения монотерапии, то в настоящее время преимущества такого подхода не представляются очевидными – по сравнению с ранним переходом к комбинации средств с разным механизмом действия. Вопрос о необходимости монотерапии или комбинированной терапии должен решаться индивидуально. В любом случае при выборе препаратов и их дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. В то же время следует избегать внесения в схему лечения сразу нескольких изменений (например, повышения дозы сразу нескольких средств или добавления сразу нескольких препаратов), это позволяет оценить отдельно эффективность и безопасность каждого из назначаемых средств.