Вопросы, рассмотренные в материале:
- Какие последствия несут разные виды инсультов у пожилых людей
- Какие основные направления реабилитации пожилого человека после инсульта нужно охватить
- Как быстро пожилой человек восстановится после инсульта, и что влияет на этот срок
Восстановление больного преклонного возраста после перенесенного кровоизлияния в мозг зависит от многих факторов. Но главное в период выздоровления — полноценный уход и правильная реабилитация после инсульта у пожилого человека. Иначе исход болезни может обернуться тяжелейшими осложнениями — от отказа двигательных функций до психического расстройства и даже смертельного исхода.
Реабилитация после инсульта у пожилого человека и сроки восстановления
Рекомендуем
«Как общаться с пожилыми родителями, чтобы всем было комфортно» Подробнее
Реабилитация после инсульта у пожилого человека должна быть полноценной, крайне важно приложить все усилия, чтобы больной как можно скорее вернулся к полноценной жизни. Для быстрого восстановления реабилитацию лучше всего пройти в профильных заведениях, где назначат комплексное лечение. Конечно, выздоровление займет немало времени, каждый из случаев болезни индивидуален. Кому-то потребуются годы, а кто-то встанет на ноги уже через несколько месяцев.
Выделяют три этапа реабилитации после инсульта пожилого человека:
- Ранняя реабилитация (полгода).
- Позднее восстановление (от 6 месяцев до года).
- Резидуальная реабилитация (после инсульта прошло не меньше года).
Первые три месяца происходит восстановление сил и функций пострадавшей части тела. Успешность и эффективность реабилитации после инсульта пожилого человека в большей степени зависит от своевременного и грамотного лечения. По мнению медиков, важнейший период выздоровления — первый год.
Первые полгода — благоприятное время для реабилитации речевых и двигательных функций после перенесенного приступа. Многие семьи помещают родственников после кровоизлияния в мозг в специализированные пансионаты. Это объясняется тем, что для эффективного лечения и восстановления больного, человек, ухаживающий за ним, должен обладать хотя бы первичными навыками и базовыми знаниями. Иначе конечный результат может оказаться неудовлетворительным.
В первые несколько дней пациента нужно оградить от любого негатива, создать благоприятный микроклимат. Очень важно разговаривать с пожилым человеком, делиться хорошими новостями.
Период выздоровления занимает длительное время, в течение которого больной проходит комплексное лечение:
Рекомендуем
«Адаптация пожилых людей: в современном обществе и домах-интернатах» Подробнее
1. Прием лекарственных препаратов.
2. Физические нагрузки:
- восстанавливающая гимнастика и физкультура;
- массажные процедуры;
- физиотерапевтические манипуляции (электрофорез, целебные ванны, магнитотерапия).
3. Психологическая поддержка:
- курс занятий у психолога;
- восстановление бытовых и социальных навыков;
- общение с другими людьми.
4. Соблюдение специальной диеты — отказ от жареного, жирного, острого, алкоголя, кофе. Рекомендуется употреблять больше продуктов, богатых полезными витаминами, микроэлементами, стимулирующими работу головного мозга и организма в целом.
5. Восстановление речевого аппарата, логического мышления и памяти:
- курс занятий у логопеда;
- решение задач и головоломок;
- занятия пением и чтением вслух.
6. Реабилитация опорно-двигательной системы:
- гимнастика, занятия на тренажерах;
- посещение бассейна;
- ходьба.
На протяжении всего курса реабилитации с пожилым человеком после инсульта рядом должны находиться родные, их цель — окружить больного любовью и заботой. Для пациента преклонного возраста — это лучшее лекарство, придающее силы и бодрость для скорейшего выздоровления и восстановления утраченных функций.
Рекомендуемые статьи по данной теме:
- Особенности пожилых людей: психологические и физиологические
- Основные проблемы пожилых людей и способы их решения
- Дом-интернат для престарелых людей: особенности и правила выбора
Лечение острого ишемического инсульта
В России инсульт занимает 2-е место в структуре общей смертности населения и является основной причиной стойкой утраты трудоспособности: примерно 20% больных, перенесших инсульт, становятся тяжелыми инвалидами и нуждаются в посторонней помощи. Среди всех видов инсульта преобладают ишемические поражения мозга.
Ишемический инсульт представляет собой гетерогенный клинический синдром. Согласно международным критериям TOAST, выделяют несколько патогенетических вариантов ишемического инсульта: инсульт, связанный с поражением артерий крупного калибра и развивающийся по типу атеротромбоза или артерио-артериальной эмболии; кардиоэмболический инсульт; микрососудистый (лакунарный) инсульт; редкие формы (синдром моя-моя, инсульт на фоне воспаления стенки сосуда (васкулит), расслоения (диссекция) стенки артерий и др.), а также недифференцированные формы. Лечение и вторичная профилактика ишемического инсульта должны проводиться с учетом его патогенетического варианта.
В начале 1990-х гг. было показано, что развитие инфаркта в первые минуты и часы заболевания происходит по быстрым механизмам некротической смерти клеток. Пусковым звеном является энергетический дефицит, который инициирует так называемый глутамат-кальциевый каскад, характеризующийся избыточным высвобождением возбуждающих аминацидергических нейротрансмиттеров — аспартата и глутамата — и чрезмерным внутриклеточным накоплением ионов Са2+ — основного триггера конечных механизмов каскада, приводящих к смерти клетки.
Формирование ядерной зоны («сердцевины» инфаркта) завершается через 5–8 мин с момента острого нарушения мозгового кровообращения. Данная область мозга окружена потенциально жизнеспособной зоной «ишемической полутени» (пенумбра), в которой снижен уровень кровотока, однако в целом сохранен энергетический метаболизм и присутствуют функциональные, но не структурные изменения.
Формирование 50% всего объема инфаркта происходит в течение первых 90 мин с момента развития инсульта, 70–80% — в течение 360 мин, в связи с чем первые 3–6 ч заболевания получили название «терапевтического окна», внутри которого лечебные мероприятия могут быть наиболее эффективными за счет спасения зоны пенумбры.
В то же время процессы, начавшиеся в первые часы заболевания, сохраняют свою значимость и в более поздние сроки, особенно при обширных размерах области ишемического поражения. Они индуцируют и поддерживают другие «отдаленные последствия ишемии»: реакцию генома с включением генетически запрограммированных молекулярных программ, дисфункцию астроцитарного и микроглиального клеточных пулов с развитием иммунных изменений и локального воспаления в очаге ишемии, нарушения микроциркуляции и гематоэнцефалического барьера. Время «доформирования» инфарктных изменений в каждом случае индивидуально и составляет от 3 до 7 сут с момента нарушения мозгового кровообращения.
Поэтому при инсульте очень важно оказание быстрой и патогенетически обоснованной медицинской помощи, желательно в течение первых 2–3 ч с момента его развития.
Современные представления о механизмах развития ишемического инсульта позволили выделить два основных направления патогенетической терапии: улучшение перфузии ткани мозга (ранняя реканализация сосуда и реперфузия) и нейропротективная терапия.
При восстановлении адекватной перфузии ткани головного мозга клинического улучшения у больных можно ожидать даже в случае отсутствия у них при МРТ визуализируемой зоны диффузионно-перфузионного несоответствия.
Проведение терапевтической реперфузии целесообразно в пределах 3–6 ч, затем при ее применении значительно нарастает риск не только реперфузионного повреждения, но и геморрагических осложнений. Таким образом, реперфузия должна быть ранней, по возможности активной и кратковременной.
Характер реперфузионной терапии определяется патогенетическим вариантом развития инсульта. При окклюзии артерий среднего и крупного калибра эффективность терапевтических мероприятий определяется достижением ранней реканализации сосуда. При частичном восстановлении кровотока подобное «драматическое» улучшение наступает почти у половины больных, тогда как у пациентов с отсутствием ранней реканализации пораженного сосуда значимого клинического улучшения в течение первых 24 ч не происходит. Более того, в отдаленном периоде, через 3 мес после перенесенного инсульта, достоверно более полное восстановление нарушенных неврологических функций наблюдается у больных с полной ранней реканализацией окклюзированной артерии и быстрым (в течение первых суток) регрессом очаговых симптомов.
Установлено, что выраженность положительной клинической динамики зависит от скорости лизиса тромба: наилучшее восстановление неврологических функций происходит при быстром (почти мгновенном) лизисе тромба. При этом скорость лизиса тромба варьирует при разных патогенетических вариантах инсульта. Наиболее быстрый и полный лизис происходит при кардиоэмболическом инсульте, что сопровождается достоверным улучшением исхода инсульта и более полным функциональным восстановлением больного. Медленная реканализация чаще наблюдается при атеротромботическом поражении артерии и может не сопровождаться значимым улучшением клинической динамики.
Спонтанная реканализация окклюзированной артерии наблюдается примерно у 10% больных с ишемическим инсультом. Проведение раннего ультразвукового исследования (транскраниальной ультразвуковой допплерографии — аппараты Angiodin 3, Companion III, Sonovit SV-30, Биомед-2, Сономед-500) повышает частоту возможной реканализации до 20%.
При большинстве окклюзий артерий среднего и крупного калибра терапией выбора является тромболизис, обеспечивающий раннюю реканализацию в 30-40% случаев. В настоящее время разработаны пять поколений тромболитиков:
I поколение — системные тромболитики: природные активаторы плазминогена (стрептокиназа, урокиназа);
II поколение — фибриноселективные тромболитики: рекомбинантный тканевый активатор плазминогена (rt-PA, альтеплаза, актилиза), рекомбинантная проурокиназа;
III поколение — усовершенствованные rt-PA и другие активаторы плазминогена: фибринспецифичная форма rt-PA — тенектеплаза, негликозилированная форма rt-PA — ретеплаза, rt-PA с длительным периодом полувыведения — ланотеплаза, ацилированный комплекс «стрептокиназа + плазминоген», обеспечивающий направленную доставку к тромбу, фибринактивированный человеческий плазминоген;
IV поколение — усовершенствованные активаторы плазминогена III поколения (биосинтетические);
V поколение — композиции тромболитиков (rt-PA + +конъюгат «урокиназа-плазминоген» и др.).
Тромболитики I поколения не применяются в клинических условиях из-за системного действия на гемостаз и высокой частоты геморрагических осложнений. Тромболитики III–V поколений проходят испытания пока еще в экспериментальных доклинических работах.
Основную роль в клинической практике играют тромболитики II поколения: rt-PA и рекомбинантная проурокиназа, обладающие малым системным тромболитическим эффектом, действующие преимущественно на свежий тромб и не активирующие факторы свертывания крови V и VII, что существенно снижает риск развития генерализованных геморрагических осложнений.
Рекомбинантный тканевый активатор плазминогена рекомендован к применению в первые 180 мин после развития ишемического инсульта, обусловленного окклюзией артерии среднего и крупного диаметра, при отсутствии геморрагического компонента в очаге ишемии и зоны обширной гиподенсивности на КТ/МРТ головного мозга, превышающей 1/3 области средней мозговой артерии, при значениях системного артериального давления не выше 180/110 мм рт. ст. Следует использовать дозу 0,9 мкг/кг, максимально — 90 мг/сут; 10 % дозы вводится внутривенно струйно, оставшиеся 90% — внутривенно капельно в течение 60 мин.
Применение рекомбинантной проурокиназы сопровождается реканализацией сосуда в 40% случаев, но вызывает геморрагические осложнения у 10,2% больных. Использование препарата целесообразно при ангиографически подтвержденной окклюзии крупной артерии (внутренняя сонная, средняя мозговая, основная). Рекомбинантную проурокиназу применяют интраартериально, в сопровождении низких доз внутривенно вводимого гепарина. Улучшение исхода заболевания регистрируется в течение 3 мес наблюдения, даже при отсроченном на 6 ч от начала острого ишемического инсульта введении препарата. Это свидетельствует о том, что тромболитическая терапия может быть эффективна за пределами «трехчасового диапазона» в случае тщательного отбора пациентов.
Одним из перспективных направлений реканализации является хирургическое удаление тромба — эндоваскулярная экстракция или иссечение. Результаты закончившегося исследования Merci Retriever Study, оценивающего эффективность эндоваскулярной экстракции тромба с помощью технологий Concentric Medical Inc., показали, что быстрая (мгновенная) реканализация окклюзированного сосуда наступает в 48% случаев, а реканализация в течение первых суток — в 81% случаев. Каких-либо осложнений, возникающих в результате манипуляции, не выявлено.
Противопоказаниями к проведению ранней реканализации окклюзированной артерии являются: позднее поступление в стационар (за пределами «терапевтического окна»); отсутствие подтвержденной при транскраниальной допплерографии окклюзии среднего и крупного диаметра (гемодинамический, лакунарный и другие патогенетические варианты инсульта); геморрагический синдром любой локализации и этиологии, наблюдавшийся у больного за последние 3 мес перед инсультом; опухоли, травмы; операции, перенесенные в последние 6 нед до инсульта; резистентная к терапии артериальная гипертензия с артериальным давлением выше 180/110 мм рт. ст.
Теоретические данные позволяли полагать, что антикоагулянты, в частности гепарин, должны быть эффективными при ишемическом инсульте. Однако международные исследования (International Stroke Trial Collaborative Group) показали, что при лечении гепарином больных с ишемическим инсультом высокий риск развития раннего кровоизлияния превышает положительный эффект терапии. Лишь субгрупповой анализ post-hoc доказал целесообразность применения антикоагулянтной терапии гепарином в первые дни прогредиентного атеротромботического инсульта, а также при подтвержденной кардиогенной эмболии и проведении хирургических вмешательств на сосудах мозга. Гепарин назначают в течение первых 3–5 дней заболевания в суточной дозе до 10–15 тыс. ед. под контролем лабораторных показателей, прежде всего АЧТВ (которое не должно увеличиваться более чем в 2 раза). За 1–2 дня до окончания курса лечения гепарином целесообразно постепенное снижение его дозы с назначением антикоагулянтов непрямого действия (аценокумарол, варфарин, этил бискумацетат), прием которых продолжается в последующие 2–3 нед. Наиболее эффективно применение варфарина в дозе 2–5 мг/сут, особенно при длительной предшествующей терапии гепарином, при наличии мерцательной аритмии, после протезирования клапанов сердца или сопутствующем инфаркте миокарда. В случае отсутствия сопутствующей кардиальной патологии возможно назначение фенилина в суточной дозе 0,03–0,06 г. Следует помнить, что лечение антикоагулянтами непрямого действия также необходимо проводить под строгим лабораторным контролем показателей коагулограммы. Биологическая активность гепарина зависит от плазменного ингибитора протеаз — антитромбина-3. Поэтому при дефиците антитромбина-3 больным с нарастающим тромбозом основной или внутренней сонной артерии рекомендуется одновременно с гепарином вводить плазму крови (альбумин, декстран — 100 мл 1–2 раза в день).
Среди негеморрагических осложнений гепаринотерапии следует отметить преходящую тромбоцитопению (у 25% пациентов, причем у 5% — тяжелую), а также парадоксальную тромбоэмболию (Reilly et al., 2001), вследствие вызванной гепарином агрегации тромбоцитов. Тромбоэмболические осложнения, вызванные применением гепарина, лечатся прекращением его введения и назначением непрямых антикоагулянтов.
Таким образом, назначение гепарина в первые дни ишемического инсульта может быть рекомендовано лишь ограниченному контингенту больных. Вместе с тем в настоящее время показано, что, в отличие от обычного гепарина, низкомолекулярные гепарины (НМГ) с молекулярной массой 4000–5000 дальтон (эноксапарин (клексан), фраксипарин, фрагмин, кливарин и др.) обладают преимущественно анти-Ха-факторной активностью, причем ингибируют даже те молекулы фактора Xа, которые успели связаться с поверхностью тромбоцитов. Преимуществами НМГ являются также: меньшее связывание их с эндотелием сосудов и плазменными белками, что ведет к лучшей усвояемости этих препаратов и быстрой их всасываемости из подкожных жировых депо (после подкожного введения «усваивается» 90% НМГ и лишь 15–30% обычного гепарина); более длинный период полувыведения (возможно их подкожное введение 1–2 раза в сутки и более редкий лабораторный контроль); меньшая афиннность к фактору Виллебранда, что способствует уменьшению влияния этих гепаринов на клеточное звено гемостаза (тромбоциты) и значительному уменьшению риска развития «гепариновых тромбоцитопении/тромбоза», а также позволяет лучше прогнозировать антикоагулянтные эффекты даже при использовании высоких доз препаратов. Геморрагические осложнения при использовании НМГ, как правило, более редки и менее выражены, чем при лечении обычным гепарином. Важно, что эти препараты предотвращают риск развития тромбоза глубоких вен и эмболии легочной артерии — одних из наиболее грозных осложнений острого периода инсульта.
Гемодилюция и антиагрегантная терапия, не оказывая радикального реперфузионного действия, несколько улучшают микроциркуляцию в ткани мозга, что служит основанием для традиционного их применения в первые дни ишемического инсульта под контролем гемореологических и сердечно-сосудистых показателей.
Гемодилюцию проводят низкомолекулярными декстранами (реополиглюкин, реомакродекс, лонгастерил, реохем — по 250—500 мл внутривенно капельно). Основным ориентиром эффективности гемодилюции является снижение уровня гематокрита до 30—35%.
Сравнительное сопоставление влияния различных антитромбоцитарных препаратов показало высокую эффективность ацетилсалициловой кислоты (тромбо АСС, аспирин кардио) в дозе 1 мг/кг/сут при отсутствии достаточного антиагрегационного эффекта меньших доз препарата, что связано с недостаточным их влиянием на цАМФ и концентрацию простациклина. Установлена также эффективность пентоксифиллина (трентала, флекситала, пентилина), оказывающего комплексное реологическое действие, направленное не только на уменьшение агрегационной способности тромбоцитов, но и на улучшение деформируемости мембран эритроцитов и нормализацию микроциркуляции в целом. У больных молодого возраста с гиперкинетическим типом кровообращения (выраженная тахикардия, стойкое повышение систолического артериального давления) предпочтителен выбор малых доз β-адреноблокаторов (обзидан, анаприлин, индерал), обладающих антиагрегационными свойствами. У пожилых больных целесообразно назначение ангиопротекторов (ангинин, продектин, пармидин), также оказывающих антитромбоцитарное действие.
Позитивное влияние на состояние церебральной гемодинамики оказывают препараты комплексного сосудисто-метаболического действия, ярким представителем которых является кавинтон (винпоцетин). Анализ 25-летнего опыта применения препарата показал, что кавинтон улучшает мозговой кровоток и микроциркуляцию, оказывая избирательное вазодилатирующее и антивазоконстрикторное действие на церебральные сосуды, ингибируя агрегацию и адгезию форменных элементов крови, нормализуя деформируемость мембран эритроцитов. Наряду с этим препарат способствует улучшению энергетического метаболизма, оптимизируя окислительно-восстановительные процессы, активизируя транспорт кислорода и глюкозы, а также их утилизацию в ткани головного мозга. Кавинтон обладает антиоксидантными и антиэксайтотоксическими свойствами, нормализует ионный градиент клеточных мембран. При ишемическом инсульте в острой фазе эффективно назначение препарата в дозе 10–20 мг/сут внутривенно капельно (в разведении на 500 мл физиологического раствора) в течение 7–10 дней (в некоторых случаях до 21 дня) с дальнейшим переводом больного на прием таблетированных форм препарата: кавинтона форте — по 10 мг 3 раза в сутки в течение 3–4 нед, затем — кавинтона — по 5 мг 3 раза в сутки в течение 1–3 мес.
Проведение активной реперфузионной терапии возможно лишь в стационаре после нейровизуализирующего исследования (КТ/МРТ головного мозга), позволяющего исключить геморрагический компонент поражения, оценить размеры ишемизированной территории и патогенетический вариант инсульта. Это оттеняет преимущества другого направления терапии — нейропротекции (цитопротекции, метаболической защиты мозга), которая может использоваться на догоспитальном этапе при появлении первых симптомов инсульта даже при возможном геморрагическом его характере.
Первичная нейропротекция направлена на прерывание быстрых механизмов некротической смерти клеток — реакций глутамат-кальциевого каскада. Применение этого вида нейропротекции следует начинать с первых минут ишемии и продолжать лечение на протяжении первых 3 дней инсульта, особенно активно в первые 12 ч. Вторичная нейропротекция направлена на уменьшение выраженности «отдаленных последствий ишемии», т. е. на блокаду провоспалительных цитокинов, молекул клеточной адгезии, торможение прооксидантных ферментов, усиление трофического обеспечения, временное торможение апоптоза. Она может быть начата спустя 3–6 ч после развития инсульта и должна продолжаться по меньшей мере 7 дней.
Следствием открытия феномена эксайтотоксичности явилось создание новых терапевтических стратегий — препаратов-антагонистов глутаматных NMDA- и AMPA-рецепторов и ингибиторов пресинаптического высвобождения глутамата. Несмотря на то что у препаратов этих групп в эксперименте были продемонстрированы выраженные нейропротективные эффекты, клинические испытания большинства из них были прекращены из-за широкого спектра серьезных побочных явлений (психических, локомоторных, общих токсических).
В настоящее время продолжаются исследования эффективности ремацемида — низкоаффинного неконкурентного антагониста NMDA-рецепторов, обладающего способностью ингибировать и потенциалзависимые кальциевые каналы. При клинических испытаниях внутривенных и оральных форм ремацемида в дозе до 400 мг каждые 12 ч значимых побочных эффектов не обнаружено.
Еще одним препаратом, блокирующим NMDA-зависимые каналы потенциалзависимым способом, является сульфат магния.
Внимание исследователей привлекает роль тормозного нейротрансмиттера глицина в механизмах острой церебральной ишемии. Была доказана роль глицина как тормозного нейротрансмиттера практически во всех отделах ЦНС. G. E. Fagg и A. C. Foster, F. Mayor и соавт. сделали вывод, что ГАМК и глицин являются равноценными нейротрансмиттерами, обеспечивающими защитное торможение в ЦНС, роль которого возрастает в условиях повышенного выброса глутамата. Ингибирующие свойства глицин проявляет посредством взаимодействия не только с собственными глициновыми рецепторами, но и с рецепторами ГАМК.
Вместе с тем J. W. Johnson и P. Ascher (1987) впервые экспериментально доказали, что глицин в субмикромолекулярных концентрациях необходим для нормального функционирования глутаматных NMDA-рецепторов. Потенцирующее действие глицина на NMDA-рецепторы проявляется в концентрациях ниже 0,1 мкмоль, а концентрации от 10 до 100 мкмоль полностью насыщают глициновый сайт. Введение высоких концентраций глицина (100 мкмоль и 1 млмоль) крысам в условиях недостатка кислорода не вызывало длительной модуляции активности NMDA-рецепторов в гиппокампе и не увеличивало эксайтотоксичность. Интересно, что введение животным высоких доз глицина или некоторых его агонистов (1-амино-1-карбоксициклопропана, являющегося почти полным агонистом, и D-циклосерина, обладающего 40–60% эффективности глицина) оказывает противосудорожное действие, а также усиливает эффекты противоэпилептических средств.
Наряду с нейротрансмиттерным глицин обладает также общеметаболическим действием, связывает низкомолекулярные токсичные продукты, в больших количествах образующиеся в процессе ишемии.
Являясь естественным метаболитом мозга, глицин не проявляет токсичности даже в дозах более 10 г/сут. Единственным побочным эффектом препарата может считаться легкая седация. Применение глицина в дозе 1–2 г/сут в течение 5 дней у пациентов с острым ишемическим инсультом (начиная с 6 ч после развития первых симптомов) позволяет обеспечить противоишемическую защиту мозга у больных с различной локализацией сосудистого поражения и разной тяжестью состояния — достоверно ускоряет регресс неврологической симптоматики (p < 0,01), улучшает функциональное восстановление больных и снижает 30-дневную летальность, по сравнению с группой плацебо. Доказаны достоверное уменьшение объема инфаркта мозга и торможение последующей кистозной трансформации очага на фоне применения глицина, а также ускоренная нормализация электроэнцефалографического паттерна.
Важным направлением вторичной нейропротекции является антиоксидантная терапия. В 1980-х гг. было установлено, что в самом раннем периоде острой фокальной ишемии мозга целесообразно использовать «ловушки» свободных радикалов и препараты, разрушающие перекиси (с сульфидными и тиоловыми группами): 2,3-димеркаптопропансульфонат (унитиол, антаксон, димеркапрол, дикаптол, дитиоглицерин), тиосульфат натрия и др. Вслед за этим было рекомендовано назначение токоферолов и каротиноидов, связывающих катализаторы и инактивирующих синглетный кислород. Однако попытки применения унитиола и токоферола (витамин Е, в том числе в комбинированной форме — аевит) в комплексе интенсивной терапии ишемического инсульта показали незначительность «вклада» этих препаратов в общий результат лечения.
В настоящее время к потенциальным нейропротекторам, используемым при ишемии мозга, относят также ферменты супероксиддисмутазу (СОД) и каталазу, глутатион, лазароиды, хелаты железа, фенил-t-бутил-нитрон. Продолжаются экспериментальные и клинические испытания селективных блокаторов нейрональной NO-синтазы [7-нитроиндазол и 1-(2-флюорометилфенил)-имидазол], которые достоверно уменьшали размер инфарктной зоны после фокальной и глобальной церебральной ишемии у животных. Относительно селективная блокада iNO-синтазы аминогуанидинами также оказала мощное нейропротективное действие в условиях экспериментального инсульта. Аминогуанидины обладают защитными свойствами даже при задержке лечения на 24 ч, что представляет безусловный интерес в плане их возможного клинического применения в терапии ишемического инсульта.
Огромный интерес представляет селеноорганическое соединение эбселен, обладающее глутатионпероксидазоподобной активностью. Эбселен способен подавлять оксидантный стресс и воспалительные реакции, ингибирующе влиять на митохондриальное звено апоптоза, индукция которого связана с высвобождением цитохрома С.
В отличие от многих других селеноорганических соединений эбселен обладает низкой токсичностью.
В ходе проведенных экспериментальных и клинических исследований высокую эффективность показал отечественный препарат мексидол. При внутривенном капельном введении в дозе от 100 до 1000 мг/сут мексидол оказывает выраженный антиоксидантный эффект, повышая активность эндогенной антиоксидантной системы и уменьшая выраженность свободнорадикальных процессов.
Антиоксидантное действие оказывает отечественный препарат эмоксипин — производное 3-гидроксипиридина. Основными эффектами эмоксипина являются торможение перекисного окисления липидов и активация антиоксидантной системы, изменение активности мембранно-связанных ферментов и модификация метаболической, рецепторной и транспортной функций клеточных мембран. Препарат безопасен и хорошо переносится больными.
Важным направлением нейропротективной терапии является применение препаратов с нейротрофическими и нейромодуляторными свойствами.
Очень важную роль игра-ют эндогенные регуляторы функций ЦНС — нейропептиды. Их молекулы, представляющие собой короткие аминокислотные цепи, «нарезаются» из более крупных белковых молекул-предшественников ферментами протеолиза («процессинг») лишь «в нужном месте и в нужное время», в зависимости от потребностей организма. Нейропептиды существуют всего несколько секунд, но длительность их действия может измеряться часами. Каждый из регуляторных пептидов способен индуцировать или ингибировать выход ряда других пептидов. В результате первичные эффекты того или иного пептида могут развиваться во времени в виде цепных и каскадных процессов.
Физиологическая активность нейропептидов во много раз превышает аналогичное действие непептидных соединений. В зависимости от места их высвобождения, нейропептиды могут осуществлять медиаторную функцию (передачу сигнала от одной клетки к другой), модулировать реактивность определенных групп нейронов, стимулировать или тормозить выброс гормонов, регулировать тканевой метаболизм или выполнять функцию эффекторных физиологически активных агентов (вазомоторная, Na+-уретическая и другие виды регуляции). Известно, что нейропептиды способны регулировать активность про- и противовоспалительных цитокинов через модуляцию активности их рецепторов. Многие нейропептиды проявляют выраженные нейротрофические ростовые свойства и легко проникают через гематоэнцефалический барьер.
Одним из наиболее известных препаратов нейротрофического ряда является церебролизин — белковый гидролизат вытяжки из головного мозга свиней, активное действие которого обусловлено фракцией низкомолекулярных пептидов. Препарат оптимизирует энергетический метаболизм мозга и гомеостаз кальция, стимулирует внутриклеточный синтез белка, замедляет процессы глутамат-кальциевого каскада и перекисного окисления липидов. Оптимальная суточная доза при ишемическом инсульте средней тяжести — 10 мл, при тяжелых инсультах — 20 мл внутривенно капельно на протяжении 7–10 дней заболевания (возможно дальнейшее продолжение курса в виде внутримышечных инъекций по 5 мл в день до 21 суток заболевания). В остром периоде каротидного ишемического инсульта более эффективны дозы 30–50 мл по сравнению с 10–20 мл.
По нашим данным, применение церебролизина у больных с ишемическим инсультом в каротидном бассейне в дозе 50 мл/сут внутривенно в значительно большей степени тормозит нарастание зоны инфаркта (к 3-м суткам заболевания), а также нормализует электроэнцефалографический паттерн, по сравнению с дозой 10 мл.
В НИИ молекулярной генетики РАН был создан синтетический аналог фрагмента АКТГ — препарат семакс, представляющий собой гептапептид, лишенный гормональной активности. Семакс — первый российский ноотропный препарат неистощающего типа из группы нейропептидов, имеющий ряд важных преимуществ перед известными аналогами: полное отсутствие токсических и побочных влияний, гормональной активности, увеличение продолжительности действия более чем в 24 раза по сравнению с природным аналогом, возможность интраназального введения с реальным проникновением в мозг.
По результатам рандомизированного двойного слепого плацебо-контролируемого исследования, проведенного в неврологической клинике РГМУ, применение препарата в суточных дозах 12—18 мкг/кг в течение 5 дней приводит к достоверному снижению уровня 30-дневной летальности и улучшению клинического исхода и функционального восстановления больных с ишемическим инсультом исходно разной степени тяжести.
Не остается без внимания применение препаратов, влияющих на энергетический метаболизм и окислительно-восстановительные процессы в нервной ткани. Установлено, что применение антигипоксантов (барбитуратов короткого действия, бензодиазепинов) целесообразно лишь при наиболее тяжелых формах ишемических инсультов.
При ограниченных корковых очагах ишемии, клинически проявляющихся расстройствами высших психических функций (прежде всего речевых) и умеренным двигательным дефицитом, эффективно назначение ноотропных препаратов (производных ГАМК), активирующих энергетический метаболизм и окислительно-восстановительные процессы в мозге. Изучение дозозависимой эффективности пирацетама (ноотропила, луцетама, мемотропила) показало, что оптимальные дозы препарата в первые 10–15 дней ишемического инсульта составляют от 6 до 12 г/сут при внутривенном введении. Для достижения максимального клинического эффекта рекомендуется длительное применение препарата (с 15-го дня — пероральный прием в дозе 4,8 г/сут на протяжении 1–1,5 мес), учитывая отсроченное нейротрансмиттерное действие пирацетама, повышающее пластичность нервной ткани.
Начиная с первых дней заболевания, после формирования морфологических инфарктных изменений в веществе мозга, все большее значение приобретает репаративная терапия, направленная на улучшение пластичности здоровой ткани, окружающей инфаркт, активацию образования полисинаптических связей, увеличение плотности рецепторов. Вторичные нейропротекторы, обладающие трофическими и модуляторными свойствами, а также ноотропы (производные ГАМК), производные холина (глиатилин) усиливают регенераторно-репаративные процессы, способствуя восстановлению нарушенных функций.
Глиатилин (a-глицерилфосфорилхолин) — соединение, содержащее 40% холина и превращающееся в организме в метаболически активную форму фосфорил-холин, способный проникать через гематоэнцефалический барьер и активировать биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов. Пилотные клинические исследования глиатилина в остром периоде ишемического инсульта (внутривенные введения в дозе 1 г 3–4 раза в сутки в течение 5 дней) выявили благоприятное влияние препарата на клиническую динамику, особенно на психическую деятельность больных, память, восстановление речевых функций.
Исследование эффективности отечественного препарата аплегина (карнитина хлорид) в остром периоде каротидного ишемического инсульта показало, что его введение в суточной дозе 7–15 мг/кг на протяжении первых 7–10 дней заболевания существенно улучшает клиническое течение и исход инсульта. Препарат оказывает «пробуждающий» эффект у тяжелобольных, ускоряет регресс очаговых неврологических симптомов и нарушений психических функций.
Важно отметить, что терапия острого ишемического инсульта включает и компоненты его вторичной профилактики. Особенно актуальной вторичная профилактика становится со второй недели заболевания, когда значительно нарастает риск повторных сосудистых эпизодов. К числу наиболее значимых профилактических мероприятий относят контроль артериального давления, глюкозы и липидов крови с коррекцией выявленных изменений. В последние годы доказана значимость использования гипотензивных препаратов из группы ингибиторов АПФ (каптоприл, эналаприл, квинаприл, лизиноприл, моэксиприл, периндоприл, рамиприл, цилазаприл, фозиноприл) не только у больных, страдающих выраженной артериальной гипертензией, но и у лиц с пограничными и даже нормальными значениями артериального давления. Это обусловлено «дополнительными» эффектами ингибиторов АПФ — их нормализующим действием на структуру и функциональное состояние сосудистой стенки артерий разного калибра (от магистральных артерий головы до артериол). Наиболее важным и доказанным направлением вторичной профилактики является длительное (часто пожизненное) применение истинных антиагрегантов: ацетилсалициловой кислоты (в том числе, в сочетании с дипиридамолом (курантил, персантин)), клопидогреля (плавикса), тиклопидина (аклотин, тагрен, тиклид), высоких доз дипиридамола. В то же время у больных, перенесших кардиогенную эмболию на фоне мерцательной аритмии, после протезирования клапанов сердца, после инфаркта миокарда целесообразно назначение антикоагулянта непрямого действия варфарина. У данного контингента больных варфарин вызывает снижение относительного риска повторного инсульта на 36–47% по сравнению с аспирином, при сопоставимой частоте геморрагических осложнений (1,3 и 1,0 %). При выявлении гемодинамически значимых стенозов сонных артерий, а также при наличии в них «эмбологенных» атеросклеротических бляшек необходима консультация сосудистого хирурга для решения вопроса о проведении эндартерэктомии или другого метода хирургической профилактики повторного нарушения мозгового кровообращения. Наличие выраженной дислипидемии, не корригируемой диетой, требует назначения гиполипидемической терапии (статины — ловастатин, симвастин, аторвастатин, правастатин, флувастатин, церивастатин; фибраты — безафибрат, фенофибрат, ципрофибрат).
Таким образом, совершенствование представлений о причинах и механизмах повреждения ткани мозга на фоне острого нарушения мозгового кровообращения определяет основные стратегические направления терапии церебрального инсульта. Результаты клинико-экспериментальных исследований последних лет свидетельствуют о необходимости проведения ранней (в пределах «терапевтического окна») комбинированной патогенетической терапии ишемического инсульта, включающей раннюю реканализацию окклюзированного сосуда и реперфузию ткани головного мозга, комбинированную нейропротекцию, стимуляцию регенераторно-репаративных процессов, а также компоненты вторичной профилактики (предотвращение (ре-)эмболии, вторичного сосудистого и тканевого повреждения).
Внедрение современных подходов к терапии ишемического инсульта в клинике нервных болезней РГМУ (кафедра фундаментальной и клинической неврологии) позволило достичь значительных успехов в лечении больных с ишемическим инсультом: снизить 30-дневную летальность с 32 до 10 % в течение 5 лет и увеличить число больных с хорошим функциональным восстановлением (индекс Бартеля >75; модифицированная шкала Рэнкина — 0–2) до 73,7 % от общего количества выживших больных.
Углубление знаний об ишемическом повреждении мозга и регенерации мозговой ткани позволяет нам все яснее представлять себе бесконечную сложность познания этих процессов. К счастью, работая в клинике, мы имеем возможность не отдаляться от реалий жизни и ежедневно оценивать применение научных гипотез на практике. Это помогает сохранять оптимизм и надежду.
В. И. Скворцова, доктор медицинских наук, профессор, член-корреспондент РАМН РГМУ, Москва
Правила постельного режима после инсульта у пожилого человека
После приступа человека госпитализируют, поэтому важно ознакомиться с таким определением как постельный режим. Совершенно не важно, с какой степенью тяжести инсульта пожилой человек попал в больницу — в первые несколько недель, а порой даже месяцев, крайне важно больше времени лежать и свести до минимума любые телодвижения.
После инсульта ишемического типа, самого распространенного, возможны повреждения одностороннего типа, в частности — паралич. Главное — не поддаваться панике и убедить пострадавшего в том, что при разумном подходе к проблеме и грамотном лечении утерянные функции быстро восстановятся.
Больничный режим и реабилитация после инсульта у пожилого человека подразумевает соблюдение важных правил:
- Ни в коем случае нельзя, чтобы пациент долгое время находился в одном положении, это опасно появлением пролежней, что сильно затруднит реабилитацию.
- Переворачивать больного необходимо регулярно, специалисты рекомендуют это делать примерно раз в два–три часа.
- Для восстановления моторики и полноценного выздоровления важно делать лечебную гимнастику.
- Необходимо сохранять правильное положение тела.
Учтите, что пожилой пациент долгое время будет проводить в лежачем положении на спине. Поэтому важно обеспечить ему комфортные условия для суставов плеча, таким образом, чтобы их подвижность была сохранена. Иначе в скором времени мягкие ткани и суставы начнут затекать, и пожилой человек будет испытывать боль в этих областях.
В лежачем положении пострадавшая рука должна находиться на возвышенном уровне. Лучше всего для этого использовать подушку или валик. Достичь максимального эффекта можно, подложив небольшой соляной мешочек весом до 500 грамм. Видимый результат от вышеописанных манипуляций должен быть следующим:
- Рука пожилого пациента не сгибается в локте.
- Пальцы выровненные — это особенно важно.
- Расстояние между туловищем и плечом должно быть одинаковым и неизменным.
Обратите внимание на правила положения ног во время первичной реабилитации после инсульта у пожилого человека:
- Под ноги пожилого пациента нужно положить специальный валик. Так вы добьетесь желаемого угла подъема в 15–20 градусов, необходимого для правильного кровоснабжения.
- Существуют еще специальные подставки для стоп. При использовании такого приспособления нужно проверить, что оно находится в нейтральном положении.
Важное примечание: для правильного положения больного обе ноги — и пострадавшая, и здоровая — должны лежать одинаково.
Соблюдать указанные правила жизненно необходимо для правильной реабилитации после инсульта пожилого человека.
Если пациент лежит на боку, нужно выполнять другие рекомендации. Из-за того, что после кровоизлияния парализуется только одна сторона, пострадавший должен лежать в двух положениях — на здоровом боку и на больном.
Если пожилой пациент лежит на здоровом боку, подложите под конечности опору, а под больную сторону — подушку. Неработающие суставы предварительно согните.
Если пожилой пациент лежит на парализованной стороне, нужно наклонить его голову вниз, но не сильно. Парализованную руку необходимо выпрямить, а ладонь уложить на туловище. Пострадавшая рука при таком положении должна быть согнута под прямым углом, а здоровая отведена назад.
Рекомендуем
«Обследование пожилого человека — каким врачам нужно показываться регулярно» Подробнее
Признаки и симптомы инсульта у мужчин
Первые признаки инсульта у мужчин проявляются уже в течение 3-х часов с момента возникновения очага поражения. Резко появляется слабость, становится трудно глотать, сбивается дыхание и усиливается тахикардия, головная боль доводит до обморочного состояния, ощущается сильное головокружение, возможно появление судорог и рвоты. Человека необходимо срочно госпитализировать. Если в этот момент быстро будет оказана первая помощь пострадавшему, то во-первых многие признаки инсульта начнут отступать, а во-вторых снижается вероятность возникновения тяжелых осложнений в будущем.
Реабилитация речи после инсульта у пожилого человека
После перенесенного приступа пожилой пациент может потерять прежнюю способность разговаривать. Это большой удар по психическому здоровью любого из нас, а тем более — для человека преклонного возраста. Если такие проблемы все-таки вас коснулись, их необходимо как можно скорее устранить.
Реабилитация после инсульта на этой фазе требует особенных действий. Патологии речи (афазии) разделяют на несколько типов:
- Расстройство речи моторного типа.
Пожилой человек слышит и хорошо понимает речь окружающих, но из-за сильных повреждений речевых центров самостоятельно выразить словами свои мысли он не может.
- Расстройство речи сенсорного типа.
Серьезная патология, возникающая из-за поражения центра Вернике. Пожилой человек слышит и повторяет слова, но не понимает их значения.
Реабилитация речевых функций должна быть быстрой и грамотной, из-за невозможности выражать свои мысли у пожилого человека страдает психика, ухудшается моральное состояние. Важно, что первыми проявлять инициативу в общении должны родственники или медицинские работники.
Для лучшего эффекта от реабилитации речевых навыков ухаживающему персоналу или близким людям необходимо соблюдать главные правила:
- Нельзя оставлять пожилого пациента одного и изолировать от людей, общение должно быть постоянным.
- Если больной не может закончить фразу или слово из-за полученных повреждений речевого центра, нельзя помогать и договаривать за него. При этом вы должны сосредоточить все свое внимание на том, что он говорит.
- В особо тяжелых случаях рекомендуют учиться выражать мысли жестами или другими коммуникационными способами.
- Нужно вместе с больным выполнять упражнения для мышц языка.
- Для реабилитации после инсульта пожилого человека очень важно найти постоянный контакт с пациентом, поддерживать диалог на любую тему, интересующую его.
Идеально, если вы обратитесь за профессиональной помощью к врачу логопеду-афазиологу. Вся реабилитация должна проходить под его руководством.
Лечение инсульта в пожилом возрасте
Наиболее эффективной терапией для пациентов пожилого возраста является тромболитическая. Однако западные клиники часто воздерживаются от этого метода, так как считают, что тромболиз способен вызвать субарахноидальное кровоизлияние. Также очень сложно наблюдать эффект от лечения при проведении этого мероприятия. Лучшие результаты лечения дали эндоваскулярные методы и внутриартериальный тромболиз. Эти методы лечения значительно уменьшают негативные последствия. Хороший результат дают применение препаратов антиагрегантов. Так, благодаря приему аспирина в первые часы наступления инсульта значительно снижается вероятность последующего развития пароксизмов. Гипотензивная терапия проводится как основная мера, так и во время вторичной профилактики. Чем раньше будет проведены мероприятия восстановлению после инсульта и физиологических функций, тем легче пожилому пациенту перенести негативные последствия и осложнения.
Клинический институт мозга Рейтинг: 5/5 — 2 голосов
Поделиться статьей в социальных сетях
Восстановление двигательных функций
Рекомендуем
«Частный дом-интернат для пожилых людей: критерии выбора и процедура оформления» Подробнее
Где бы ни проходила реабилитация после инсульта у пожилого человека — в домашних условиях или в пансионате — приоритетом должно быть восстановление всех потерянных функций. Иногда бывает, что полноценная регенерация может не наступить. По этой причине восстановительный период двигательных функций можно разделить на две группы:
- Полноценный — реабилитация всех потерянных способностей организма полностью.
- Компенсирование утраченных способностей в случае, если полное восстановление невозможно. Больной пожилой человек должен получить хотя бы необходимый минимум бытовых навыков.
Даже если полная реабилитация не поможет восполнить потерянные умения, нужно выполнять полный список рекомендаций, упражнений и пройти комплексное лечение. Отказываться от полноценного восстановления нельзя ни в коем случае.
Процесс реабилитации в этот период должен состоять из нескольких этапов. В первые дни и недели будет достаточно выполнять несложные упражнения без чрезмерной физической активности. Позже пожилой пациент будет стараться выполнять поставленные задачи самостоятельно. Ухаживающий должен оказывать помощь больному только в трудных случаях.
После этого этапа начинается реабилитация двигательных функций. Первое — имитация шагов, без подъема с кровати. Далее нужно помочь пожилому человеку встать и некоторое время просто стоять на одном месте. В качестве опоры можно использовать подручные предметы: стулья, спинку кровати. Начать снова ходить после приступа человек должен сам, с небольшой помощью ухаживающего.
Самая трудная задача — восстановить двигательные способности рук. Это связано с тем, что многие поврежденные клетки мозга отвечают именно за эту функцию. Но как бы там ни было, эта временно утраченная способность все-таки может быть восстановлена, если заняться проблемой как можно скорее. Важно отдавать себе отчет, что процесс реабилитации после инсульта пожилого человека — долгая и трудоемкая задача, но эффективная.
Можно на несколько часов зафиксировать здоровую руку так, чтобы пожилой пациент старался обслуживать себя только больной рукой. Например, держал ложку, печатал на компьютере, умывался.
Питание и восстановление глотания
Рекомендуем
«Центры для пенсионеров: какие бывают и как туда попасть» Подробнее
Иногда вследствие перенесенного приступа люди могут ощущать вкус и количество пищи только в одной половине ротовой полости. Пожилому пациенту придется заново учиться жевать и глотать. Существует специальный комплекс упражнений по восстановлению рефлекса глотания:
- Имитация глотательных движений.
- Имитация зевания, при этом важно как можно шире открывать рот.
- Полоскание горла обычной водой.
- Имитация кашля.
- Надувание щек и задержки дыхания в таком положении на несколько секунд.
- Проговаривание звука «и» и постукивания по гортани в это время.
Обслуживающий персонал и близкие люди больного во время реабилитации после инсульта должны соблюдать базовые требования в области питания. Повреждения после болезни могут отразиться и на способности организма принимать и переваривать пищу. Поэтому важно обеспечить пострадавшего правильным питанием и кормить его самостоятельно. Сам пожилой пациент не сможет даже донести еду до рта, а иногда это может быть очень опасно.
Подавать пищу можно только с рабочей стороны, ее консистенция обязательно должна быть мягкой!
Следите за тем, чтобы пожилой человек успевал прожевывать и проглатывать порцию, прежде чем давать ему другую.
Проверяйте температуру еды, не давайте слишком горячую или холодную пищу, это может привести к спазмам и судорогам пищевода.
Главное в питании пожилого человека, перенесшего инсульт, — соблюдать диету, принципы которой заключаются в исключении из рациона или употреблении очень малого количества животного жира и соли.
Частичный отказ от животных жиров способствует понижению холестерина в крови, а это поможет избежать повторного приступа. Снижение количества употребления соли нормализирует артериальное давление. Когда оно в норме, восстановление функций организма после перенесенного кровоизлияния проходит эффективнее и быстрее, и предупреждается дальнейшее повреждение нейронов мозга. Еще одним важным эффектом при правильном питании является снижение веса.
Рекомендуем
«Комплекс упражнений для пожилых людей: тело и дыхание» Подробнее
Другие способы реабилитации после инсульта у пожилого человека
1. Реабилитация с помощью лекарств.
Этот вид восстановления основан на применении различных манипуляций, уколов, которые регенерируют утраченные возможности головного мозга человека. Лекарства, назначаемые после кровоизлияния, работают на улучшение движения крови по сосудам мозга (ноотропные препараты). Еще они положительно влияют на обмен веществ в мозговых нейронах и на аналитико-синтетическую работу коры больших полушарий.
2. Массаж.
Массажа для реабилитации после инсульта пожилого человека состоит из нескольких этапов: пациента укладывают на спину, парализованную руку отводят в сторону и фиксируют на уровне плечевого сустава. Важно, чтобы кисть и предплечье были разогнуты. Далее тщательно массируют все места сгибов, суставы пальцев, кисти, локтя. Движения должны быть медленными и аккуратными, без провоцирования болевых ощущений и тонуса.
Поврежденную ногу нужно массажировать таким же способом, как и руку. Под колено необходимо положить подушку или валик из полотенца.
3. Специальные тренажеры.
К счастью, в современных магазинах можно найти любые вспомогательные тренажеры для восстановления двигательных навыков. Они помогают реабилитировать пожилого человека дома или в пансионате, даже если он не в состоянии встать с кровати. Принцип работы таких устройств следующий — тренировка поврежденных или парализованных конечностей, в которых отсутствует чувствительность. С помощью специальных приспособлений можно разработать суставы, активировать работу нервных окончаний и вернуть организм к прежнему здоровому состоянию.
Видимый эффект реабилитации после инсульта пожилого человека дают такие тренажеры как:
- тренажер для шагов;
- брусья для подтягивания на руках (для работы мышц и суставов рук и предплечий);
- горка для подъемов и ходьбы;
- брусья для хождения с утяжелением.
Только врач определяет комплекс необходимых упражнений, их продолжительность и интенсивность.
4. Лечебная физкультура (ЛФК).
На сегодняшний день существует множество различных методик по реабилитации после инсульта пожилого человека. Самой эффективной из них признана ЛФК.
Комплекс упражнений, необходимых пожилому пациенту, подбирается индивидуально. Среди них могут быть:
1. Упражнения пассивного характера. Их выполнение должно проходить с помощью медицинского работника или обученного близкого человека:
- массажные процедуры;
- сгибание суставов ног и рук;
- поднятие и опускание конечностей;
- сжатие кулака.
2. Упражнения на стуле — подходят для больных, умеющих сидеть:
- вращения и наклоны головы;
- имитация хватательной функции — сжатие и разжимание кулака;
- специальная дыхательная гимнастика со сведением и разведением лопаток.
3. Упражнения в положении стоя:
- руки поднимаются вверх на вдохе и опускаются вниз на выдохе;
- игра с задействованием мяча для тенниса, руки вытянуты вперед, пальцы сомкнуты.
- поочередное поднятие и опускание ног на сиденье стула;
- вставание на носочки.
Рекомендуем
«Гимнастика для пожилых людей: лучшие упражнения при различных заболеваниях» Подробнее
Факторы риска
Среди факторов риска инсульта лидирующие позиции занимают сердечно-сосудистые заболевания:
- атеросклероз;
- нарушения ритма;
- артериальная гипертензия;
К более редким причинам относятся:
- заболевания крови (полицитемия, эссенциальный тромбоцитоз, серповидноклеточная анемия, коагулопатии);
- поражения сосудов (васкулиты, ангиопатии, интоксикации);
- мальформации и аневризмы сосудов головного мозга;
Ишемическому инсульту могут предшествовать преходящие нарушения мозгового кровообращения (ПНМК). ПНМК это вид ОНМК, при котором также появляются очаговые неврологические расстройства, но они полностью проходят в течение 24 часов.
Геморрагическому инсульту часто предшествует серия гипертонических кризов, один из которых может закончиться кровоизлиянием. Гипертонический криз может спровоцировать разрыв имеющейся аневризмы.
Профилактика повторного инсульта
Для предупреждения инсульта и повторного удара нужно соблюдать следующие рекомендации по профилактике:
- Уделять внимание артериальному давлению, его высокие показатели часто становятся причиной кровоизлияния в мозг.
- Если вы страдаете гипертонией, проконсультируйтесь с врачом и подберите подходящий лекарственный препарат. Для лучшего эффекта нормализации давления можно совместить прием таблеток с умеренными нагрузками.
- Проводить больше времени на свежем воздухе, чаще ходить пешком не торопясь.
- Отказаться от вредных привычек, они — главная причина возникновения приступа.
- Следить за весом. Лишние килограммы увеличивают риск инсульта.
- Стараться находить положительные моменты, причины для смеха, радоваться, заниматься любимыми делами.
Признаки инсульта
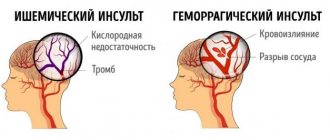
Проявления геморрагического и ишемического инсультов различаются. При ишемическом инсульте преобладают очаговые проявления — признаки утраты функций поврежденных участков мозга.
Часто встречающиеся очаговые проявления:
- нарушения речи;
- отсутствие понимания обращенной речи;
- парезы (слабость в конечностях, до полного отсутствия движений в них);
- выпадения полей зрения — человек не видит перед собой правую или левую половину;
- асимметрия нижней половины лица — “кривая” улыбка;
- снижение чувствительности на правой или левой половине тела, лица.
Обычно общее состояние стабильное, часто отсутствуют головные боли, нарушения сознания редки. Повышение АД (артериального давления) чаще умеренное. Ишемический инсульт чаще развивается в покое.
При геморрагическом инсульте на первый план выходят общемозговые проявления:
Ознакомьтесь с нашими пансионатами с помощью короткого видео:
- резкая, сильная головная боль;
- тошнота и рвота;
- нарушения сознания вплоть до комы.
АД часто повышено. Геморрагический инсульт часто развивается в период активной деятельности, волнения.