Диэнцефальный синдром (гипоталамический) — это комплекс расстройств эндокринного, обменного, вегетативного типа.
Во время этих нарушений наблюдается поражение гипоталамической области промежуточного мозга. В большинстве случаев эти расстройства происходят из-за дисфункции гипоталамуса.
Для диэнцефального синдрома характерно:
- изменение массы тела, в большинстве случаев она увеличивается;
- появление головных болей;
- проблемы с настроением, частые перемены;
- появление состояния гипертензии;
- проблемы с менструальным циклом;
- повышение аппетита;
- возникновение ощущения повышенной жажды;
- иногда повышается и понижается половое влечение.
Данное нарушение часто возникает в эндокринологической, гинекологической, невралгической практике, при этом во время диагностирования возникают сложности, которые связанны с многообразием симптоматики и разновидностей синдрома.
Диэнцефальный синдром в большинстве случаев проявляется у подростков в возрасте от 13 до 15 лет, а также во время репродуктивного возраста от 31 до 40 лет. В репродуктивном возрасте он в основном преобладает у женщин – от 12,5 % до 17,5 %.
Заболевание приводит к серьезным расстройствам репродуктивного здоровья многих женщин. Наблюдается развитие эндокринного бесплодия, появление поликистоза яичников, а также различные патологии акушерского и перинатального характера.
Причины и провоцирующие факторы
Нарушения в функционировании гипоталамуса могут возникнуть из-за целого ряда причин и факторов:
- наличие опухолей в головном мозгу, которые приводят к сдавливанию гипоталамической области;
- травматические повреждения черепно-мозгового характера, во время которых возникает прямое повреждение гипоталамуса;
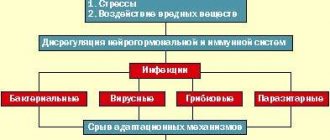
- состояние нейроинтоксикации – токсикомания, наркомания, алкоголизм, вред от производственной деятельности, влияние экологических вредных компонентов;
- различные нарушения с сосудистым характером – инсульт, остеохондроз;
- нейроинфекции вирусного и бактериального типа – грипп, малярия, тонзиллит в хронической форме;
- факторы с психогенным характером – проявление стрессовых и шоковых ситуаций, чрезмерных умственных нагрузок;
- период беременности и гормональные перестройки, которые связаны с этим периодом;
- болезни хронического типа, которые проявляются совместно с элементами вегетативного типа – бронхиальная астма, состояние гипертонии, язвенные поражения желудка и двенадцатиперстной кишки, состояние ожирения.
Лечение
Лечение, как диэнцефального криза, так и самого синдрома зависит от выявленных причин:
- если причина заболевания находится в нейроинфекции, то проводят терапию по излечению данной инфекции;
- если причина в опухоли, то производится операция, по удалению данной опухоли;
- при данном заболевании пациенту назначается специальная диета.
Что касается лечения лекарственными средствами, то оно направлено на восстановление нормального цикла менструации, когда это касается женщины, а также на приведение в норму обмена веществ.
Если пациент вовремя обращается к врачам, то вероятность полного излечения очень высока.
Классификация и клиническая картина
Насчитывается большое число исследовательских программ по изучению диэнцефального синдрома, согласно которым была создана классификация расстройства.
Дисфункция диэнцефальных структур бывает нескольких типов, у каждого из которых свои симптомы и проявления:
- Диэнцефальный синдром с гипоталамической (диэнцефальной) эпилепсией.
- Расстройство вегетативно-висцерально-сосудистого характера. Наблюдаются нарушения в сердечно-сосудистой и дыхательной системе.
- Расстройство терморегуляции. Возникает повышение температуры тела от субфебрильной до фебрильной. При данной форме появляется состояние озноба, мышечной дрожжи, иногда может появиться гипотермия.
- Нарушения нервно-мышечного типа. Эта форма сопровождается повышенной слабостью в виде физической астении.
- Нарушения нервно-трофического характера. Это нарушение характеризуется проявлением повышенных отеков на фоне общей слабости, жажды, головных болей, ознобоподобного тремора и гипотермии.
- Нейроэндокринная форма. Данное нарушение проявляется в виде возникновения гипо- и гиперфункции гипофиза и других желез внутренней секреции.
- Нервно-психические расстройства. Наблюдаются вегетативно-сосудистые, нейроэндокринные, обменно-трофические нарушения.
- Нейроэндокринно-обменные расстройства. Это эндокринные нарушения, при которых возникает ожирение, раннее половое созревание, головные боли, появляется быстрая физическая и умственная утомляемость, нарушение менструального цикла и другие сбои.
Диэнцефальная эпилепсия
Диэнцефальная эпилепсия – это своеобразные вегетативные пароксизмы, схожие с приступами обычной эпилепсии, но причиной которых служат нарушения в работе гипоталамуса. Они могут проявляться от нескольких часов до суток.
Данная форма синдрома совмещает в себе следующие симптомы:
- за сутки до наступления приступа у человека может поменяться настроение;
- возникновение повышенного чувства голода;
- ощущение жажды;
- проявление беспричинного страха;
- примерно через два часа может появиться ощущение озноба;
- повышение температуры тела;
- проявление сильного потоотделения;
- может поменяться окраска кожи;
- возникновение частого мочеиспускания и дефекации.
Приступы обычно возникают совместно с судорогами, обмороками.
NSICU.RU neurosurgical intensive care unit сайт отделения реанимации НИИ им Н.Н. Бурденко
НИИ Нейрохирургии им Н.Н. Бурденко, РАМН, Москва
Введение
Диэнцефальные структуры (ДС) включает в себя таламус, гипоталамус, эпиталамус, субталамус и гипофиз [1]. Таламус, располагаясь ниже боковых желудочков, представляет собою скопление ядер, имеет овальную форму, образует боковую стенку III желудочка и занимает 4/5 пространства диэнцефальной области. Основной функцией таламуса является первичный анализ и передача информации коре мозга от всех органов чувств за исключением обонятельного анализатора. Гипоталамус – это комплекс ядер, которые формируют дно и боковые стенки III желудочка.
Выделяют паравентрикулярное, супраоптическое, преоптическое, супрахиазматическое, вентромедиальное, аркуатное, маммиллярное, заднее и другие ядра. Ядра гипоталамуса имеют обширные интракраниальные связи. В гипоталамусе синтезируются пептиды – либерины и статины. Гипоталамус является высшим центром эндокринной регуляции, обеспечивает постоянство внутренней среды организма, регулирует функционирование органов и систем организма, координирует работу нервной, эндокринной и иммунной систем. Эпиталамус — шишковидное тело, поводок, его ядра и спайки, задняя комиссура — образуют крышу III желудочка, к которой прилежит сосудистое сплетение.
В шишковидном теле синтезируется мелатонин. Эпиталамус регулирует цикл сон-бодрствование, принимает участие в регуляции эмоций и работы автономной нервной системы. Субталамус включает в себя субталамическое ядро, ростральные отделы красного ядра и черной субстанции, располагается между таламусом и покрышкой среднего мозга и участвует в экстрапирамидной регуляции движений. Гипофиз расположен в турецком седле клиновидной кости и имеет две доли – переднюю (аденогипофиз) и заднюю (нейрогипофиз). Нейрогипофиз соединен с гипоталамусом ножкой гипофиза, которая представляет собою аксоны нейронов ядер гипоталамуса и эпиталамуса и по которой транспортируется вазопрессин, окситоцин и мелатонин. В передней доле гипофиза синтезируются тропные гормоны (адренокортикотропный, тиреотропный, гонадотропный, соматотропный гормоны и пролактин), выделение которых регулируется гипоталамическими пептидами. Либерины и статины поступают в аденогипофиз из гипоталамуса по разветвленной системе артериол, капилляров и венул. Эндокринная регуляция является основной функцией гипофиза.
Описаны синдромы, развивающиеся вследствие повреждения ДС: диэнцефальная дистермия (гипертермия, гипотермия, пойкилотермия), гипоталамическое ожирение, диэнцефальный синдром детей, гипоталамическая кахексия взрослых, анорексия, булимия, диэнцефальная глюкозурия, акромегалия, болезнь Кушинга, гипоталамический гипогонадизм, гипофизарный нанизм, гигантизм, синдром Прадера-Вилли и другие [2,3]. У нейрореанимационных пациентов с черепно-мозговой травмой признаки повреждения ДС выявляются в 15-33% наблюдений [4 – 6]. Спектр клинических проявлений, которые эти авторы считают последствием повреждения ДС, у пациентов с черепно-мозговой травмой широк и включает в себя нарушение сознания, расширение зрачков, повышение внутричерепного давления, артериальную гипертензию, тахикардию, брадикардию или другие нарушения сердечного ритма, лихорадку, повышение мышечного тонуса, опистотонус, гипергидроз, тахипноэ. Учитывая механизмы повреждения мозга при черепно-мозговой травме, сложно говорить об изолированном повреждении ДС у этой категории пациентов. Ряд вышеперечисленных симптомов является следствием первичного повреждения стволовых и подкорковых структур или дислокации ствола мозга.
У пациентов с опухолями хиазмально-селлярной области (ХСО) и осложненным течением послеоперационного периода критическое состояние обусловлено изолированным повреждением ДС. При этом формируется характерный синдром — синдром диэнцефальной дисфункции (СДД).
Цель исследования
Описание СДД у реанимационных пациентов. В связи с поставленной целью было необходимо решить следующие задачи: определить структуру СДД; определить варианты СДД; провести корреляцию между вариантом СДД и исходом заболевания.
Материалы и методы исследования
В исследование вошли пациенты, оперировавшиеся в Институте в период с 2006 года по 2009 год, включительно. Критериями включения были: Возраст старше 18 лет; опухоль ХСО; осложненное течение раннего (7 суток) послеоперационного периода; пребывание пациента в отделении реанимации более 48 часов. Критериями исключения были: пребывание пациента в отделении реанимации менее 48 часов; интракраниальные осложнения, не связанные с повреждением диэнцефальных структур (оболочечные гематомы, внутримозговые гематомы на отдалении от ложа удаленной опухоли, ишемическое повреждение мозга в бассейне магистральных сосудов мозга); атоническая кома, развившаяся в течение 7 суток после операции; тромбоэмболия легочной артерии и острый инфаркт миокарда, развившиеся в течение 7 суток после операции; сепсис, развившийся в течение 7 суток после операции. Регистрировались проявления полиорганной дисфункции. Для этого использовались критерии шкалы SOFA [7]. Исключениями стала квалификация измененного сознания (ИС) и дисфункции дыхательной системы. Сознание оценивалось по шкале RASS (Таблица №1).
Шкала RASS была выбрана, поскольку у изучаемой группы пациентов развивается как угнетение сознания, так и психомоторное возбуждение. В этих условиях использование других общепринятых шкал, оценивающих уровень сознания, в том числе и шкалы ком Глазго, не охватывало всех изменений сознания, характерных для пациентов с опухолями ХСО при осложненном течении послеоперационного периода. Отсутствие ИС соответствовало оценке RASS 0, при любой другой оценке RASS сознание считалось измененным.
Критериями дисфункции дыхательной системы являлись снижение индекса pO2/FiO2 ниже 400, как в шкале SOFA, и необходимость проведения продленной ИВЛ (более 24 часов после операции). Это связано с тем, что причиной дыхательной дисфункции у нейрореанимационных пациентов является не только паренхиматозное повреждение легких, которое отражает pO2/FiO2 индекс, но и другие механизмы, например, нарушение центральных механизмов регуляции дыхания или угнетение сознания [8]. Другие соматические органные дисфункции (СОД) квалифицировались строго в соответствии со шкалой SOFA. Дисфункция сердечно-сосудистой системы определялась как развитие артериальной гипотензии (снижение среднего АД ниже 70 мм.рт.ст.) или необходимость использования симпатомиметических препаратов. Почечная дисфункция определялась как повышение уровня креатинина выше 110 мкмоль/л или при снижении диуреза менее 500 мл/сут. Печеночная дисфункция определялась как повышение уровня билирубина выше 20 мкмоль/л. Гематологическая дисфункция определялась как тромбоцитопения (менее 150 тыс/мкл).
Водно-электролитные нарушения (ВЭН) и кишечная дисфункция часто развиваются у пациентов с опухолями ХСО и осложненным течением послеоперационного периода. Шкала SOFA не включает оценку этих нарушения, поэтому были введены следующие квалифицирующие их критерии. ВЭН определялись как диснатриемия (повышение выше 145 ммоль/л или снижение ниже 135 ммоль/л) вследствие несахарного диабета, синдрома неадекватной секреции вазопрессина или сольтеряющего синдрома. Кишечная дисфункция определялась как парез ЖКТ. Лихорадка определялась как повышение температуры тела выше 38,5ºС, гипотермия – снижение температуры тела ниже 36ºС. Для предупреждения развития гормональной недостаточности все пациенты после операции получали заместительную гормональную терапию в дозе, которые используются у пациентов с гормональной недостаточностью, находящихся в состоянии выраженного стресса: гидрокортизон 2,5 – 3 мг/кг/сут, L-тироксин 2-2,5 мкг/кг/сут. Данные представлены в виде медианы с указанием 25 и 75 перцентиля. При анализе данных использовались тест Манна-Уитни и отношение рисков. Различия считались достоверными при p<0,05, а риск считался достоверным, если нижняя граница доверительного интервала превышала единицу. Статистический анализ проводился с помощью программы Statistica 7.0.
Результаты исследования и их обсуждение
Согласно критериям включения в исследование вошло 83 пациента. 7 больных было исключено из анализа в соответствии с вышеуказанными критериями: 2 пациента с эпидуральной гематомой, 3 пациента с формированием атонической комы в течение 48 часов, 1 пациент с острым инфарктом миокарда и 1 – с ТЭЛА. Таким образом, было проанализировано 76 пациентов с осложненным течением раннего послеоперационного периода в возрасте от 19 до 77 лет (медиана 49 лет).
Женщин было 43 (56,6%), мужчин – 33 (43,4%). У 46 пациентов была аденома гипофиза, у 17 – краниофарингиома, в 8 наблюдениях – менингиома ХСО, и по одному наблюдению были представлены пациенты с глиомой и эпендимомой III желудочка, гемангиоперицитомой, эпидермоидной кистой и метастазом рака в ХСО.
У всех 76 пациентов (100%) выявлялись ИС и диснатриемия, развивающиеся, соответственно, на первые и вторые сутки после операции (Таблица №2).
С учетом анатомии и физиологии ДС это является логичным. Поскольку вазопрессин синтезируется в паравентрикулярном и супраоптическом ядре, депонируется в нейрогипофизе, а транспортируется туда по ножке гипофиза, то существует высокая вероятность периоперационного повреждения какой-либо одной или нескольких из этих анатомических структур. Это незамедлительно приводит к дизнатриемии. ИС также легко объяснить. Таламус, занимающий 4/5 ДС, вычленяет важную информацию, поступающую от всех сенсорных анализаторов, и передает только ее коре мозга. При повреждении этого ограничивающего механизма к коре поступает огромное количество ненужной информации, которую она не способна проанализировать, происходит очевидная перегрузка, приводящая к изменению сознания [9]. Эпиталамус синтезирует мелатонин, который затем депонируется в нейрогипофизе. Мелатонин имеет первостепенное значение для адекватного функционирования циркадного ритма сон-бодрствование. При повреждении эпиталамуса, ножки гипофиза или гипофиза развиваются нарушения сна, которые приводят к изменению сознания [10]. Кроме этого, различные ДС связаны со стволовыми структурами, лимбической системой, корой мозга. Морфологическое повреждение этих связей также может стать причиной ИС [11].
Дисфункция дыхательной, сердечно-сосудистой системы и водно-электролитные нарушения развивались на вторые сутки после операции, а парез желудочно-кишечного тракта – на третьи. Наиболее частыми СОД были дисфункция сердечно-сосудистой системы, кишечная дисфункция и дисфункция дыхательной системы. Дисфункция сердечно-сосудистой и дыхательной систем развивались на вторые сутки, соответственно, у 52 (68%) и 50 (66%) пациентов. Кишечная недостаточность развилась на третьи сутки у 51 (67%) пациента. Сердечно-сосудистая, дыхательная система и желудочно-кишечный тракт являются теми структурами, на которые ДС оказывают выраженное и непосредственное влияние. Исходя из этого, частое развитие этих СОД у пациентов с осложненным течением послеоперационного периода является логичным. Гораздо реже и позже развивалась тромбоцитопения – у 21 (28%) пациента с 4 суток после операции. Это объясняется тем, что уровень тромбоцитов регулируют другие механизмы. Почечная и печеночная дисфункция развивалась в ранние сроки после операции, но выявлялись очень редко – в трех (4%) и одном (1%) наблюдении, соответственно. ДС непосредственно не регулируют клубочковую фильтрацию, поэтому они не могут оказывать непосредственное влияние на клиренс креатинина [12]. При несахарном диабете почечная недостаточность формируется только при развитии декомпенсированной гиповолемии, которую легко избежать при проведении адекватной инфузионной и заместительной гормональной терапии препаратами вазопрессина. Кроме этого, почечная недостаточность может развиваться вследствие резистентной артериальной гипотензии, что возникает крайне редко у изучаемой группы пациентов [13]. ДС, вероятно, также лишены непосредственного регулирующего влияния на функцию печени, которая, однако, может страдать вследствие гипоперфузии на фоне резистентной артериальной гипотензии. Другой возможной причиной развития почечной и печеночной недостаточности может быть абдоминальный компартмент-синдром, развивающийся вследствие пареза желудочно-кишечного тракта [14]. Однако резистентная артериальная гипотензия и компартмент-синдром развиваются достаточно редко [13], что и отражается в частоте этих дисфункций у изучаемой категории пациентов.
Лихорадка развивалась у 18 (23,7%) пациентов, гипотермии не было выявлено ни в одном из наблюдений. Таким образом, дистермия, ранее описанная как характерный для повреждения ДС симптом, редко развивалась у наших пациентов.
При повреждении ДС нарушение функций надпочечников и щитовидной железы неизбежно. Клиническими проявлениями надпочечниковой и тиреоидной недостаточности являются артериальная гипотензия, бради- или тахикардия, гипотермия или лихорадка, парез желудочно-кишечного тракта, повышенная проницаемость мембран, приводящая к полисерозиту и интерстициальному отеку [2,15]. В соответствии с принятыми протоколами интенсивной терапии все пациенты, вошедшие в исследование, получали глюкокортикостероидные и тиреоидные гормоны в дозах, полностью замещающих их продукцию надпочечниками и щитовидной железой в условиях выраженного стресса. Из этого следует, что мы могли исключить надпочечниковую и тиреоидную недостаточность из числа причин развития вышеперечисленных органных нарушений.
Очевидно, что при повреждении задней доли гипофиза или его стебля неизбежно появятся ВЭН [2]. При каком варианте повреждений ДС у пациента облигатно разовьется ИС и СОД до сих пор остается неизвестным. Проведенный анализ также не смог ответить на этот вопрос. Это означает, что по-прежнему отсутствуют точные предоперационные и интраоперационные предикторы развития ИС и СОД.
Следует подчеркнуть, что до операции все пациенты, вошедшие в исследование, были в компенсированном состоянии, и у них не отмечалось проявлений соматических органных дисфункций, а ВЭН были менее выраженными или вовсе отсутствовали. Таким образом, при описании структуры послеоперационного СДД следует учитывать развившиеся после операции диснатриемию, ИС и СОД. Для определения вариантов СДД пациенты были разделены на группы в зависимости от комбинации выявленных дисфункций. Получилось 6 групп (Таблица №3).
Примечание. Гр – группа; ИС – измененное сознание; ВЭН – водно-электролитные нарушения; СД – соматическая дисфункция; ОРИТ – отделение реанимации и интенсивной терапии; ШИГ – Шкала Исходов Глазго; ДС – диэнцефальные структуры; СС – стволовые структуры; ТЭЛА – тромбоэмболия легочной артерии.
Группу 1 составили 12 пациентов. У них выявлялась изолированное сочетание ИС и ВЭН без СОД. Медиана возраста этих пациентов составила 42,5 лет, медиана продолжительности пребывания в ОРИТ — 8,5 суток. У 11 (91,7%) пациентов, по шкале исходов Глазго (ШИГ), был зафиксирован благоприятный исход (ШИГ=4), у одного пациента (8,3%) – неблагоприятный (ШИГ=3), летальных исходов не было.
Группу 2 составили 11 пациентов. Они имели одну СОД в дополнение к ИС и диснатриемии. Наиболее часто, у 6 (54,5%) пациентов, развивалась дисфункция сердечно-сосудистой системы. Парез кишечника развился у двух пациентов, и дыхательная недостаточность развилась в двух наблюдениях. В одном наблюдении выявлялась тромбоцитопения. Медиана возраста составила 51 год, а медиана длительности пребывания в ОРИТ – 13 суток. Благоприятный исход (ШИГ=4) был у 5 (45,5%) пациентов, неблагоприятный (ШИГ=3) был у 6 больных (54,5%).
Группу 3 составили 12 пациентов. У них выявлялось две СОД на фоне ИС и диснатриемии. Кишечная недостаточность развилась у 9 (75%) больных, дыхательная недостаточность — у 8 (66,7%) пациентов, сердечно-сосудистая — в 7 (58,3%) наблюдениях. Медиана возраста в этой группе составила 47 лет, а медиана продолжительности пребывания пациентов в ОРИТ – 23,5 суток. У 3 (25%) больных имел место благоприятный исход: ШИГ=4 в двух наблюдениях; ШИГ=5 в одном наблюдении. У 9 пациентов (75%) исход был неблагоприятный. Из них у 5 больных развилась грубая инвалидизация (ШИГ=3), а в 4 наблюдениях (33%) был зафиксирован летальный исход (ШИГ=1). Причиной смерти в 3 наблюдениях был сепсис, в одном – ТЭЛА.
Группу 4 составили 25 пациентов. У них выявлялись сразу три СОД в дополнение к ИС и диснатриемии. Дыхательная недостаточность развилась в 24 (96%) наблюдениях, сердечно-сосудистая недостаточность — у 23 (92%) пациентов, кишечная недостаточность — у 24 (96%). У 4 (16%) больных была отмечена тромбоцитопения. Медиана возраста в этой группе составила 53 года, медиана продолжительности пребывания в ОРИТ – 22 дня. Благоприятный исход отмечался у 6 (24%) пациентов: ШИГ=5 у двух пациентов, ШИГ=4 у четырех пациентов, неблагоприятный исход – у 19 больных (76%), из которых у 8 развивалась глубокая инвалидизация (ШИГ=3). Летальный исход имел место у 11 пациентов (44%). У 4 умерших пациентов причиной смерти был сепсис, у 2 – менингоэнцефалит, еще у 2 – гемотампонада желудочковой системы, дислокация и вклинение, 2 пациента скончались вследствие подтвержденного морфологического повреждения диэнцефальных структур, а 1 – вследствие ТЭЛА.
Группу 5 составили 12 пациентов. У них выявлялись одновременно четыре СОД с ИС и диснатриемией. У всех пациентов развивались дыхательная, сердечно-сосудистая, кишечная недостаточность и тромбоцитопения. Медиана возраста составила в этой группе 57,5 лет, медиана продолжительности пребывания в ОРИТ – 40,5 суток. Благоприятный исход (ШИГ=4) был зафиксирован у 4 (33,3%) пациентов этой группы. Неблагоприятный исход развился в 8 (66,7) наблюдениях. При этом только один из 8 пациентов с неблагоприятным исходом выжил (ШИГ=3). У остальных, 7 (58,3%) пациентов, имел место летальный исход (ШИГ=1). В 5 наблюдениях причиной смерти был сепсис, в 2 наблюдениях – повреждение диэнцефальных структур.
Группу 6 составили 4 пациента. У них развивалось одновременно 5 СОД с ИС и диснатриемией. У всех пациентов развивались дыхательная, сердечно-сосудистая, кишечная недостаточность и тромбоцитопения. У 3 пациентов выявлялась почечная дисфункция, а в одном наблюдении – печеночная. Медиана возраста в этой группе составила 52 года, медиана продолжительности пребывания в ОРИТ – 7,5 суток. В этой группе не было пациентов с благоприятным исходом, во всех наблюдениях наступил летальный исход. Причиной смерти у одного пациента был сепсис, у трех – морфологически подтвержденное повреждение диэнцефальных и структур.
Исходы пациентов первой группы с изолированным сочетанием ИС и диснатриемии были лучше, чем во всех остальных группах. Длительность их пребывания в ОРИТ была наименьшей. Различия между первой и второй группами не были достоверными (р=0,5). Однако, были получены достоверны различия по длительности пребывания пациентов в ОРИТ между первой и третьей, первой и четвертой группами (р=0.04 и р=0.01, соответственно). При анализе не учитывалась длительность пребывания в ОРИТ пациентов группы 5, поскольку это были наиболее тяжелые пациенты, у которых летальный исход наступил ранние сроки после операции. Благоприятные исходы в группе 1 развивались чаще, чем в других группах, а неблагоприятные – реже (Таблица №3). Риски развития неблагоприятного и летального исходов в группах 2 – 6, по сравнению с первой группой, приведены в таблице №4.
Летальных исходов в группах 2 и 3 не было, а в группе 6 все пациенты имели летальный исход, поэтому в этих группах было невозможно высчитать риски.
Известно, что ряд пациентов с изолированной диснатриемией, изолированным ИС или даже сочетанием ИС и диснатриемии не требуют пребывания в ОРИТ в послеоперационном периоде [16]. У некоторых пациентов эти нарушения могут сохраняться в течение длительного времени после выписки их из стационара, а адекватно подобранная терапия позволяет вернуться пациентам к своей повседневной деятельности.
Очевидно, пациенты группы 1 имели более выраженные формы ИС и диснатриемии, чем больные с подобными нарушениями, но не требующие пребывание в ОРИТ. По сравнению с последними у пациентов группы 1 отличительной чертой являлась их нестабильность. Это проявлялось необходимостью изменения в течение суток проводимой интенсивной терапии. Однако тот факт, что одни и те же проявления могут быть, как у реанимационных пациентов, так и у тех, кто уже вернулся к своей повседневной деятельности, не позволяет выделить изолированное сочетание ИС и диснатриемию в одну из форм СДД.
В группе 2 количество неблагоприятных исходов существенно превысило количество благоприятных (Таблица №3). Это дает основание считать больных группы 2 пациентами первой стадии СДД. Следовательно, СДД – это синдром, включающий в себя измененное сознание, диснатриемию и, как минимум, одну соматическую органную дисфункцию. Исходы у пациентов каждой последующей группы были тяжелее, чем исходы пациентов предыдущей группы (Таблица №4). Риск развития неблагоприятного исхода по сравнению с первой группой был выше в каждой последующей группе: 13,2; 33; 34,8, соответственно (Таблица №4). Нижний предел доверительного интервала превышал единицу во всех группах, что свидетельствует о достоверности выявленного риска. Не понятно, почему риск развития неблагоприятного исхода в группе 5 по сравнению с группой 1 составил 22, тогда как в группе 3 и 4 – 33 и 34,8, соответственно. Однако в этой группе риск развития летального исхода по сравнению с первой группой был достоверно выше, причем для группы 4 риск развития летального исхода по сравнению с первой группой не достиг достоверного уровня (Таблица №4). Из этого следует, что СДД имеет 5 степеней тяжести. СДД 1 первой степени имеет ИС, диснатриемию и одну СОД. В каждой последующей степени добавляется по одной СОД.
СДД, по-сути, является вариантом синдрома полиорганной дисфункции (СПОД). Однако в отличие от СПОД, развивающегося на фоне синдрома системной воспалительной реакции, СДД имеет ряд принципиальных отличий. Во-первых, СДД обязательно включает в себя ИС и диснатриемию, которые не всегда развиваются при СПОД [17]. Во-вторых, для СДД нехарактерны почечная и печеночная дисфункция, типичные для СПОД [18]. В-третьих, существенным отличием являются сроки и очередность развития СОД. При СДД происходит раннее и фактически одновременное, в течение 1 – 3, суток развитие дыхательной, сердечно-сосудистой и кишечной дисфункции. Даже не характерная для СДД почечная дисфункция формировалась в течение полутора суток после операции. Для СПОД характерно более медленное и поэтапное появление СОД [19]. В-четвертых, тромбоцитопения имеет различную прогностическую значимость для СДД и СПОД. В нашем исследовании она выявлялась у 21 пациента, что значительно чаще, чем почечная или печеночная недостаточность, но существенно реже, чем сердечно-сосудистая, дыхательная или кишечная дисфункция. Это не дает оснований для суждения о том, является ли тромбоцитопения типичным или нетипичным феноменом для пациентов с СДД. В то время, как для СПОД тромбоцитопения типична [17,18]. Нами не было выявлено различий по частоте её встречаемости в различных группах. Другими словами, если появление любой другой органной дисфункции означает утяжеление состояния пациента и ухудшение его прогноза, то выявление тромбоцитопении мало что означало для исхода. Однако наиболее важным фактом является то, что, ни в одном из наших наблюдений тромбоцитопения не достигала уровня 50 тысяч в мкл, и почти всегда количество тромбоцитов превышало 100 тысяч в мкл. Это означало, что тромбоцитопения при СДД не требует коррекции в отличие от СПОД.
Выводы
- У больных с нейрохирургической патологией ХСО синдром диэнцефальной дисфункции в послеоперационном периоде проявляется сочетанием измененного сознания, водно-электролитных нарушений в виде диснатриемии и, как минимум, одной соматической органной дисфункции.
- Наличие у пациента измененного сознания и диснатриемии не достаточно для диагностики синдрома диэнцефальной дисфункции.
- Тяжесть синдрома диэнцефальной дисфункции и исход определяются количеством развившихся соматических органных дисфункций.
Литература
- Бер М, Фротшер М. Топический диагноз в неврологии по Петеру Дуусу. Анатомия, физиология, клиника. Пер. с анг. под ред. З.А. Суслиной. 4-е изд. М: Практическая медицина, 2009. 478 стр.
- Endocrinology. DeGroot L.J., Jameson J.L. Elsevier Saunders, Philadelphia, 2006. p. 3336.
- Russell A. Diencephalic syndrome of emaciation in infancy and childhood.// Arch Dis Child, 1951. V.26 p274.
- Baguley I.J., Heriseanu R.E., Cameron I.D., et al. A critical review of the pathophysiology of dysautonomia following traumatic brain injury.// Neurocrit Care. 2008. V. 8 p. 293-300.
- Boeve B.F., Wijdicks E.F., Benarroch E.E. Paroxysmal sympathetic storms («diencephalic seizures») after severe diffuse axonal head injury.// Mayo Clin. Proc. 1998. V. 73 p. 148-152.
- Clifton G.L., Robertson C.S., Kyper K. Cardiovascular response to severe head injury.// J Neurosurg. 1983. V. 59 p. 447-54.
- Vincent J.L., Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the working group on sepsis-related problems of the European society of intensive care medicine.// Intensive Care Med. 1996. V. 22 p. 707-710.
- Попугаев К.А., Савин И.А., Горячев А.С. и др. Шкала оценки тяжести дыхательной недостаточности у нейрохирургических пациентов.// Анест. и реан., 2010. №4 c. 42-50.
- Stewart J.T., Quijije N., Sheyner I., Stover K.T. Delirium without focal signs related to a thalamic stroke.// J. Am. Geriatr. Soc. 2010. V. 58 p. 2433-2434.
- Figueroa-Ramos M.I., Arroyo-Novoa C.M., Lee K.A., et al. Sleep and delirium in ICU patients: a review of mechanisms and manifestations.// Intensive Care Med. 2009. V. 35 p. 781–795.
- Frontera J.A. Delirium and sedation in the ICU.// Neurocrit Care 2011. V. 14 p. 463-474.
- Legrand M., Payen D. Understanding urine output in critically ill patients.// Ann Intensive Care. 2011. V. 24 p.13.
- Popugaev K.A., Savin I.A., Goriachev A.S., Kadashev B.A. Hypothalamic injury as a cause of refractory hypotension after sellar region tumor surgery.// Neurocrit Care. 2008. V. 8 p. 366-373.
- Cheatham M.L.: Intra-abdominal hypertension and abdominal compartment syndrome.// New Horiz. 1999. V. 7 p. 96–115.
- Попугаев К.А., Савин И.А., Горячев А.С. и др. Вторичный абдоминальный компартмент синдром при осложненном течении послеоперационного периода у больных с опухолями хиазмально-селлярной локализации.// Анест. и реан., 2011. № 4 с. 37-42.
- Аденомы гипофиза: клиника, диагностика, лечение/ Под ред. Б.А. Кадашева. М.-Тверь: ООО «Издательство Триада», 2007. 368 с.
- Knaus W.A. and Wagner D.P. Multiple systems organ failure: epidemiology and prognosis.// Crit. Care Clin. 1989. V. 5 p. 221–232.
- Cerra F.B. Multiple organ failure syndrome./ In: Bihari DS, Cerra FB (eds). New Horizons. Multiple Organ Failure. Fullerton, CA: Society of Critical Care Medicine. 1989. p 1–24.
- Murray M.J., Coursin D.B. Multiple Organ Dysfunction Syndrome.// Yale J. Biol. Med. 1993. V. 66 p.501-510.
Постановка диагноза — дело непростое
Во время проведения полиморфного диагноза диэнцефального синдрома могут проявиться сложности при обследовании пациента. В целях постановки диагноза проводятся такие исследования и берутся следующие анализы:
- проведение сахарной кривой;
- результат термометрии в трех местах;
- ЭЭГ;
- берется трехдневная проба Зимницкого.
Определяется уровень глюкозы натощак с уровнем нагрузки сахара 100 грамм. При этом определяется показатель глюкозы через каждые полчаса.
Определяется ряд разновидностей сахарной кривой:
- гипергликемического типа, когда показатель глюкозы превышает нормальный уровень;
- гипогликемического типа, когда показатель глюкозы ниже нормального уровня;
- двугорбового типа, когда падение показателя глюкозы меняется с новым повышением;
- торпидного типа, когда небольшой скачок показателя глюкозы в крови останавливается на одном уровне.
Термометрия делается в трех зонах – в двух подмышечных местах и в области прямой кишки. Различные расстройства с термометрическим характером могут проявляться в виде изотермии, когда температурный режим в подмышечной области и в прямой кишке равны, в то время как уровень температурного режима в прямой кишке должен быть выше на 0,5-1 градус Цельсия.
А также в виде гипо- и гипертермии (в области подмышечных впадин температурный режим выше или ниже нормы), тероминферсии, когда уровень температурного режима в области прямой кишки ниже температурного режима подмышечной зоны.
Во время электроэнцефалографического исследования можно выявить проблемы, которые касаются глубинной структуры головного мозга.
При взятии трехдневной пробы Зимницкого делаются исследования, которые помогают определить уровень выпитого и выделяемого количества жидкости.
Помимо этого делается МРТ головного мозга, которое помогает определить высокое давление внутричерепного типа, а также различные последствия травматических повреждений, гипоксии, образований опухолевого вида.
Проводятся исследования на уровень содержания гормонов в крови и определяются биохимические данные кровяного состава, это нужно для определения эндокринно-обменных нарушений.
В обязательном порядке для определения синдрома с органическим происхождением проводится ряд исследований:
- УЗИ надпочечников;
- УЗИ щитовидной железы и внутренних органов;
- МРТ и КТ надпочечников.
Диагностика
Особенностью данного заболевания, как мы отмечали выше, является сложность диагностики. Для проведения исследований пациенту необходимо обратиться и к эндокринологу, и к гинекологу, если дело касается женщины. Диагностические исследования в данном случае включают в себя:
- анализы крови и мочи, которые берутся для того, чтобы оценить уровень АКТГ, а также уровень кортикостероидов;
- специальные пробы, которые берутся в случае использования дексаметазона;
- томография, которая проводится, чтобы убедиться в наличии или отсутствии опухоли на надпочечниках или гипофизе;
- гормональные исследования.
Классификация сосудистых кризов
Термин сосудистый криз объединяет в себе две патологии:
- Гиперкинетический тип криза, характеризующийся спазмом сосудов и повышением давления без увеличения объема циркулирующей крови;
- Гипокинетический (водно-солевой) характеризуется одновременным повышением давления и формированием отеков областей тела. При этом рост давления сопровождается увеличением объема крови в сосудах, которые теряют тонус своих стенок, становятся более проницаемыми.
По распространенности гемодинамических расстройств сосудистые кризы делят на:
- системные (гипертонические, гипотонические, вегетативные кризы);
- регионарные (мигрень, ангионевротические отеки, ангиотрофоневроз).
Системные кризы возникают тогда, когда нарушена общая емкость периферических вен или изменено периферическое сопротивление кровотока. При этом может произойти падение или повышение артериального давления. Кроме того, при подобных состояниях имеются признаки нарушения сердечной деятельности вторичного характера. При резком повышении давления будет иметь место гипертонический криз, при снижении давления — сосудистый коллапс или гипотонический криз.
Регионарные кризы возникают при нарушении кровоснабжения ткани или органа. Здесь при высоком давлении может быть значительное снижение притока крови к органу или вообще его прекращение. При артериальной гипотонии наоборот, приток крови к органу превышен. При пониженном давлении в венах и нарушении в них сосудистого тонуса нарушается отток крови от органов и тканей. При этом происходит застой крови в венах и капиллярах. С регионарными расстройствами кровотока напрямую связаны такие заболевания, как болезнь Рейно (имеется ишемия пальцев), мигрень (резкая боль в какой-либо части головы), гипертоническая болезнь (церебральные кризы).