Диагностика
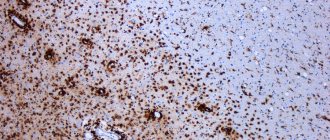
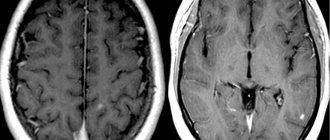
Для определения рассеянного склероза врачи используют методы опроса и неврологического осмотра, а затем подтверждают диагноз МРТ-исследованием и анализами. На МРТ изучают головной и спинной мозг на наличие старых и новых очагов поражения. Для лучшей визуализации свежих бляшек применяют контраст. Диагноз ставится, если у пациента обнаружили 4 и более очага демиелинизации размером не меньше 3 мм, либо 3 очага рядом с боковыми желудочками, в стволе мозга, мозжечке или спинном мозге.
Кроме МРТ при рассеянном склерозе могут назначать:
- регулярные анализы крови для определения уровня иммуноглобулинов в ликворе;
- люмбальные пункции для изучения состава жидкости спинного мозга.
Симптоматическое лечение
Целью симптоматической терапии является устранение или смягчение существующих неврологических симптомов. На само течение РС симптоматическая терапия не оказывает влияния, однако может улучшить качество жизни пациента. Для этого применяются препараты различных групп. Зачастую одно и то же средство одновременно устраняет несколько проявлений рассеянного склероза.
Синтетические аналоги ГАМК
Гамма-аминомасляная кислота – один из т.н. тормозных медиаторов в ЦНС. Поражение мозговых структур при рассеянном склерозе сопровождается устранением тормозных импульсов с развитием мышечного спазма и спастических болей. Подобные симптомы устраняются с помощью «Баклофена». Этот синтетический аналог ГАМК восстанавливает тормозные импульсы и угнетает спазм. «Баклофен» расслабляет не только скелетную, но и гладкую мускулатуру. Поэтому его можно использовать при спастических запорах и затруднении опорожнения мочевого пузыря.
Бензодиазепины
Производные бензодиазепина («Диазепам», «Клоназепам») по своим свойствам близки к ГАМК. Они усиливают действие «Баклофена», а также обладают свойствами транквилизаторов. Поэтому их используют для устранения тревоги и страха у пациентов с рассеянным склерозом. Помимо этого бензодиазепины обладают свойствами анальгетиков – способны устранять боль.
Холинолитики
Эти средства нормализуют мышечный тонус путем влияния на центральные и периферические холинергические рецепторы. «Мидокалм», «Гиосциамин», «Оксибутинин» используют для снятия спазма скелетных мышц, гладкой мускулатуры кишечника и мочевого пузыря.
Противоэпилептические средства
Тоже могут быть полезны при рассеянном склерозе. «Карбамазепин», «Фенитоин» предупреждают развитие судорог, нормализуют чувствительность, эффективны при невритах, сопровождающихся болью, нарушением глотания и речи.
Трициклические антидепрессанты
Устраняют ощущение подавленности и усталости, повышают настроение, работоспособность. Эти препараты также нормализуют мышечный тонус и устраняют боль.
Витамины
Значение этих биологически активных веществ при рассеянном склерозе трудно переоценить. Витамины группы В нормализуют чувствительность и движение, аскорбиновая кислота повышает иммунитет, витамин Е укрепляет сосуды, а витамин D предупреждает развитие остеопороза – частого спутника рассеянного склероза. Все препараты для симптоматического лечения рассеянного склероза применяются только по назначению врача и под его контролем.
Причины рассеянного склероза
Современная медицина точного ответа не может дать на этот вопрос. Общепринятым же мнением врачей, является наличие неблагоприятных внешних и внутренних факторов действующих на пациента. К таким неблагоприятным факторам можно отнести:
- Неправильное питание
- Частые вирусные или бактериальные инфекции
- Травмы позвоночника и головного мозга
- Стрессовые ситуации
- Генетическая предрасположенность
- Радиация и токсические вещества
- Геоэкономическое место взросления и проживания
- Недостаток витамина D
- Аутоиммунные реакции в организме
Лечение обострений
В период обострений терапия проводится при помощи сильнодействующих противовоспалительных средств, кортикостероидных гормонов. Схемы и дозы введения этих препаратов индивидуально определяются врачом в зависимости от состояния пациента. Одновременно с кортикостероидами при обострении обычно назначаются препараты, улучшающие функции нервной ткани (так называемые нейропротекторы), средства, укрепляющие сосудистую стенку, и препараты, улучшающие реологические свойства крови. При отсутствии противопоказаний показаны лечебная физкультура и физиотерапевтические процедуры.
Патогенетическое лечение
Целью патогенетического лечения РС является быстрое снятие симптомов, вызванных обострением, а также предупреждение обострений и увеличение периода ремиссии. Кроме того, следует стремиться изменить течение заболевания и замедлить его прогрессирование. Лекарственные препараты, применяющиеся для лечения РС, могут быть разделены на две группы. Первая группа – препараты, которые применяются в периоды обострений. Вторая группа – препараты, изменяющие ход заболевания путем подавляющего воздействия на патологически активную иммунную систему. К ним относятся иммуномодуляторы, иммуносупрессоры, цитостатики и моноклональные антитела. Конечно, наиболее эффективным видом лечения рассеянного склероза было бы этиологическое, направленное на устранение причины. Но поскольку этиология заболевания до сих пор мало изучена, лечение начинают с влияния на патогенез, механизм развития заболевания.
Патогенетическое лечение направлено на:
- предотвращение демиелинизации аксонов;
- ускорение ремиелинизации;
- иммуносупрессию – снижение патологической активности иммунной системы;
- иммуномодуляцию – изменение, модулирование иммунного ответа;
- угнетение местных воспалительных и аутоиммунных процессов;
- укрепление, снижение проницаемости сосудистой стенки и ГЭБ (гематоэнцефалического барьера).
При правильно подобранном патогенетическом лечении процессы восстановления начинают преобладать над процессами повреждения аксонов миелиновой оболочки нервных волокон. В результате тяжесть обострений снижается, а ремиссии, наоборот, удлиняются. При этом переход ремиттирующего течения во вторично прогрессирующее с инвалидизацией наступает как можно позже или не наступает вовсе.
Рассеянный склероз (РС) представляет собой хроническое прогрессирующее заболевание нервной системы неизвестной этиологии, характеризующееся развитием диффузной демиелинизации и аксональной дегенерации [1]. Его относят к мультифакториальным заболеваниям. Под этим термином понимается сочетанное воздействие внешних и генетических факторов, приводящее к развитию хронического воспалительного, демиелинизирующего и нейродегенеративного процессов. Среди внешних факторов в настоящее время особое внимание уделяется трем факторам риска развития РC — гиповитаминозу витамина D, вирусной инфекция Эпштейна-Барр и курению [2, 3]. Недостаток витамина D давно обсуждается в качестве фактора риска РС, но в последние годы интерес к нему резко возрос.
Название «витамин D» присвоено группе веществ, представленной более чем 10 структурными аналогами. Основные из них — витамин D2, или эргокальциферол, и витамин D3, или холекальциферол. Витамин D поступает в организм двумя путями: с пищей и в результате синтеза в коже под воздействием ультрафиолетовых лучей. Всасывание поступившего с пищей витамина D происходит в двенадцатиперстной и тощей кишке в присутствии желчных кислот. В коже под воздействием солнечных лучей или ультрафиолетовой радиации из 7-дегидрохолестерола образуется превитамин D3, который сразу же под влиянием тепла конвертируется в витамин D3 (холекальциферол). Образовавшийся в коже и поступивший из кишечника витамин D связывается со специфическим витамин D-связывающим белком, осуществляющим его транспортировку к местам дальнейшего метаболизма. Часть витамина D транспортируется в жировые и мышечные ткани, где он фиксируется, представляя собой резервную форму, основное же его количество переносится в печень. В печени с помощью фермента 25-гидроксилазы витамины D2 и D3 превращаются в 25-оксивитамин D [25(ОН) D3], или кальцидиол, основную циркулирующую форму витамина D. Далее в почках кальцидиол под действием фермента α-гидроксилазы превращается в активный метаболит 1,25-дигидроксивитамин D3 (кальцитриол). Этот метаболит распознается тканями, содержащими специфические рецепторы витамина D (VDR), которые представлены в коже, костях, мышцах, гонадах, кишечнике, центральной нервной системе (ЦНС), микроглии, активированных моноцитах, В- и Т-лимфоцитах, дендритных клетках. Кальцитриол по своей структуре и действию отличается от типичных витаминов и больше напоминает стероидный гормон.
Основным источником витамина D является его образование в коже под действием солнечного облучения (80%) и только 20% поступает с пищей или добавками [4]. Считается, что кратковременное (в течение 10-30 мин) солнечное облучение лица и рук эквивалентно приему 200 ЕД витамина D. На уровень cинтеза витамина D в коже влияют широта, время года и дня, загрязнение воздуха, облачность, содержание меланина в коже, использование солнцезащитных кремов, возраст, степень открытости одежды.
Образование превитамина D3 зависит от угла падения солнечных лучей. Увеличение угла падения вследствие низкого стояния солнца над горизонтом, облачности, загрязнения окружающей среды определяет преобладание излучения с большей длиной волны. Как следствие, меньше ультрафиолетовых фотонов достигает поверхности кожи и стимулирует синтез витамина D. Продукция витамина D фактически отсутствует рано утром и поздно днем и в течение целого дня на протяжении нескольких зимних месяцев на широте выше 35°. Поэтому проживание в северных широтах является фактором риска дефицита витамина D. Те лица, которые избегают солнечных лучей вне зависимости от широты проживания, находятся также в группе риска по дефициту витамина D в любое время года. Неожиданно высокая частота дефицита витамина D была обнаружена в Майами [5]. Оказалось, что темнокожие люди нуждаются в более длительной инсоляции, чтобы синтезировать необходимое количество витамина D, поскольку эпидермис их кожи содержит большое количество меланина, который конкурирует с 7-дегидрохолестеролом за поглощение ультрафиолетовых фотонов. В стареющей коже уменьшается содержание 7-дегидрохолестерола, что снижает синтез витамина D у пожилых людей [6]. В 70 лет синтез витамина D снижается на 75%. Кроме того, ограничение подвижности, снижение почечной продукции 1,25-дигидроксивитамина D, а также уменьшение потребления обогащенных витамином D продуктов создают трудности в адекватном обеспечении витамином D пожилых людей.
Уровень 7-дегидрохолестерола в коже страдающих ожирением лиц не отличается от такового у людей, не страдающих ожирением. Однако подкожный жир создает запасы витамина D, за счет чего его недостаточно в циркуляторном русле у тучных людей [7].
На уровень витамина D также влияют снижение биодоступности в результате мальабсорбции, повышенный катаболизм (при использовании антиконвульсантов, глюкокортикостероидов), снижение синтеза 25-гидроксивитамина D в результате печеночной недостаточности, потери 25-гидроксивитамина D при нефротическом синдроме, снижение синтеза 1,25-дигидроксивитамина D при хронической почечной недостаточности. Cнижение уровня эстрогенов влияет на активность фермента α-гидроксилазы, что приводит к снижению уровня 1,25(ОН)2D3 в постменопаузе. Наконец, женщины имеют в целом более низкий уровень витамина D, чем мужчины [8, 9]. Во время беременности и кормления их потребность в витамине D возрастает и редко компенсируется.
До настоящего времени продолжаются дебаты относительно оптимального уровня витамина D в сыворотке крови. Большинство экспертов полагают, что уровень выше 30 нг/мл (75 нмоль/л) адекватен [10-12]. Существующие рекомендации декларируют, что сывороточный уровень витамина D по крайней мере 75-90 нмоль/л необходим не только для оптимизации обмена кальция и фосфора, но и профилактики некоторых аутоиммунных болезней [13, 14]. Гиповитаминоз D определяется при уровне 25(ОН)D3 в сыворотке крови ниже 75 нмоль/л (30 нг/мл), D-витаминная недостаточность — при 50 нмоль/л (20 нг/мл), а D-дефицит — при уровне ниже 25 нмоль/л (10 нг/мл). Менее понятно, каким должен быть верхний уровень витамина D. Согласно данным литературы, уровень от 150 до 200 нг/мл (375-500 нмоль/л) может считаться безопасным [10].
При отсутствии метаболических болезней костей, таких как рахит, остеомаляция или остеопороз, дефицит витамина D асимптомен. Многочисленные исследования показывают, что средний уровень витамина D во взрослых популяциях всех стран с умеренным климатом, где эти исследования проводились, ниже оптимального значения. Например, в США — 60 нмоль/л (когорта в 18 558 человек с 2000 по 2004 г.) [15], 61 нмоль/л — во Франции (когорта 1579 человек) и в Канаде [16, 17], 51 нмоль/л — в Великобритании [18]. В северных странах уровень витамина D еще ниже — так, например, в Финляндии он составил 44 нмоль/л летом и 24 нмоль/л зимой (220 молодых мужчин) [19]. На территории России первые исследования подтвердили наличие дефицита витамина D как у детей и подростков (Якутск, Москва, Владивосток), так и у пожилых (Москва, Екатеринбург) [20].
Витамин D является важнейшим регулятором фосфорно-кальциевого метаболизма, обеспечивая необходимый уровень данных элементов для адекватного остеогенеза. Дефицит кальцитриола вызывает нарушение всасывания кальция. Снижение уровня кальция в плазме крови и уменьшение уровня активного метаболита витамина D вызывает пролиферацию клеток паращитовидной железы и увеличение секреции паратгормона. Вторичный гиперпаратиреоз влечет остеокластическую резорбцию кости, нарушение процессов ремоделирования и минерализации костной ткани, снижение ее плотности и изменения костной архитектуры, что в свою очередь приводит к остеопорозу, повышению риска переломов.
В дополнение к хорошо известному действию на обмен кальция и фосфора витамин D обладает другими важными эффектами, особенно выражено его противовоспалительное, антипролиферативное, а также иммуномодулирующее воздействие. Учитывая патогенез РС, следующие эффекты витамина D, оказываемые на иммунную систему, могут быть особенно интересны: способность модулировать дифференцировку и функциональную активность антигенпредставляющих клеток, тем самым уменьшая активность потенциально аутоагрессивных Т-лимфоцитов [21-23], способность ингибировать В-клетки, пролиферацию и дифференцировку Т-клеток [24, 25], способность переключать ответ цитокинов с провоспалительного Th1/Th17 в противовоспалительный Th2 [26, 27], и наконец, механизм, позволяющий способствовать дифференцировке регуляторных Т-клеток и функции естественных киллеров [28, 29]. Имеются также данные о нейропротективном действии витамина D [30].
Другие исследования поднимают вопрос о генетической регуляции метаболизма витамина D у пациентов с РС. Безусловно, генетические факторы влияют на метаболизм витамина D, который регулируют более 200 генов. Эффекты кальцитриола в отношении иммунной системы также могут быть обусловлены работой конкретных генов. С этим связано предположение о том, что гены, имеющие отношение к синтезу витамина D, могут влиять на риск РС. Недавно было показано, что экспрессия гена аллеля HLA-DRB1*1501 модулируется витамином D [31]. Также было показано, что отсутствие функциональных вариантов в гене CYP27B1
, который кодирует фермент, конвертирующий 25(ОН)D3 в его активную форму, ассоциируется с увеличением риска РС [32].
Первые гипотезы о возможной связи РС с дефицитом витамина D возникли из наблюдений, подтвердивших, что риск развития РС ассоциирован с широтой проживания [33, 34]. Распространенность РС увеличивается с удалением от экватора. Существует гипотеза, что широта влияет на риск РС через уровень инсоляции и сывороточный уровень витамина D. Тем не менее последние исследования показывают, что «градиент широты» стирается, что может быть объяснено рядом причин, включая лучшую диагностику РС, изменение образа жизни, улучшение санитарных условий проживания [35]. Большинство выводов о положительной роли витамина D при РС происходит из того, что риск РС и его активность ассоциированы с временем года. Как показано в ряде исследований, лица, родившиеся весной, имеют значительно более высокий риск развития РС, чем родившиеся осенью [36-39]. Это может быть частично объяснено тем, что в первом случае бо’льшая часть беременности протекала в период низкой инсоляции (октябрь — март), а во втором случае — в период высокой инсоляции (апрель — сентябрь). Основываясь на исследовании 136 пациентов и 272 лиц контрольной группы, проведенном в Тасмании, было обнаружено, что риск РС был ниже у тех, кто в детстве большее время проводил на солнце в каникулы и выходные, чем у тех, кто был защищен от солнечных лучей (p
<0,01) [40]. Обратная корреляция между риском РС и инсоляцией в прошлом также обнаруживалась и в других исследованиях [41, 42]. Наконец, в США обследовали 79 пар монозиготных близнецов, один из которых был болен РС. Оба близнеца различались только по степени инсоляции в детстве. Близнецы без РС получали значительно большую инсоляцию в прошлом [43]. Однако все эти исследования, касающиеся связи между уровнем инсоляции, полученным в детском и подростковом возрасте, и риском РС в последующем, имеют ряд ограничений. Во-первых, ретроспективная оценка продолжительности инсоляции в прошлом затруднительна [36]. Также при исследовании уровня инсоляции необходимо помнить, что связь между количеством образованного витамина D и уровнем инсоляции не является прямой. Кроме того, есть указания на то, что инсоляция оказывает независимый от витамина D иммуномодулирующий эффект [44, 45].
Только одно исследование напрямую анализировало риск РС, основанный на уровне витамина D3 в сыворотке у здоровых людей, за несколько лет до начала у них РС [46]. Исследовали 257 случаев РС среди молодых американских солдат, у которых брался хотя бы один образец сыворотки крови перед возникновением у них неврологических симптомов. Группу контроля составили 514 человек. В зависимости от уровня витамина D в сыворотке крови среди белых было выделено 5 подгрупп: подгруппа с самым высоким уровнем витамина D (99-152 нмоль/л) имела значительно более низкий риск РС, чем подгруппа с наименьшим уровнем (15-63 нмоль/л, p
<0,01). Для лиц белой расы уменьшение риска РС составило 41% с каждым увеличением уровня витамина D на 50 нмоль/л (OШ=0,59; 95% ДИ 0,36-0,97). Для группы чернокожих лиц не было получено статистически значимых различий.
В результате исследования был сделан вывод о том, что высокий уровень витамина D ассоциирован с низким риском РС для лиц белой расы. На основании этого исследования A. Ascherio и K. Munger [3] полагают, что почти ⅓ случаев РС можно избежать, если сывороточный уровень витамина D в детском и подростковом возрасте поддерживать на уровне около 100 нмоль/л. Одно из последних исследований убеждает, что уровень витамина D in utero
, полностью зависящий от уровня витамина D у матери, влияет на риск развития РС в последующем [47]. Канадское исследование с участием детей, перенесших первый демиелинизирующий эпизод, показало, что риск развития достоверного РС в течение последующих 3 лет обратно и независимо коррелировал с уровнем 25(OH)D3 [48].
Другие исследования касаются изучения уровня витамина D непосредственно у больных РС. По данным разных исследователей, распространенность гиповитаминоза витамина D у больных РС колеблется от 17,0 до 86,7% [49, 50].
Так, еще в сравнительно давнем американском исследовании было показано, что у 80 госпитализированных женщин с РС (средний балл по EDSS 7,2) средний уровень 25-гидроксивитамина D очень низкий, однако низкая двигательная активность этих больных могла в некоторой мере объяснить полученные результаты [49]. В то же время в ряде работ не обнаружено статистически значимой разницы в сывороточном уровне 25(ОН)D3 у больных РС и в контроле. Так, в финском исследовании группы из 40 пациентов, находившихся в дебюте РС, не обнаруживалось разницы в уровне 25(ОН)D3 между ними и 40 субъектами контрольной группы, если образцы исследовались зимой. Вместе с тем пациенты с РС имели значительно более низкий уровень 25(ОН)D3 в период с июня по сентябрь [51]. В другом исследовании, также проведенном в Финляндии, дефицит витамина D выявлялся с одинаковой частотой (у 50%) в группе пациентов и в контроле. При этом сезонные вариации 25(ОН)D3 были сходными у больных и лиц контрольной группы, однако уровень витамина D был ниже у пациентов в период обострения РС [52].
В 2008 г. в Нидерландах были обследованы 267 больных РС. Уровень 25(ОН)D3 был значительно ниже при прогрессирующих формах РС в сравнении с ремиттирующим РС. В этом же исследовании было показано, что низкий уровень 25(ОН)D3 ассоциирован с высоким баллом по шкале EDSS [53]. Впрочем, следует добавить, что хотя ряд исследователей обнаруживают обратную корреляцию между уровнем витамина D и баллом инвалидизации по шкале EDSS, тем не менее значительная часть пациентов с недостатком витамина D имеют небольшую инвалидизацию [54]. Хотя инвалидизация, уменьшая возможности выхода на улицу, наряду с систематическим избеганием жары и солнца этими пациентами может усилить гиповитаминоз D.
J. Corrale и соавт. [55] провели исследование уровня витамина D у 132 пациентов с разными типами РС и стадией заболевания и 60 лиц контрольной группы. Все обследованные проживали в Буэнос-Айресе (Аргентина) на 34-й широте южного полушария. Уровень 25(ОН)D3 был значительно ниже у пациентов с ремиттирующим РС (47,3±9,0 нг/мл в стадии ремиссии и 38,5±8,7 нг/мл в стадии обострения), чем у здоровых из группы контроля (61,2±5,6 нг/мл). Также продемонстрировано, что в период обострения уровень витамина D был значимо ниже, чем в стадии ремиссии. У пациентов с первично прогрессирующим РС уровень витамина D не отличался от показателей контрольной группы и составлял 52,2±6,5 нг/мл. Авторы эту разницу в уровне витамина D при ремиттирующем и первично-прогрессирующем РС объясняют особенностями патогенеза и морфологии этих двух принципиально отличающихся форм РС.
Исследование уровня витамина D у больных РС в России на примере Свердловской области также установило высокую частоту гиповитаминоза витамина D как среди больных РС, так и у здоровых добровольцев. Однако у пациентов с РС гиповитаминоз витамина D встречался чаще и был более выражен. Величина снижения уровня 25(ОН)D3 не коррелировала ни с одной изученной характеристикой РС, но была более выражена у молодых пациентов. Отмечалась тенденция к снижению концентрации витамина D3 при обострении РС [56].
Как известно, депрессия и утомляемость — частые симптомы при РС, они также ассоциированы с гиповитаминозом D. В Нидерландах в 2010 г. проведено исследование депрессии и утомляемости у 59 больных РС [57]. Уровень витамина D отрицательно коррелировал с уровнем депрессии (r
=–0,326,
р
=0,006). Такой корреляции не получено в отношении утомляемости. Авторы делают вывод, что гиповитаминоз витамина D может вносить вклад в наличие депрессивных симптомов при РС, хотя это положение требует подтверждения.
Исследования последних лет демонстрируют четкую связь между активностью РС и концентрацией витамина D. Так, в 2 исследованиях показано, что каждое увеличение уровня 25(ОН)D3 на 10 нмоль/л приводило к снижению частоты обострений на 11,0 и 13,7% соответственно [58, 59]. Еще в одном исследовании [60] было установлено, что при каждом удвоении сывороточного уровня витамина D частота обострений снижалась на 27,0%.
При исследовании уровня витамина D в цереброспинальной жидкости у больных и лиц контрольной группы достоверных различий получено не было, также не было выявлено отличий при исследованиях в стадии ремиссии и обострения [61].
Экспериментальные исследования показывают, что витамин D препятствует развитию экспериментального аутоиммунного энцефаломиелита и заметно улучшает клинические симптомы у пораженных мышей [62-65]. Однако этот эффект более заметен у женских особей, возможно, вследствие усиления эффекта витамина D эстрогенами [66].
К настоящему времени проведено несколько клинических исследований по применению витамина D в лечении РС, хотя качество некоторых из них вызывает вопросы.
В одном из ранних исследований P. Goldberg и соавт. [67], применяя в течение 2 лет витамин D (5000 ЕД в день в виде масла печени трески) у 16 пациентов, отметили снижение частоты обострений РС на 60%. В канадском исследовании продемонстрировано использование высоких доз витамина D3 (холекальциферол, 14 000 EД в день) в течение длительного периода (6 мес — 1 год) без развития гиперкальциемии или других значимых побочных эффектов, несмотря на достижение уровня витамина D3 около 400 нмоль/л. Спустя 1 год такого лечения отмечено уменьшение количества обострений на 41% и значительное улучшение по шкале EDSS у леченых пациентов [68].
Два недавно опубликованных рандомизированных двойных слепых плацебо-контролируемых исследования, проведенных в Финляндии [69] и Норвегии [70] и посвященных применению 20 000 ЕД витамина D в неделю дали противоречивые результаты. В финском исследовании среднее значение 25(ОН)D3 у пациентов, получавших витамин D в течение 1 года в дополнение к интерферону β, возросло до 110 нмоль/л, и у пациентов в группе, получавшей препарат, оказалось значительно меньше Gd-накапливающих очагов, при этом наблюдалась тенденцию к уменьшению накопления инвалидизации и улучшению параметров ходьбы. Ежегодная частота обострений была одинаковой как в группе получавших препарат, так и в группе плацебо.
В 96-недельном норвежском исследовании не получено разницы между группами по ежегодной частоте обострений, показателям шкал EDSS, MSFC, хотя медиана концентрации D3 в группе, получавшей витаминотерапию, достигла 121 нмоль/л.
Вследствие достаточно неопределенных результатов клинических исследований, опубликованных к настоящему времени, невозможно ответить на вопрос, может ли витамин D быть использован для лечения РС. В настоящее время проводятся хорошо спланированные клинические исследования, которые, возможно, будут способствовать разъяснению данного вопроса. Что касается безопасности высоких доз витамина D, то эти данные уже существуют. Лечение пациентов с РС высокими дозами витамина D безопасно [71-73].
Таким образом, многочисленные исследования показывают, что большинство пациентов с РС имеют дефицит витамина D. Выявлена ассоциация между дефицитом витамина D и активностью болезненного процесса. Для окончательного доказательства связи между уровнем витамина D в организме и риском развития РС необходимо продолжить соответствующие исследования. Несмотря на то что в настоящее время эффект витамина D в лечении РС не доказан, с чисто медицинской точки зрения нельзя игнорировать факт, что недостаток витамина D в целом причиняет ущерб здоровью этих пациентов. И хотя практические рекомендации отсутствуют, тем не менее целесообразно проводить скрининг лиц из группы риска по РС на содержание витамина D в сыворотке крови. В случае дефицита витамина D следует поднимать его уровень до 30-40 нг/мл (75-100 нмоль/л).
Препараты
Глюкокортикоиды
Это синтетические аналоги гормонов коры надпочечников – «Преднизолон», «Метилпреднизолон», «Дексаметазон». Данные препараты при рассеянном склерозе блокируют определенные биологически активные вещества класса цитокинов и снижают продукцию Т-лимфоцитов. Тем самым глюкокортикоиды угнетают воспалительные и аутоиммунные процессы. Кроме того, эти лекарства снижают проницаемость сосудистых стенок и ГЭБ. Глюкокортикоиды при рассеянном склерозе применяют в режиме пульс-терапии – большими дозами за короткие промежутки времени.
АКТГ
Адренокортикотропный гормон выделяется передней долей гипофиза и стимулирует выработку собственных глюкокортикоидов корой надпочечников. Таким образом, действие АКТГ и его синтетических аналогов («Синактен», «Тетракозактид») сходно с препаратом предыдущей группы, но имеет меньшую опасностью побочных эффектов (язвообразование, гиперкортицизм). Хотя в данном случае возможны нарушения водно-солевого обмена и повышение артериального давления.
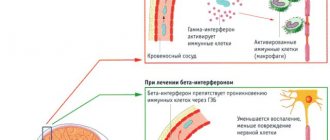
Синтетические бета-интерфероны
(«Авонекс», «Ребиф», «Бетаферон») оказывают иммуномодулирующее действие, угнетают аутоиммунные процессы, снижают активность Т-лимфоцитов, препятствуют проникновению цитокинов через ГЭБ. Кроме того, бета-интерфероны эффективны на начальных этапах вирусных инфекций – одной из причин рассеянного склероза.
Копаксон
Данный препарат обладает иммуномодулирующими свойствами, он специально разработан для лечения рассеянного склероза. Представляет собой последовательность аминокислот глутамина, лизина, аланина, тирозина. По химической структуре сходен с миелином.
Ангиопротекторы и антиагреганты
Эти препараты («Курантил», «Пентоксифиллин») препятствуют склеиванию эритроцитов, улучшают текучесть крови и укрепляют сосудистую стенку.
Ингибиторы протеолитических ферментов
Вводимые внутривенно капельно «Контрикал», «Гордокс» угнетают ферменты класса протеаз, которые разрушают белковые структуры и участвуют в воспалительных процессах. Хороший результат дает плазмаферез, метод аппаратного экстракорпорального (вне тела) очищения крови. В ходе плазмафереза вместе с плазмой удаляются антигенные комплексы, биологически активные вещества, запускающие аутоиммунные процессы. Не так давно в США был разработан препарат Anti-LINGO-1, который ускоряет ремиелинизацию. Сейчас этот препарат находится в фазе клинических испытаний, но, возможно, он еще скажет новое слово в лечении рассеянного склероза.
Общие симптомы и признаки рассеянного склероза
Сразу стоит отметить, что протекание заболевания для каждого пациента сугубо индивидуально. У одного человека рассеянный склероз может проявлять очень бурно, а у другого протекать совершенно не заметно. Но к общим симптомам склероза можно отнести: