Невролог
СЕМЕНОВА
Ольга Владимировна
Стаж 5 лет
врач-невролог, заведующий кабинетом диагностики и лечения когнитивных расстройств
Записаться на прием
Полинейропатии (полиневропатии) — группа патологий, поражающих периферические нервы. Клиническая картина определяется формой заболевания, диагностированной у пациента. Специфические признаки — слабость и атрофия мышц, снижение сухожильных рефлексов, нарушение чувствительности, вегетативные расстройства. Лечение полиневропатии осуществляется неврологом. Основной задачей врача становится определение причины развития заболевания. Терапия носит симптоматический характер.
Причины
Причины, приводящие к развитию полинейропатии у пациентов, многообразны. Часто повреждения нервных клеток развиваются на фоне тяжелых отравлений метиловым спиртом, мышьяком или угарным газом. Аналогичным образом на состояние аксонов могут повлиять летучие соединения с высоким содержанием фосфора.
В отдельных случаях симптоматика патологии проявляется на фоне хронических интоксикаций человеческого организма, дифтерии, авитаминоза или сахарного диабета. Заболевание может развиться при уремии, циррозе печени, поражения почек, гипотиреозе или раке. Длительный прием пациентом амиодарона, изониазида или метронидазола может привести к манифестации полиневропатии.
Инвалидность при хр. полинейропатии
Наташа
1752 просмотра
28 ноября 2020
Доброго дня!Жен.,30 лет!Заболела полинейропатией в ноябре 2019,когда заметила резкое снижение зрения на один глаз,за 3 дня с -4 упало до -10,в мрт очаги глиоза,отек,киста шишковидной железы.Пролечили в стационаре,зрение восстановилось,выписали,спустя 2-х месячное лечение я заболела сильно гриппом и…ПНП вернулась.Снова лечение на 2 месяца,но дома,т.к.пришел covid,пролечили,и снова ПНП и так 4 или 5 вспышек.Обратилась.к неврологу вновь,направила обследоваться.Кардиолог-постмиокард.кардиосклероз и редкая экстрасистолия.Ревматолог-остеоартроз,бурсит,трохантерит и остеопороз легк.степ.,спондилоартроз ПОП,сколиоз и остеохондроз.УЗИ почек -киста прав.почки.Эндокринолог-б/о,все хорошо.Другие имеющиеся заболевания:хр.тонзилит,хр.гастрит,хр.холецистит,хр.ж/д анемия,липоматоз,в правом легком эмфизема,киста и пневмофиброз,в носоглот.миндалинах гиперплазия с кистозными включениями.Операции:2010-торакотомия и средн.лобэктомия сред.доли прав.легкого,лимфаадектомия нижнего лимфоузла,2012-апоплексия лев.яичника,2015-лапоротомия,разрыв кисты лев.яичника.ЭНМГ полное отсутствие рефлексов с обеих сторон нижн.конечностей,аксонал.нарушения чувствит.-ти и наруш.рефлекторной возбудимости.Как то в общем так.С работы из-за этого уволили,т.к.частые больничные.Работать не могу,т.к.болевой синдром:онемение конечностей,жжение,покалывание,слабость в теле,боль в коленях,бедрах,спине…Была у терапевта,спросила про оформление инвалидности,т.к.невролог сказала,что ПНП теперь хронической формы и можно пробовать оформить,так хоть на лекарства и постоянные курсы лечения будут деньги,невролог считает что ПНП в следствии нарушения соединит.ткани,либо наследственное,вроде так.Терапевт посмотрел пару бумажек:только ЭНМГ и заключение невролога и сказала,что не дадут мне инвалидность.И говорит что не верит что у меня такие сильные боли,обезболиваться дорогими противосудорожными у меня нет средств.Даже про хр.болезни ничего не спросила и не посмотрела все мои обслед-я.Вопрос,дадут ли мне инвалидность,стоит ли пробовать,имею ли я право?Работоспособность снижена,что делать не знаю.И да,лечение в этот раз не помогает,ни от ревматолога,ни от невролога,легче совсем немного.
Вопрос закрыт
инвалидность
Полиневропатия
Виды
Неврологи выделяют два вида полинейропатий на основании патогенетических признаков поражения периферических нервов — аксональный и демиелинизирующий. Первая форма заболевания поражает длинные цилиндрические отростки нервных клеток, называемые аксонами. Вторая провоцирует утрату миелина миелинизированными нервными волокнами. Поздние стадии аксональных расстройств сопровождаются демиелинизацией. Первичные демиелинизирующие полиневропатии осложняются вторичным поражением цилиндрических отростков нервных клеток.
В процессе диагностики и лечения полинейропатий врачи могут использовать иные классификации заболевания. На основании клинической картины неврологи выделяют моторные, сенсорные и вегетативные полиневропатии. В чистом виде эти типы патологии встречаются редко: у большинства пациентов диагностируется поражение двух или трех видов нервных волокон (моторно-сенсорные, сенсорно-вегетативные и т. д.).
Изучение этиологии заболевания позволяет неврологам выделить наследственные, аутоиммунные, метаболические, алиментарные, токсические и инфекционно-токсические полиневропатии.
Перечень необходимых обследований для МСЭ
Какие группы инвалидности считаются рабочими?
Как и при всех остальных болезнях, получение инвалидности при полинейропатиях подразумевает прохождение определенного минимума обследований, бланки которых впоследствии должны быть предоставлены на МСЭ.
В данный перечень входят:
- Общие (клинические) исследования крови и мочи.
- Диагностика ликвора (необходима для пациентов, страдающих инфекционными полинейропатиями, а также аутоиммунными).
- Офтальмологические, соматические виды диагностики, обусловленные происхождением заболевания.
- ЭМГ (электромиография), ЭНМГ (электронейромиография) (проведение процедур рекомендуется в динамике).
- Вирусологические, бактериологические исследования, исходя из особенности возникновения полинейропатии.
- РВГ (реовазография – изучение кровоснабжения конечностей), тепловизиография.
- Биохимическая диагностика крови и мочи (необходима при токсических, соматических полинейропатиях, а также при порфирийной форме заболевания).
Кроме того, по мнению лечащего врача могут потребоваться и дополнительные виды исследований, что обуславливается особенностями этиологии полинейропатии, характером, а также тяжестью ее протекания.
Симптоматика патологии
Во время осмотра пациента невролог выявляет признаки поражения моторных, сенсорных и вегетативных волокон. Степень вовлеченности этих структур в патологический процесс определяет клиническую картину заболевания. Так, при обнаружении у мужчин и женщин профессиональной полинейропатии неврологи фиксируют сенсорно-вегетативные симптомы (которые связаны с регулярной фиксацией мышц в состоянии статического напряжения).
Преобладание моторных признаков патологии становится причиной развития парезов верхних и нижних конечностей. При отсутствии лечения у пациента атрофируются отдельные группы мышц, в т. ч. дыхательные (на фоне синдрома Гийена-Барре). Позднее снижаются сухожильные рефлексы, человек с трудом выполняет элементарные действия — застегивание пуговиц или завязывание шнурков.
Сенсорная симптоматика развивается симметрично, на ранних этапах затрагивая стопы и кисти пациентов. Расстройство чувствительности проявляется по-разному. Пациенты могут ощущать покалывание, жжение, онемение, боль. На поздних стадиях заболевания взрослые и дети сталкиваются с нарушениями болевой и температурной чувствительности кожных покровов.
Вегетативные нарушения сопровождаются иссушением кожи, нарушением регуляции сосудистого тонуса. Со временем у пациентов появляются признаки тахикардии и нестабильной работы желудочно-кишечного тракта. Мужчины могут столкнуться с эректильной дисфункцией.
Показания для прохождения МСЭ
Лечащий врач направляет пациента для проведения МСЭ, если наблюдаются следующие отклонения здоровья, способные, по его мнению, стать препятствием для выполнения возложенных трудовых обязанностей. К ним относятся:
- Парезы и параличи рук и ног, устойчивый болевой синдром, выраженные трофические и вегетативные нарушения, сенситивная атаксия, признаки прогрессирующей вегетативной недостаточности, значительно ограничивающие жизнедеятельность человека.
- Затяжная временная нетрудоспособность при неблагоприятном либо сомнительном прогнозе, касающемся восстановления чувствительных, двигательных и других функций.
- Периодические рецидивы и прогрессирующее течение болезни с учетом ее происхождения, развитие постгерпетической невралгии.
- Отсутствие возможности возвращения к трудовой деятельности по специальности, обусловленное двигательным дефектом и/или условиями труда, противопоказанными для конкретного человека, если они не могут быть изменены по заключению комиссии.
Механизм развития полинейропатий
Диагностика
Первичные симптомы полинейропатии выявляются неврологом в процессе осмотра пациента. Следующим этапом диагностики становятся лабораторные исследования. Ребенку или взрослому назначаются общеклинический и биохимический анализы крови, генетические и иммунологические тесты. В отдельных случаях выполняется забор биоптата из периферического нерва. Гистологический анализ полученного материала позволит врачам установить характер повреждений нервных волокон.
Ключевым аппаратным методом диагностики полиневропатии остается электромиография. В ходе процедуры врачи исследуют биоэлектрические потенциалы мышц пациента. ЭМГ позволяет оценить интенсивность патологического процесса и исключить из анамнеза ребенка или взрослого другие неврологические заболевания.
По скорости развития выделяют:
- острые полинейропатии развиваются менее чем за четыре недели: наиболее часто это синдром Гийена-Барре;
- подострой полинейропатию называют, если болезнь развивается за 4-8 недель;
- хроническое течение, когда болезнь развивается более двух месяцев (8 недель). Хроническое течение более характерно при алкоголизме, некомпенсированном сахарном диабете, вегетарианстве, или просто неправильном питании, приводящем к дефициту витаминов группы В, наследственных причинах, воспалительных процессах с вовлечением аутоиммунных механизмов, поражающих преимущественно миелиновую оболочку нервов и др..
Кроме вышеуказанных причиной даннного заболевания могут быть: применение нейротоксичных препаратов, проведение химиотрерапии интоксикация солями тяжелых металлов, некоторые хронические соматические заболевания с явлениями недостаточности печени, почек, заболевания эндокринных органов, например, щитовидной железы.
Также полинейропатия возникает при аутоиммунных болезнях, как поражающих преимущественно периферические нервы (синдром Гийена-Барре, мультифокальная моторная невропатия, хроническая воспалительная демиелинизирующая полинейропатия, парапротеинемическая полинейропатия), так и системных болезнях соединительной ткани (ревматоидный артрит, болезнь Съегрена, системная красная волчанка).
В развитии полинейропатии этиологическую роль часто имеют инфекционные факторы как бактериальной природы (боррелиоз, ботулизм, дифтерия,сифилис, Вич-инфекция), так и вирусной( грипп, цитомегаловирус, герпес и др.). Особое место в группе полинейропатий занимают наследственные нейродегенеративные заболевания, такие как транстиретиновая семейная амилоидная полинейропатия, полинейропатия при порфирии, наследственная нейропатия со склонностью к параличам от сдавления.
Лечение
Терапия наследственных форм полинейропатии носит симптоматический характер. Аутоиммунные расстройства доводятся до стадии ремиссии. Диабетический, алкогольный и уремический типы патологии требуют сочетания медикаментозной терапии и ЛФК. На фоне дифтерийной полиневропатии пациентам назначается искусственная вентиляция легких.
Современная фармакология не может предложить страдающим от полинейропатий лицам препараты, эффективно устраняющие повреждения цилиндрических отростков нервных клеток или миелинизированных нервных волокон. Паллиативная терапия включает витаминные комплексы и нейротрофические средства.
Лечение порфирийных полиневропатий предполагает применение глюкозы и обезболивающих препаратов. При демиелинизирующей форме заболевания пациентам назначается мембранный плазмаферез, дополняемый инъекциями иммуноглобулина. При их недостаточной эффективности врачи применяют глюкокортикостероидные средства — преднизолон или его аналоги.
Лечение диабетической полинейропатии нижних конечностей осуществляется не только неврологом — пациенту необходима консультация эндокринолога. При интенсивных болях мужчины и женщины получают трициклические антидепрессанты, прегабалин и габанетин.
Симптоматика токсических полиневропатий становится менее явной при исключении контактов ребенка или взрослого с токсином. При интоксикации лекарственными препаратами врач корректируют суточную дозу, получаемую пациентом.
Хирургическое вмешательство на фоне полинейропатии выполняется при деформации стоп и развитии контрактур суставов. В этом случае пациенту предстоит длительный период реабилитации. При лечении уремической полиневропатии ребенку или взрослому может потребоваться трансплантация почки.
Основы лечения нейропатии
Лечить данное заболевание нужно комплексно, обязательно с коррекцией основной патологии. При аутоиммунных болезнях назначаются гормоны, цитостатики, при диабете — сахароснижающие лекарства или инсулин, при токсическом типе болезни — очищающие методики (гемосорбция, плазмаферез).
Целями терапии нейропатии нижних конечностей являются:
- восстановление нервной ткани;
- возобновление проводимости;
- коррекция нарушений в системе кровообращения;
Реклама: - улучшение самочувствия;
- снижение болевых ощущений и прочих расстройств;
- оптимизация двигательной функции ног;
- повышение скорости обмена веществ.
Существует много методик лечения, основная из них — медикаментозная.
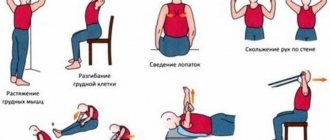
Хирургическое лечение практикуют только при наличии опухолей, грыж, после травм. Всем больным для предотвращения атрофии мышц показаны физические упражнения из специального комплекса ЛФК, в первое время их выполняют под контролем врача-реабилитолога.
При нейропатии следует соблюдать диету с увеличением содержания витаминов гр.В, а также надо исключить алкоголь, продукты с химическими добавками, маринады, жареное, копченое.
Заболевание успешно лечится при помощи физиопроцедур. Отлично зарекомендовали себя массаж, магнитотерапия, лечебные грязи, рефлексотерапия, электростимуляция мышц. Для предупреждения формирования язв следует носить специальную обувь, применять ортезы.
Основные препараты для лечения патологии
В лечении нейропатии препараты играют ведущую роль. Поскольку в основе лежит дегенерация нервной ткани, следует медикаментозным путем восполнять структуру нервных корешков. Это достигается путем применения таких лекарств:
Реклама:
- Нейропротекторы
, ускорители метаболизма в нервных клетках — Пирацетам, Милдронат. Улучшают трофику нервной ткани, помогая улучшить ее структуру. - Антихолинэстеразные препараты
— Ипидакрин, Прозерин. Оптимизируют сенсорную работу нервов, помогают в передаче нервных импульсов. - Антиоксиданты
— Мексидол, Цитофлавин. Способствуют «гашению» действия свободных радикалов, усугубляющих разрушение периферических нервов. - Препараты альфа-липоевой кислоты
. Усиливают метаболизм, усиливают восстановление нейроцитов, особенно показаны при диабетической нейропатии.
В обязательном порядке в курсе терапии применяются витамины группы В, особенно показаны В12, В6, В1. Чаще всего назначаются комбинированные средства — Нейромультивит, Мильгамма в таблетках, уколах. После их приема устраняются расстройства чувствительности, все симптомы уменьшают выраженность.
Чем еще лечат нейропатию?
Реклама:
Очень полезны для организма при любой форме нейропатии нижних конечностей витамины, являющиеся мощными антиоксидантами — аскорбиновая кислота, витамины Е, А. Их обязательно применяют в комплексной терапии заболевания для уменьшения разрушительного влияния свободных радикалов.
При сильных мышечных спазмах больному помогут миорелаксанты — Сирдалуд, Баклофен, которые применяют только с назначения врача — при злоупотреблении они способны увеличить слабость мышц.
Есть и другие лекарства против данной патологии. Они подбираются индивидуально. Таковыми являются:
- гормональные средства для подавления боли, воспалительного процесса — Преднизолон, Дексаметазон
; - сосудистые лекарства для улучшения кровообращения в тканях — Пентоксифиллин, Трентал
; - антидепрессанты, седативные средства, препараты против излишней тревожности — Амитриптиллин, Дулоксетин
; - анальгетики, в том числе наркотические при сильных болях — Трамадол, Анальгин, а также НПВН — Кетопрофен, Кетонал Дуо
.
Местно рекомендуется применять мази с новокаином, лидокаином, нестероидными противовоспалительными средствами, а также согревающие мази с красным перцем, ядами животных. При бактериальном поражении кожи стоп, ног накладывают повязки с антибиотиками (мази Тетрациклиновая, Оксациллин).
Народное лечение нейропатии
Лечение народными средствами используют с осторожностью, особенно, при диабете. Рецепты могут быть такими:
- Соединить желток сырого яйца и 2 ложки оливкового масла. Добавить 100 мл сока моркови, столовую ложку меда. Пить по 50 мл трижды в день после еды. Курс — 14 дней.
- Влить в ведро теплой воды 2/3 стакана уксуса 9%, насыпать стакан соли. Подержать ноги в воде 15 минут. Курс — раз в день месяц.
- Смешать 3 столовые ложки семян пажитника, столовую ложку лаврового листа, все измельчить. Заварить в термосе литром кипятка на час, потом пить по малым порциям в течение дня. Курс — 10 дней.
- Развести голубую глину водой до кашицы, нанести на ноги. Дать высохнуть, потом смыть. Повторять каждый день 2 недели.
При своевременной терапии болезнь имеет хороший прогноз. Даже если причина нейропатии очень тяжелая, ее можно замедлить или остановить прогрессирование, а также повысить качество жизни человека.
Формы алкогольной полинейропатии
Различаются набором симптомов, клинической картиной.
Сенсорная. Проявляется болезненностью в кистях рук, стопах ног (второе чаще), онемением или жжением, судорогами, ощущением зябкости. Чувствительность ладоней к температурным или болевым раздражителем может стать более острой или, наоборот сниженной. Нарушения чувствительности могут быть сегментарными. Часто они возникают вместе с заметными вегетативно-сосудистыми нарушениями (потливость, мраморность кожи на стопах или ладонях или изменением ее оттенка на синюшный). Ряд рефлексов может снижаться.
Двигательная. Сенсорные нарушения при такой форме проявляются в легкой степени, чаще затрагивают ноги. Мышцы слабеют. Часто поражается большеберцовый нерв, из-за чего нарушается сгибание стоп, пальцев ног, человек может ходить на носках, разгибатели стопы и пальцев работают неправильно. В области голеней, стоп может развиваться мышечная атрофия или появляться повышенный тонус мышц. Без лечения парезы (слабость мышц) усиливаются вплоть до паралича, могут появляться боли, онемение, нарушения чувствительности. Эти же симптомы могут возникать и для рук.
Атаксическая. Координация движений и походка нарушаются из-за снижения глубокой чувствительности. В ногах появляется чувство онемения, стопы и ладони становятся нечувствительными, рефлексы снижаются.
Смешанная. При этой форме полинейропатии присутствуют симптомы, характерные для двигательной и сенсорной форм: болезненность, снижение чувствительности, слабость мышц рук, ног, изменение (чаще снижение) рефлексов.
Алкогольная полинейропатия может протекать бессимптомно (есть почти у всех пациентов с хроническим алкоголизмом). В хронической форме симптоматика нарастает постепенно, в течение года или более. В острой или подострой форме она развивается за несколько недель, является более выраженной.
Заказать кодирование от алкоголизма
Опытные врачи Наркологи. В стационаре или на дому. Круглосуточный выезд по Москве и области. Профессионально, анонимно, безопасно.
Заболевания периферической нервной системы у пожилых, несмотря на высокую частоту, являются одним из наименее изученных вопросов в нейрогериатрии. Их распространенность у пациентов до 55 лет составляет от 3,3 до 8%, а в более старшей возрастной группы (60—74 года) достигает 22% [1]. Подавляющее большинство из них составляют пациенты с диабетической полинейропатией (ПНП). У пожилых редко встречаются специфические формы ПНП, однако отдельные формы встречаются чаще и имеют свои клинические особенности в сравнении с более молодыми пациентами. Это связано с возрастными изменениями, происходящими в организме, которые приводят к снижению плотности серого вещества головного и спинного мозга, уменьшением количества нейромедиаторов, гипоталамо-гипофизарной недостаточности, гормональными нарушениями, а также нарушениями других видов обмена. Так, у пожилых наблюдается снижение сенсорных функций всех модальностей (слух, зрение, обоняние, вкус и чувствительность). Возрастные изменения происходят и в периферической нервной системе в виде уменьшения числа нервных волокон, прежде всего толстых миелинизированных волокон, их частичной демиелинизации, уменьшения расстояния между перехватами Ранвье [2, 3]. Дегенеративные процессы в пожилом возрасте наблюдаются не только в миелиновой оболочке периферических нервов, но и в аксонах. Происходит валлеровское перерождение, замедление аксоплазматического тока, что приводит к нарушению трофики мышц. Число и размер сенсорных нейронов в ганглиях задних корешков также уменьшаются, в наибольшей степени страдают волокна, проводящие вибрационную чувствительность. В связи с этим снижение ахилловых рефлексов и порога вибрационной чувствительности в стопах у людей старше 70 лет считается нормой в то время как у молодых пациентов является признаком ПНП. Уменьшение с возрастом числа периферических волокон, признаки демиелинизации и нейрогенного воспаления напоминают патологические изменения при ПНП. При электронейромиографическом исследовании (ЭНМГ) отмечаются более низкие показатели скорости распространения возбуждения по сравнению с молодыми людьми. Так, у лиц 70 лет СРВ на 15—25% меньше в сравнении с 30-летними [2].
Восстановление функций нервов у пожилых пациентов с ПНП происходит медленнее по сравнению с более молодыми, что связано со снижением метаболизма и процессов регенерации в периферических нервах, ухудшением кровоснабжения и трофическими нарушениями. Это обусловлено наличием таких сопутствующих заболеваний, как артериальная гипертензия (АГ), атеросклероз и др.
В пожилом возрасте наиболее часто встречаются следующие ПНП: 1) дисметаболические (диабетическая, при дефиците витамина В12, заболеваниях щитовидной железы, печени, почек); 2) токсическая (алкогольная); 3) аутоимунные (хроническая воспалительная демиелинизрующая, на фоне моноклональной гаммапатии), 4) паранеопластические; 5) амилоидные; 6) идиопатические ПНП тонких волокон.
При обследовании пожилого пациента с ПНП всегда следует проводить дифференциальный диагноз с паранеопластическими ПНП. Симптомы ПНП могут возникать как после появления клинических симптомов опухоли, так и предшествовать им. Наиболее часто они встречаются при раке легкого, желудочно-кишечного тракта, почек, матки и придатков, щитовидной железы и болезнях крови. Отличия в развитии, течении и прогнозе большинства ПНП в пожилом возрасте по сравнению с молодыми пациентами заключаются в более частом поражении вегетативной нервной системы; наличии болевого нейропатического синдрома, который у пожилых требует быстрого и адекватного купирования; неустойчивости при ходьбе и падениях, которые имеют полиэтиологическую природу; трудности подбора эффективной терапии в связи с сопутствующими заболеваниями.
Поражение вегетативной нервной системы наиболее часто встречается при диабетической, алкогольной и амилоидной ПНП. Их выраженность у пожилых пациентов усугубляется нейродегенеративными процессами в головном мозге с поражением вегетативных структур (см. таблицу). Наиболее опасной для жизни является кардиальная автономная нейропатия (КАН). По данным 6-летнего наблюдения за пациентами, страдающими сахарным диабетом (СД), уровень смертности среди них при наличии КАН достигает 29%, тогда как смертность среди пациентов с СД без КАН составляет всего 6% [4]. Одним из самых тяжелых симптомов КАН, ухудшающих качество жизни больных, является ортостатическая гипотензия. Особенностью диабетической ПНП у пожилых пациентов с СД является большая частота АГ, приводящая к увеличению случаев развития КАН. Так, у пациентов с СД 2-го типа без АГ распространенность КАН составляет 48%, в то время как сочетание СД и АГ приводит к развитию КАН в 79% случаев [5]. Это ведет к лабильному течению АГ, так у пациентов с КАН в ночное время отмечается резкое повышение артериального давления (АД) или, наоборот, не отмечается его снижения, характерного для ночного времени суток. Эти факторы увеличивают вероятность развития инсульта и инфаркта миокарда, поэтому пациенты с АГ и СД рассматриваются как группа высокого риска сердечно-сосудистых осложнений.
Поражение систем организма при вегетативной нейропатии
Для предотвращения тяжелых последствий КАН важна ее ранняя диагностика с тем, чтобы как можно раньше начать патогенетическое лечение. Для этого разработаны специальные диагностические тесты — проба с глубоким дыханием (изменение ЧСС при дыхании с частотой 6 раз в мин); тесты Вальсальвы, Шелонга (ортостатическая проба), тест «30:15» (учащение ЧСС при вставании с максимальным значением к 15-му удару с последующим урежением с минимальным значением к 30-му удару); проба с изометрической нагрузкой [6]. Для раннего выявления КАН проводят кардиоваскулярные тесты пациентам с СД 1-го типа через 5 лет от начала заболевания, а пациентам с СД 2-го типа — сразу при постановке диагноза и затем 1 раз в год.
Одной из актуальных проблем геронтологии является неустойчивость пациентов при ходьбе, приводящая к падениям. По данным ВОЗ, падения являются второй по частоте причиной травм и смерти в результате несчастных случаев. Показано, что с возрастом ухудшается состояние систем поддержания равновесия (лобная доля и ее связи, вестибулярный аппарат, мозжечок и его связи, проприоцепция). У пациентов с ПНП неустойчивость при ходьбе и риск падений зависят от степени поражения толстых миелинизированных нервных волокон, приводящего к сенситивной атаксии. Более выражена оно у пациентов с демиелинизирующими ПНП. Однако и диабетическая ПНП с поражением толстых волокон, являясь преимущественно аксональным вариантом, также является независимым фактором нарушения равновесия [7].
Нейропатическая боль наблюдается при диабетической, алкогольной, паранеопластической, амилоидной ПНП. Боли могут быть очень выраженными, что приводит к существенному снижению качества жизни пациентов. Механизмы развития болевого синдрома и старения сходны [8—10]. При обоих состояниях наблюдаются изменения синтеза нейротрансмиттеров и экспрессии рецепторов в спинном мозге. Снижение чувствительности в пожилом возрасте может быть связано с нейропластическими изменениями на уровне заднего рога и функциональными нарушениями нисходящих путей антиноцицептивной системы. На клеточном уровне при старении включаются механизмы, влияющие на функционирование сенсорных нейронов, — снижение экспрессии генов, кодирующих нейротрофические факторы, нейропептиды, внутриклеточные мессенджеры, митохондриальные белки, а также ионные каналы и рецепторы мембран. Уменьшается синтез кальцитонин-ген-родственного пептида, субстанции Р, оксида азота в клетках задних рогов спинного мозга. С возрастом уменьшаются плотность и функциональная активности глиальных клеток спинного мозга, осуществляющих трофические функции. В совокупности вышеописанные изменения ведут к нарушению воротного контроля боли на спинальном уровне.
Говоря о патогенезе заболеваний периферической нервной системы, активно обсуждается роль каналопатий — группы заболеваний, обусловленных нарушением функции натриевых, кальциевых, калиевых, хлорных каналов в мембране клетки. Потенциалзависимые натриевые каналы, кроме участия в генерировании потенциала действия, участвуют в формировании и функционировании нейрональных связей, начиная с раннего эмбрионального периода развития. Механизмы плейотропных эффектов натриевых каналов включают реципрокные взаимодействия между нейронами и глией посредством нейротрансмиттеров, факторов роста, цитокинов. Каналопатии приводят к развитию болевых ПНП и нейродегенерации (например, при рассеянном склерозе) [11].
Каналопатии подразделяются на первичные или генетические (обусловленные мутацией, кодирующих синтез гликопротеина ионных каналов) и вторичные, возникающие вследствие нарушения функции ионных каналов при дисметаболических, токсических или аутоимунных заболеваниях. Эти заболевания вызывают изменение транскрипции ионных каналов, снижение экспрессии генов ионных каналов и открытие других каналов, в норме неактивных. Выделяют 9 альфа-субъединиц потенциалзависимых Na-каналов (Na1.1—1.9). Каждая субъединица имеет определенные функции и различную распространенность. Так, Na1.7 и Na1.8 субъединицы являются ключевыми молекулами, участвующими в формировании периферической нейропатической боли, повышении болевой чувствительности, ассоциированной с воспалением и повреждением ткани. При болевой диабетической ПНП наблюдается подавление функции потенциалзависимых Na 1.6, Na1.7 и Na 1.9 каналов, что вносит свой вклад в развитие аллодинии и гипералгезии.
В основе идиопатической нейропатии тонких волокон, которая нередко встречается у пожилых, также лежит мутация гена, кодирующая гликопротеин канала Nav1.7. Данная форма нейропатии имеет позднее начало, боль у большинства пациентов начинается с дистальных отделов конечностей, реже наблюдается генерализованный болевой синдром. Нередко у таких пациентов встречаются вегетативные нарушения. Некоторые из связанных с болью симптомов (психомоторное возбуждение, повышение АД, рвота, гиперкоагуляция, гипергликемия) являются жизнеугрожающими у пожилых больных с тяжелыми коморбидными заболеваниями. Это диктует необходимость проведения своевременной и адекватной противоболевой терапии.
Имеющиеся на сегодняшний день средства для лечения нейропатической боли, например противоэпилептические препараты (ПЭП), трициклические антидепрессанты (ТЦА), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН), воздействуют только на отдельные проявления нейропатической боли, их длительное применение связано с увеличением количества побочных эффектов: периферических отеков и повышения массы тела (ТЦА и ПЭП из группы габапентиноидов), АГ (ТЦА и СИОЗСиН) и сопряженной с ней ортостатической гипотензии вследствие вегетативной нейропатии и приема антигипертензивных препаратов. При наличии у пожилого пациента помимо боли еще и депрессивных расстройств, назначение ТЦА и СИОЗСиН целесообразно не только во избежание полипрагмазии, но и в силу того, что оба этих расстройства имеют общие патогенетические механизмы — снижение активности антиноцицептивной системы вследствие возрастной инволюции нисходящих серотонинергических и норадренергических путей. В случае наличия у пациента с болью тревожных растройств оптимально применение габапентиноидов (прегабалин, габапентин) и производных гамма-аминомасляной кислоты — ГАМК (баклосан, ноофен), воздействующих также на механизмы порочного круга боль—спазм—боль. Селективные активаторы калиевых каналов (флупиртин) также способны воздействовать на механизмы боли и спазма, подавляя возбудимость нейронов передних и задних рогов спинного мозга, однако гепатотоксичность флупиртина ограничивает его применение у пожилых. Блокаторы натриевых каналов (карбамазепин и окскарбазепин) в меньшей степени влияют на тревогу и на механизмы спазма. Их анальгетическое действие обусловлено подавлением гипервозбудимости и эктопической активности периферических и центральных ноцицепторов за счет стабилизации нейрональных мембран и снижения готовности продуцировать потенциал действия. Этот механизм обусловливает класс-специфические побочные эффекты ПЭП — седацию, атаксию, снижение когнитивных функций, что является нежелательным для пожилых больных.
Одним из наиболее безопасных препаратов для лечения нейропатической боли у лиц пожилого возраста является габапентин (габагамма), стуктурно близкий к тормозному нейромедиатору ГАМК, нейротрансмиттеру, участвующему в передаче и модуляции боли. Предполагается, что центральный анальгетический эффект габапентина развивается вследствие взаимодействия со специфическими α2δ2-кальциевыми каналами, что приводит к снижению потенциала действия мембран аксонов. Габапентин повышает концентрацию ГАМК в цитоплазме нейронов и увеличивает содержание серотонина в плазме крови. Он способен проникать через мембранные барьеры с помощью определенных аминокислотных транспортных механизмов, увеличивать концентрацию и, возможно, синтез ГАМК в ЦНС, блокируя боль на спинальном уровне, предотвращать гибель нейронов ингибированием синтеза глутамата.
Габагамма не только значимо уменьшает выраженность болевого синдрома при болевых ПНП, но и улучшает качество жизни больных, так как частота побочных эффектов (тошнота, головокружение, сонливость, тремор, нистагм, сухость во рту), минимальна за счет гибкой системы дозировок препарата, в отличие от других форм габапентина. Большинство имеющихся на отечественном фармацевтическом рынке форм габапентина имеют две дозировки — 300 и 600 мг, обеспечивающие постепенную титрацию препарата до анальгетической дозы, однако промежуточная дозировка 400 мг, позволяющая оптимизировать индивидуальный подбор дозы для обезболивающей терапии, возможна только при лечении габагаммой.
Анальгетический эффект габапентина в отношении как спонтанных, так и стимулзависимых болей достоверно превышал эффект плацебо при различных формах нейропатических болевых синдромов, прежде всего при диабетической ПНП, однако, в случае, когда пожилому больному назначается только анальгетическая терапия без препаратов, восстанавливающих функцию нерва, исчезновение боли как сигнала опасности не побуждает пациента продолжать лечение, поэтому изолированное симптоматическое лечение боли в конечном итоге приводит к усугублению сенсомоторного дефицита в конечностях, нарастанию проявлений вегетативной нейропатии, формированию вегетативно-трофических расстройств, которые при инфицировании могут стать причиной ампутации конечности. Таким образом, для пожилых пациентов необходимой является патогенетическая терапия, способствующая восстановлению функции периферических нервов, а в ряде случаев и улучшению функций ЦНС. Подобные средства характеризуются купированием основных проявлений нейропатии — как ее симптомов, так и функциональных показателей пораженных нервов [12, 13].
Роль окислительного стресса при старении нервной системы и в развитии ПНП признается ведущей [14—18]. Окислительным стрессом называется процесс повреждения клетки в результате действия свободных радикалов (СР). Большинство их постоянно образуется в клетке — около 5% потребляемого тканями кислорода превращается в СР, но их уровень в норме настолько небольшой, что клетка либо инактивирует их с помощью антиоксидантных систем (восстановленный глутатион, витамины С и Е, коэнзим Q, нейтрализующие короткоживущие СР, превращаясь при этом в долгоживущие или стабильные радикалы, в которых неспаренный электрон делокализован — окисленный глутатион, аскорбат-радикал, токофероксил-радикал, радикалы коэнзима Q) либо заменяет поврежденные молекулы. СР кислорода, образующиеся в качестве побочных продуктов нормального метаболизма в дыхательной цепи митохондрий, а также других цитоплазматических реакций, не вызывают повреждения клетки, однако уровень СР, превышающий ее защитные возможности, вызывает серьезные клеточные нарушения (например, истощение АТФ) и, как результат, разрушение клетки. Один из наименее реактивных СР, супероксид, превращается в более агрессивные (гидроксильный радикал и др.), что может вызвать окисление и разрушение многих клеточных компонентов — белков и липидов мембран, ДНК. В зависимости от интенсивности окислительного стресса клетки могут погибнуть в результате апоптоза или некроза. При некрозе клеточная мембрана разрушается и содержимое клетки высвобождается в межклеточное пространство, в результате чего могут повреждаться окружающие клетки и ткани. Эффект окислительного стресса зависит от силы его выраженности. Клетки могут вернуться в исходное состояние при небольших нарушениях, однако более выраженный окислительный стресс вызывает клеточную смерть. Тем не менее его нельзя рассматривать, как абсолютно вредный для организма. В некоторых случаях, окислительный стресс используется организмом как защитный механизм. Иммунная система использует его для борьбы с антигенами, а некоторые СР служат посредниками (первичные мессенджеры) в передаче сигнала.
Различные органы и ткани в той или иной степени подвержены действию СР и демонстрируют разную устойчивость в процессе реализации окислительного стресса — наименее устойчивы к нему нейроны головного и спинного мозга, а максимальная устойчивость наблюдается в клетках кожи (это вполне объяснимо, ведь кератиноциты живут в пограничных условиях, где доступ кислорода из воздуха практически не ограничен). Именно поэтому окислительный стресс является причиной или важным компонентом таких патологических состояний центральной и периферической нервной системы, как диабетическая и алкогольная ПНП, радикулопатия и компрессионно-ишемические мононейропатии и плексопатии, ишемия головного мозга, нейродегенеративные заболевания, а также является одним из этапов процесса старения. В условиях окислительного стресса угнетается синтез оксида азота (NO) — основного регулятора расслабления сосудистой стенки, и активируется ядерный фактор (NF-kB), инициирующий выделение субстанций, которые ухудшают кровоток, например эндотелина-1. В связи с этим обоснованным представляется применение для патогенетического лечения нейропатий у пожилых пациентов препаратов, обладающих антиоксидантным действием, тиоктовой или альфа-липоевой кислоты (тиогамма), эффективность и безопасность которых доказана в ходе целого ряда двойных слепых рандомизированных плацебо-контролируемых исследований [13—18].
Для активации регенеративных процессов в периферических нервах используются нейротропные витамины группы В (В1, В6, B12). Их одновременное применение стимулирует аксоплазматический транспорт структурных элементов мембраны или миелиновой оболочки, например холина. Тиамин способствует ремиелинизации за счет активации фосфолипазы-A, что усиливает гидролиз эфиров жирных кислот, кроме того посредством усиления энергообеспечения в форме АТФ поддерживает аксоплазматический транспорт, что особенно важно для восстановления трофической функции нервов. Пиридоксин участвует в синтезе транспортных белков и сфингозина — структурного элемента мембраны нервного волокна и нейромедиаторов антиноцицептивной системы (серотонин, норадреналин). Цианокобаламин обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Применение его способствует не только ремиелинизации (за счет активации реакции трансметилирования, обеспечивающей синтез фосфатидилхолина мембран нервных клеток), но и снижению интенсивности болевого синдрома, что связано с собственным антиноцицептивным действием высоких доз цианкобаламина. Нейротропные комплексы витаминов группы В (мильгамма) увеличиивают скорость проведения нервного импульса, улучшают репаративные процессы в периферическом нерве. Начинать терапию пожилых пациентов целесообразно с инъекций мильгаммы (по 2 мл внутримышечно в течение 10 дней) ввиду частого наличия у больных ПНП синдрома мальабсорбции, обусловленного поражением вегетативных волокон, регулирующих деятельность желудочно-кишечного тракта. Одновременно больные могут получать внутривенно по 600 мг тиогаммы-турбо в течение 15 дней. Парентеральное введение обеспечивает максимальную биодоступность антиоксидантов и нейротропных витаминов у пациентов с мальабсорбцией. После окончания курса инъекций необходимо продолжение терапии таблетированными формами (мильгамма-композитум по 1 драже 3 раза в день после еды и тиогамма по 600 мг 1 таблетка утром за 30 мин до еды) в течение 2—6 мес в зависимости от тяжести ПНП и скорости восстановления клинических и нейрофизиологических показателей.
Наивысшую доказательную базу антиоксиданты и витамины группы В имеют в лечении неврологических осложнений СД и алкоголизма, но тем не менее их потенциал в патогенетическом лечении других форм поражения периферической нервной системы у пожилых больных требует дальнейшего изучения. Иногда начало патогенетической терапии приводит к усилению болевого синдрома вследствие усиления периферической афферентации по регенерирующим нервным волокнам, причем болевой синдром при монотерапии витаминами группы В, антихолинэстеразными препаратами или антиоксидантами регрессирует медленнее, чем при симптоматической терапии ТЦА, СИОЗСиН или ПЭП, поэтому при выраженном нейропатическом болевом синдроме в начале лечения целесообразно назначение комбинированной терапии. Наличие ортостатической гипотензии может ограничить применение ТЦА и потребовать добавления симптоматической терапии. Для терапии ортостатической гипотензии используют минералокортикоиды (флудрокортизон ацетат по 0,1—1,0 мг в сут). При неэффективности флудрокортизона или невозможности его применения в качестве монотерапии, назначаются симпатомиметики (эфедрин, фенилпропаноламин, фенилэфрин, метилфенидат, декстроамфетамин, тирамин, мидодрин, иохимбин, DL-дегидроксифенилсерин). Синтетические аналоги вазопрессина (десмопрессина ацетат, лизин-вазопрессин), эритропоэтин, кофеин и ингибиторы циклооксигеназы (индометацин, флурбипрофен, ибупрофен) относят к дополнительным препаратам, не используемым в качестве монотерапии. Существуют нефармакологические методы лечения ортостатической гипотензии, такие как медленное, постепенное изменение положения тела; избегание напряжения, натуживания и изометрических упражнений; использование компенсаторных физических упражнений; отмена гипотензивных препаратов; сон с приподнятым головным концом; диета с высоким содержанием натрия и прием пищи малыми порциями; специальные комбинезоны, сдавливающие нижнюю часть тела; повышенное потребление жидкости (кроме пациентов с сердечной и почечной недостаточностью) [3, 5].
Основным требованием к патогенетическому лечению нейропатий у пожилых больных является снижение болевой симптоматики на фоне улучшения функциональных показателей периферических нервов. Контроль эффективности терапии должен включать в себя оценку симптомов и клинических проявлений нейропатии, а также измерение объективных параметров функций нервов при ЭНМГ-исследовании и тестов на кардиальную автономную нейропатию. При лечении ПНП рекомендуется проведение нейрофизиологических исследований через 3 мес после начала патогенетической терапии. При нормализации объективных показателей функции периферических нервов и вегетативной иннервации лечение можно приостановить. Контроль неврологического дефицита у таких пациентов должен проводиться не реже одного раза в год для решения вопроса о необходимости повторного проведения патогенетической терапии.