: 30 Окт 2021 , Братство кольца , том 88, №3
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
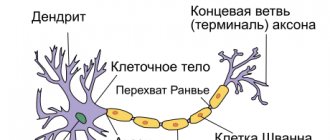
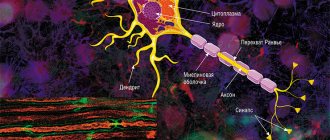
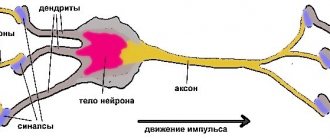
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты
) и длинного (
аксон
) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом – миелиновой оболочкой
, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз
– хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах
, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей – через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать
детский церебральный паралич
в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии
(МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Не все знают, что миелин – это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии
(ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных
) исследований.
Проведение возбуждения в немиелинизированных и миелинизированных нервных волокнах
В безмякотных нервных волокнах возбуждение распространяется непрерывно вдоль всей мембраны, от одного возбужденного участка к другому, расположенному рядом. В отличие от этого в миелинизированных волокнах потенциал действия может распространяться только скачкообразно, «перепрыгивая» через участки волокна, покрытые изолирующей миелиновой оболочкой. Такое проведение называется салътаторным.
Прямые электрофизиологические исследования, проведенные Като (1924), а затем Тасаки (1953) на одиночных миелинизированных нервных волокнах лягушки, показали, что потенциалы действия в этих волокнах возникают только в перехватах, а участки между, перехватами, покрытые миелином, являются практически невозбудимыми.
Плотность натриевых каналов в перехватах очень велика: на 1 мкм2 мембраны насчитывается около 10 ООО натриевых каналов, что в 200 раз превышает плотность их в мембране гигантского аксона кальмара. Высокая плотность натриевых каналов является важнейшим условием сальтаторного проведения возбуждения. Схема на рис. 46 позволяет понять, каким образом происходит «перепрыгивание» нервного импульса с одного перехвата на другой.
В состоянии покоя наружная поверхность возбудимой мембраны всех перехватов (перехватов Ранвье) заряжена положительно. Разности потенциалов между со седними перехватами не существует. В момент возбуждения поверхность мембраны перехвата А становится заряженной электроотрицательно по отношению к поверхности мембраны соседнего перехвата Б. Это приводит к возникновению местного (локального) электрического тока, который идет через окружающую волокно межтканевую жидкость, мембрану и аксоплазму в направлении, показанном на рис. 46 стрелкой. Выходящий через перехват Б ток возбуждает его, вызывая перезарядку мембраны. В перехвате А возбуждение еще продолжается, и он на время становится рефрактерным. Поэтому перехват Б способен привести в состояние возбуждения только следующий пере хват В и т. д.
«Перепрыгивание» потенциала действия через межперехватный участок оказывается возможным только потому, что амплитуда потенциала действия в каждом перехвате в 5—6 раз превышает пороговую величину, необходимую для возбуждения соседнего перехвата. При определенных условиях потенциал действия может «перепрыгнуть» не только через один, но и через два межперехватных участка. Такое наблюдается, в частности,’в том случае, если возбудимость соседнего перехвата снижена каким-либо фармакологическим агентом, например новокаином, кокаином и др.
| V V |
Время, необходимое для передачи возбуждения от одного перехвата другому, примерно одинаковое у волокон различного диаметра (при температуре 24 °С оно составляет около 0,07 мс). Длина межперехватных участков, как отмечалось, пропорциональна диаметру нераного волокна. Отсюда следует, что в миелинизированных
| 2. | |
| 3 д ‘-Л | |
| 4 Д | |
| ■J | \ |
| ‘.Л | |
| ^———— | |
| ШМ | 1ШШШ |
Рис. 47. Ответы седалищного нерва лягушки на электрические стимулы возрастающей силы.
Отведение потенциалов действия двухфазное. В начале каждой записи виден артефакт раздражения. Сила тока увеличивается постепенно от I к 6. Отметка времени —1 мс.
Рис. 46. Сальтаторное распространение возбуждения в мнкотном нервном волокне от перехвата к перехвату.
Стрелками показано направление тока, возникающего между возбужденным (А) и соседним покоящимся (Б) перехватом.
волокнах скорость проведения нервного импульса примерно пропорциональна их диаметру. В этом отношении миелинизи- рованные волокна отличаются от безмякотных, у которых скорость проведения пропорциональна не диаметру, а корню квадратному из его величины.
Проведение возбуждения по миелинизированному нервному волокну часто сравнивают с передачей сигналов по электрическому кабелю с ретранслирующими генераторами (например, трансатлантическому кабелю). Действительно, участки нервного волокна между перехватами по своим электрическим свойствам подобны кабелю, погруженному в жидкость, обладающую высокой электропроводностью. Внутренним проводником является аксоплазма, внешним — межклеточная жидкость, а изолятором — жировая миелиновая оболочка. Импульс, проходящий между перехватами, представляет собой импульс электрического тока. Перехваты Ранвье играют роль ретранслирующих генераторов, т. е. промежуточных усилительных станций линии связи. При передаче сигнала каждый следующий перехват возбуждается импульсом, генерируемым предыдущим, вырабатывает новый импульс и передает его по волокну. Поскольку сопротивление внутреннего проводника на единицу длины очень велико (в 106 раз больше, чем медной проволоки того же диаметра), ретранслирующие генераторы должны быть расположены’близко друг к другу, иначе импульс угаснет.
Предположение о скачкообразном распространении возбуждения в нервных волокнах впервые было высказано Б. Ф. Вериго (1899). Такой способ проведения имеет ряд преимуществ по сравнению с непрерывным проведением в безмякотных волокнах: во-первых, «перепрыгивая» через сравнительно большие участки волокна, возбуждение может распространяться со значительно большой скоростью, чем при непрерывном проведении: по безмякотному волокну того же диаметра; во-вторых скачкообразное распространение является энергетически более экономным, поскольку в состояние активности приходит не вся мембрана, а только ее небольшие участки в области перехватов, имеющие ширину менее 1 мкм. Потери ионов (в расчете на единицу длины волокна), сопровождающие возникновение потенциала действия в таких ограниченных участках мембраны, очень невелики, а следовательно, малы и энергетические затраты на работу натрий-калиево- го насоса, необходимые для восстановления измененных ионных соотношений между внутренним содержимым нервного волокна и тканевой жидкостью.
составной характер потенциала действия нервного ствола и
классификации нервных волокон
Амплитуда электрических импульсов, отводимых от целого нервного ствола, зависит от силы приложенного раздражителя. Раздражителю слабой силы соответствует
| j—1 I L |
| 100 — 75 -60 — |
| i I I I i III |
с
25 50 75 100 125 150 175 200 225 250 275 300
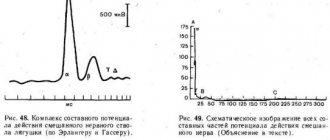
Рис. 48. Комплекс составного потенциала действия смешанного нервного ствола лягушки (по Эрлангеру и Гассеру).
Рис. 49. Схематическоое изображение всех составных частей потенциала действия смешанного нерва (Объяснение в тексте).
небольшой ответ; по мере усиления раздражения амплитуда потенциала возрастает, достигая максимальной величины, и затем остается постоянной, несмотря на дальнейшее увеличение силы раздражителя (рис. 47). Объясняется это тем, что электрический ответ целого нервного ствола является алгебраической суммой потенциалов действия отдельных его волокон. В каждом волокне амплитуда потенциала действия не зависит of силы раздражения в соответствии с законом «все или ничего». Пороги раздражения отдельных волокон отличаются друг от друга. При слабой силе стимула возбуждение возникает в наиболее возбудимых поверхностно расположенных нервных ‘волокнах. Усиление стимула приводит к увеличению числа возбужденных волокон, поэтому суммарный ответ на раздражение увеличивается до тех пор, пока все волокна не вовлекаются в реакцию.
Такую картину можно наблюдать, если отводящие электроды расположить на нерве вблизи раздражающих электродов. При увеличении расстояния между этими двумя парами электродов суммарный потенциал действия начинает расчленяться на несколько отдельных колебаний, которые становятся наиболее отчетливо выраженными при удалении отводящих электродов на 10—15 см от места раздражения (рис. 48). Впервые это явление было подробно изучено Эрлангером и Гассером (1937). Они показали, что причиной расчленения суммарного потенциала действия на компоненты является неодинаковая скорость проведения возбуждения по разным волокнам, вследствие чего к отводящим электродам нервные импульсы поступают по этим волокнам неодновременно.
В настоящее время нервные, волокна по скорости проведения возбуждения, длительности различных фаз потенциала действия и строению принято подразделять на три основных типа, обозначаемых буквами А, В и С (рис. 49).
Волокна типа А делятся на четыре подгруппы: ос, (5, у, б. Они покрыты миелиновой оболочкой. Наиболее толстые их них а-волокна (Аа), у теплокровных животных и человека они имеют диаметр 12—22 мкм и характеризуются значительной скоростью проведения возбуждения — 70—120 м/с. Такие волокна проводят возбуждение от моторных нервных центров спинного мозга к скелетным мышцам (двигательные волокна) и от определенных рецепторов мышц к соответствующим нервным центрам. Пик потенциала действия волокна Аа у теплокровных длится 0,4—0,5 мс. После его окончания развивается следовая деполяризация, которая продолжается 15—20 мс и переходит в следовую гиперполяризацию длительностью около 40—60 мс.
Три другие группы волокон типа А: Ар, Ау и А5 — имеют меньший диаметр, меньшую скорость проведения и более длительный потенциал действия. Это преимущественно чувствительные волокна, проводящие возбуждение от различных рецепторов (тактильных, некоторых болевых, температурных и рецепторов внутренних органов) в ЦНС.
Исключение составляют лишь у-волокна, значительная часть которых проводит возбуждение в центробежном направлении от клеток спинного мозга к так называемым интрафузальным мышечным волокнам, входящим в состав рецепторов мышц — мышечных веретен (см. рис. 51, А).
К волокнам типа В относятся миелинизированные, преимущественно преганглио- нарные, волокна вегетативной нервной системы. Скорость проведения возбуждения в этих волокнах у теплокровных животных составляет 3—18 м/с. Продолжительность потенциала действия волокон типа В (1—2 мс) примерно в 3 раза превышает длительность потенциала действия волокон типа А. Отличительной особенностью этих волокон является то, что в них не обнаруживается фаза следовой деполяризации: нисходящее колено пика непосредственно переходит в следовую гиперполяризацию, которая в ряде случаев продолжается более 100 мс.
К волокнам типа С относят безмякотные нервные волокна очень малого диаметра (примерно 1 мкм). Скорость проведения возбуждения в этих волокнах не более 3 м/с. Большинство волокон типа С — это постганглионарные волокна симпатической нервной системы.
К волокнам типа С относят также те нервные волокна, которые участвуют в проведении возбуждения от болевых рецепторов и некоторых рецепторов холода, тепла и давления.
Потенциалы действия волокон этого типа характеризуются наибольшей продолжительностью (2 мс у теплокровных животных)., Они имеют длительную фазу следовой деполяризации (50—80 мс), сопровождающуюся еще более продолжительной (300 — 1000 мс) следовой гиперполяризацией. Все эти данные суммированы в табл. 3.
| Таблица 3 ⇐ Предыдущая3Следующая ⇒ Рекомендуемые страницы: |
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции
(МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh
et al
., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al
., 2017).