Проблема лечения больных, перенесших позвоночно-спинномозговую травму, является одной из самых сложных в системе нейрореабилитации. Такие пациенты психологически и/или экономически зависимы от своих близких и от социума, так как зачастую значительно ограничены в перемещениях и у них нарушено естественное функционирование жизненно важных систем организма [1, 2].
Многочисленные современные исследования продемонстрировали большие перспективы использования электрической стимуляции спинного мозга в двигательной реабилитации пациентов с отдаленными последствиями травмы спинного мозга. Доказано, что через несколько лет после травмы, после полного паралича, пациенты могут самостоятельно стоять, ходить после курса реабилитации с применением эпидуральной электрической стимуляции спинного мозга [3—5]. Доказано, что механизм действия эпидуральной и чрескожной электрической стимуляции спинного мозга (ЧЭССМ) единый [6]: ЧЭССМ также, как и эпидуральная электрическая стимуляция, может успешно применяться для восстановления двигательных функций пациентов, парализованных после травмы спинного мозга вследствие его полного моторного поражения [7—9].
Особенностью большинства предшествующих работ, показавших возможности электрической стимуляции спинного мозга в восстановлении произвольных движений и самостоятельного поддержания вертикальной позы, является то, что регулярные, часто ежедневные, стимуляционные воздействия и сопутствующие двигательные тренировки длились по 5—9 мес и все двигательные тренировки осуществлялись усилиями 2—3 методистов в присутствии физиолога или врача [4, 5, 10]. То есть впечатляющие результаты были достигнуты за длительный промежуток времени с привлечением большого числа специалистов. Фактически, подавляющее большинство работ в этой области — дорогостоящие научные исследования, проведенные в специфических экспериментальных условиях на селектированных в соответствии с требованиями конкретного исследования пациентах. Остается неясным, насколько вне ограничений и условий эксперимента эффективен курс электрической стимуляции спинного мозга для восстановления двигательной активности пациентов, перенесших травму спинного мозга.
Травма спинного мозга сопровождается не только двигательными нарушениями. Важным является оценка эффективности и безопасности процедур электрической стимуляции спинного мозга прежде всего для восстановления опорожнения мочевого пузыря, кишечника и половой функции у пациентов с травмой спинного мозга, так как наибольшие страдания спинальным пациентам приносят нарушения именно этих функций [11]. Ранее было показано, что стимуляция спинного мозга с параметрами, используемыми для восстановления двигательных функций, влияет на мочевыделительные функции [12, 13]. Недавно опубликованы результаты уродинамического исследования, показавшего, что у пациентов со спинномозговой травмой, не контролирующих функции мочевого пузыря, однократная ЧЭССМ на уровне позвонков Тh11—12 уменьшает гиперактивность детрузора, регулирует рассогласованность детрузора и сфинктера, увеличивает наполняемость мочевого пузыря и облегчает мочеиспускание [14]. Таким образом, можно ожидать, что краткосрочный курс электрической стимуляции спинного мозга, направленный на восстановление двигательной активности, может положительно влиять на реабилитацию выделительных функций.
Цель исследования — определить эффективность использования ЧЭССМ в сочетании со стандартной реабилитацией пациентов, перенесших спинномозговую травму. Дополнительная цель — оценить влияние ЧЭССМ на выделительные функции у пациентов со спинномозговой травмой.
Материал и методы
Исследования проведены на базе СПб ГБУЗ «Городская больница № 40». Цель, задачи и протокол исследования были одобрены научной проблемной комиссией (протокол № 142). От пациентов получено информированное письменное согласие на участие в исследовании.
Критерии включения в исследование: возраст от 18 лет, средне- и нижнегрудной уровень травмы, срок травмы более 9 мес, тяжесть травмы спинного мозга по шкале Американской ассоциации спинальной травмы (American Spinal Injury Association — ASIA) — В или С, тонус мышц нижних конечностей по модифицированной шкале Эшворта — 2 или 3 балла.
Критерии исключения: выраженные сопутствующие заболевания в стадии декомпенсации, повреждения кожных покровов в зоне расположения электродов, наличие нестабильности в элементах опорно-двигательного аппарата, психические заболевания.
В исследовании приняли участие 15 пациентов со спинномозговой травмой в позднем периоде (табл. 1;
Таблица 1. Описание участников исследования. Изменение показателей двигательной активности до и после курса лечения Примечание. * — пациенты проходили реабилитацию амбулаторно. Курсивом выделены пациенты женского пола, фоном — различия показателей до и после курса лечения, жирным шрифтом — положительная динамика, обычным шрифтом — отрицательная динамика. пациенты ранжированы внутри каждой группы по длительности периода после травмы). Все пациенты проходили стандартный курс восстановительного лечения. Восстановительный курс состоял из занятий лечебной физической культурой, механотерапии, в том числе роботизированной («Lokomat», Hocoma, Швеция), массажа, физиотерапии, выполняемых ежедневно, по 10 процедур на курс. Длительность исследования составила ~2 нед.
Основную группу (№№ 1—7 в табл. 1) составили пациенты, согласившиеся на проведение процедуры ЧЭССМ. Они получали стандартный курс терапии и процедуры ЧЭССМ. Пациенты контрольной группы (№№ 8—15 в табл. 1) получали только стандартное лечение.
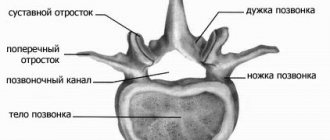
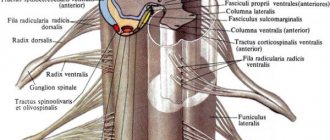
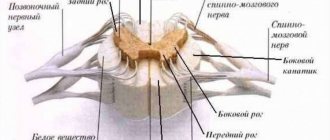
Для ЧЭССМ применялся аппарат БиоСтим-5 (ООО «Косима»). Электроды (WFB02 QWER, Китай; BF4, LEAD-LOC, Inc., США) с адгезивным токопроводящим слоем фиксировали накожно. Стимулирующий электрод (катод) в виде диска диаметром 2,5 см располагали на средней линии позвоночника между остистыми отростками на 3 уровнях: С5—6, Th11—12 и L1—2. Индифферентные электроды (аноды) помещали симметрично над гребнями подвздошных костей. Стимуляция осуществлялась прямоугольными импульсами (монополярными и/или биполярными) длительностью 1 мс, заполненными несущей частотой 10 кГц. Величину тока подбирали индивидуально, чтобы он не был болезненным и в то же время вызывал сокращение мышц нижних конечностей. Диапазон амплитуды использованных токов составлял 30—120 мА. В течение процедуры величину тока постепенно увеличивали на 20—40 мА. Частота импульсов составляла 15—30 Гц. ЧЭССМ проводили одновременно с двигательной тренировкой на тренажере для активно-пассивной реабилитации верхних и нижних конечностей (Thera vital, «Medica Medizintechnik», Германия). Режим тренировки подбирали индивидуально в зависимости от функциональных способностей больных и поставленных реабилитационных задач. Также для улучшения статики использовали упражнения сидя на стуле, стоя в коленоупоре с постепенным уменьшением площади опоры. При выборе параметров стимулирующих воздействий ориентировались на результаты использования ЧЭССМ для регуляции локомоторных [8] и постуральных функций [10] у пациентов с вертебро-спинальной патологией.
Длительность комплексной процедуры составляла 30 мин, на курс 10 процедур, проводимых ежедневно 5 раз в неделю.
В оценке неврологического статуса пациентов до и после курса лечения применялись стандартные шкалы. Для определения тяжести спинальной травмы по показателям чувствительности и мышечной силы использовали шкалу ASIA/ISNCSCI (International Standards for Neurological and Functional Classification of Spinal Cord Injury — Международные стандарты неврологической и функциональной классификации повреждений спинного мозга). Для определения мышечной спастичности применяли шкалу Эшворта. Силу мышц-сгибателей и мышц-разгибателей бедер, голеней и стоп оценивали по 6-балльной шкале Британского совета медицинских исследований (Harrison scale) [15]. Также в состав стандартного неврологического осмотра входило определение уровня гипо- и анестезии, наличия глубокой чувствительности и мышечно-суставного чувства. Пациенты заполняли дневник мочеиспускания, в котором отмечали позывы к мочеиспусканию и его контроль. Количество остаточной мочи контролировали с помощью катетеризации мочевого пузыря или ультразвукового исследования. Все исследования проводили перед началом реабилитационного курса и сразу после его завершения.
Статистический анализ изменений мышечной силы и чувствительности проводили с использованием критерия Стьюдента и непараметрического критерия Вилкоксона, сравнивая значения для обеих ног пациента, не усредняя их. Различия между показателями считались статистически значимыми при р
<0,05 по каждому из критериев. Остальные показатели сравнивали с применением критериев Манна—Уитни или Вилкоксона.
3.Подготовки к операции по имплантации электродов
Поскольку в результате операции в организм больного попадёт и будет длительно размещено инородное тело, необходимо проведение профилактических мероприятий для исключения риска инфицирования и развития иных осложнений:
- обследование общего состояния больного на предмет переносимости оперативного лечения (сердечно-сосудистой и дыхательной системы, иммунного статуса и фоновых заболеваний);
- выявление возможных латентных инфекций методом бакпосева соскоба из носа, глотки, промежности (особую опасность представляет Staphylococcus aureus);
- антибиотикотерапия (при выявлении инфекций одновременно оценивается чувствительность бактерий к разным группам антибиотиков, что учитывается при выборе препаратов);
- согласование с пациентом возможной локализации подкожного генератора.
О нашей клинике м. Чистые пруды Страница Мединтерком!
Результаты
Средний возраст пациентов в контрольной группе составил 27,9±3,80 года, в основной группе — 29,9±8,07 года. Усредненный период после травмы 2,8±2,21 и 1,9±1,06 года в контрольной и основной группах соответственно. Статистически достоверных отличий между группами по этим параметрам нет. Показатели спастичности в контрольной и основной группах составили 2,7±0,39 и 2,1±0,35 балла по шкале Эшворта соответственно. Исходно по балльным оценкам мышечной силы, чувствительности, регистрируемым показателям мочевыделительной системы группы были однородны между собой, не имели статистически значимых различий (см. табл. 1 и 2).
Таблица 2. Изменения показателей чувствительности и выделительной функции до и после курса лечения Примечание. * — 0 — контроль отсутствует, 1 — частичный контроль, 2 — полный контроль; ** — 0 — >100 мл, 1 — 50—100 мл, 2 — <50 мл. Фоном выделены различия показателей до и после курса лечения, жирным шрифтом — положительная динамика, курсивом — пациенты женского пола.
В ходе проведения восстановительного лечения никакие нежелательные явления (болезни, травмы, незапланированные оперативные вмешательства и др.) не произошли. Отмечено увеличение спастичности на 1 балл в конце курса у 1 пациента из основной группы (О8) и 2 больных из контрольной группы (К5, К9).
По результатам исследования мышечной силы все пациенты основной группы, у которых в начале курса регистрировалась мышечная сила в нижних конечностях, отметили ее улучшение до 2—3 баллов (пациенты О5, О8, О10, О12), еще у 2 больных, у которых ранее отсутствовала мышечная активность в нижних конечностях, появилась мышечная сила до 2 баллов (пациенты О2, О4). Субъективно пациенты отмечали, что во время проведения процедуры ЧЭССМ им легче заниматься на тренажере, стоять или выполнять другие задания врача, они начали ощущать напряжение, работу мышц нижних конечностей, улучшилась их регуляция, что значительно повлияло на эмоциональный настрой пациентов и дальнейшую мотивацию к занятиям.
В контрольной группе у 1 пациента, у которого регистрировалась мышечная сила в начале курса, также отмечено ее увеличение до 2 баллов (пациент К10).
Сравнение балльных оценок мышечной силы, зарегистрированных до и после курса с помощью статистических критериев, выявило в основной группе достоверный прирост силы мышц-сгибателей и мышц-разгибателей бедра и мышц-разгибателей голени (p
<0,05 как по критерию Вилкоксона, так и по критерию Стьюдента). Статистический анализ изменений мышечной силы в контрольной группе показал достоверный прирост силы мышц-сгибателей и мышц-разгибателей бедра по критерию Вилкоксона (
p
<0,01) и недостоверный по критерию Стьюдента (
p
=0,838). Из-за впечатляющих различий между значениями вероятностей, рассчитанных по 2 критериям, заключение о статистической значимости изменений показателей мышечной силы в контрольной группе не сделано.
При исследовании чувствительности (см. табл. 2) у 1 пациента основной группы уровень анестезии опустился на 1 сегмент. Еще у 2 пациентов появились глубокая чувствительность и мышечно-суставное чувство в коленных суставах (пациенты О2, О10). Сравнение балльных оценок чувствительности, зарегистрированных до и после курса с помощью статистических критериев, не выявило достоверных различий.
В контрольной группе изменение чувствительности после курса отмечено не было.
Прирост по шкале ASIA в основной группе составил от 1 до 8 баллов. Пациентам О2 и О4 переквалифицировали уровень и степень тяжести травмы по этой шкале с В на С (см. табл. 1).
Прирост по шкале ASIA в контрольной группе не превысил 1 балла.
После анализа дневников мочеиспускания, которые вели пациенты, было выявлено, что в основной группе у 1 из 3 больных, не контролировавших мочеиспускание, появились позывы к мочеиспусканию, также у него восстановился частичный контроль мочеиспускания (пациент О2). Еще у 1 пациента (О3) также появился частичный контроль мочеиспускания. В обоих случаях эффект ЧЭССМ на мочевыделительную функцию был отмечен после 3—5 процедур. В начале курса у 4 пациентов основной группы (О2, О3, О5, О8) количество остаточной мочи составляло более 100 мл. В конце курса ЧЭССМ у 2 пациентов (О3 и О8) после мочеиспускания оставалось от 50 до 100 мл мочи, а у 1 больного (О2) — менее 50 мл, что соответствует нормальным показателям и позволило ему реже катетеризироваться. В целом по группе различия анализируемых показателей мочевыделительной функции статистически недостоверны.
В контрольной группе анализируемые показатели мочевыделительной функции остались без изменений после курса лечения.
Как работает нейромодуляция
Нейромодуляция работает либо путем активной стимуляции нервов для получения естественной биологической реакции, либо путем применения целевых фармацевтических агентов в крошечных дозах непосредственно к месту действия.
Устройства нейростимуляции включают приложение электродов к головному, спинному мозгу или периферическим нервам. Эти точно размещенные электроды через удлинитель подключаются к генератору импульсов и источнику питания, который генерирует необходимую электрическую стимуляцию. Электрический ток низкого напряжения проходит от генератора к нерву и может либо подавлять болевые сигналы, либо стимулировать нервные импульсы там, где они раньше отсутствовали.
В случае фармакологических агентов, доставляемых с помощью имплантированных насосов, лекарство можно вводить в меньших дозах, поскольку оно не должно метаболизироваться и проходить через тело до достижения целевой области. Меньшие дозы – в диапазоне 1/300 пероральной дозы – могут означать меньшее количество побочных эффектов, повышение комфорта пациента и улучшение качества жизни.
Нейромодуляция, будь то электрическая или магнитная, использует естественный биологический ответ организма, стимулируя активность нервных клеток, которые могут влиять на популяцию нервов, высвобождая медиаторы-передатчики, такие как дофамин, или другие химические соединения-посредники, такие как пептидное вещество P, которые могут модулировать возбудимость и паттерны возбуждения нейронных цепей. Также могут быть созданы более прямые электрофизиологические эффекты на нервные мембраны, такие как механизм действия электрического взаимодействия с нервными элементами. Конечный эффект – это «нормализация» функции нейронной сети от ее возбужденного состояния. Предполагаемые механизмы действия для нейростимуляции включают деполяризующую блокаду, случайную (стохастическую) нормализацию потенциала действия (нервного импульса), аксональную блокаду, уменьшение кератоза нервных импульсов и подавление колебаний нервной сети.2 Хотя точные механизмы нейростимуляции неизвестны, эмпирическая эффективность привела к широкому применению данного метода в клинической практике.
Существующие и новые методы лечения нейромодуляции также применяют при лекарственно-устойчивой эпилепсии3, при хронической головной боли и в функциональной терапии, начиная от мочевого пузыря и кишечника или контроля дыхания до улучшения сенсорных нарушений, таких как слух (кохлеарные имплантаты и слуховые имплантаты ствола мозга) и зрение (имплантаты сетчатки).4 Технические улучшения включают тенденцию к минимально инвазивным (или неинвазивным) системам; а также более мелкие и сложные устройства, которые могут иметь автоматическое управление с обратной связью5 и совместимость с магнитно-резонансной томографией.6
Нейромодуляционная терапия была исследована для лечения других хронических состояний, таких как болезнь Альцгеймера,78 депрессия, хроническая боль,910 а также в качестве дополнительного лечения при восстановлении после инсульта.1112
Обсуждение
Основным результатом проведенного исследования является доказательство эффективности использования ЧЭССМ в двигательной нейрореабилитации. В результате проведенного курса лечения у ряда пациентов отмечалось улучшение двигательной и выделительной функций. Так, после 2-недельного курса ЧЭССМ в сочетании с двигательной терапией и стандартным курсом восстановительного лечения, состоящего из массажа, лечебной физической культуры, механотерапии, у 6 из 7 пациентов отмечено увеличение мышечной силы нижних конечностей, у 3 — улучшение показателей чувствительности. После завершения курса 2 пациентам степень тяжести травмы уменьшена с ASIA B до ASIA C.
Ранее проведенное исследование, в котором была использована ЧЭССМ в ходе короткого курса двигательной реабилитации, было направлено на изучение сочетанного влияния стимуляции спинного мозга и активации серотониновых рецепторов, поэтому в нем не было группы пациентов, которым не проводили стимуляцию [16]. Группу участников составляли как пациенты с травмой спинного мозга, так и больные с ятрогенной миелопатией, курс состоял из 16—17 получасовых процедур ЧЭССМ на фоне механотерапии, половина пациентов получали буспирон — агонист серотониновых рецепторов. В результате курса в среднем по группе было получено достоверное увеличение мышечной силы, чувствительности. Однако невозможно связать достигнутые после курса реабилитации результаты только с ЧЭССМ из-за отсутствия контрольной группы пациентов, которым ЧЭССМ не проводили.
Таким образом, мы впервые в контролируемом исследовании показали, что ЧЭССМ эффективна в краткосрочном курсе реабилитации двигательных функций у пациентов с тяжестью травмы спинного мозга ASIA В и С. Если обратиться к исследованиям, в которых было продемонстрировано, что многомесячный курс электрической стимуляции спинного мозга приводит к восстановлению самостоятельной ходьбы у пациентов с тяжелыми двигательными нарушениями [3—5], станет очевидным, что длительный процесс восстановления ходьбы состоял из переходивших один в другой коротких курсов, в ходе которых решались определенные реабилитационные задачи. У пациентов последовательно восстанавливали: произвольные движения ног в условиях их внешней поддержки (когда сила тяжести была компенсирована), способность поддержания вертикальной позы, независимой регуляции шагательных движений для правой и левой ноги по отдельности. Это дает основание полагать, что 2—3-недельные курсы ЧЭССМ можно применять в условиях стационарной или амбулаторной реабилитации спинальных пациентов для многоэтапного восстановления тяжелых двигательных нарушений, усложняя восстанавливаемые двигательные навыки на каждом последующем этапе.
В основной группе у 1 пациента увеличилась спастичность нижних конечностей на 1 балл после курса ЧЭССМ. Следует отметить, что и в цитированном выше исследовании [16] также зарегистрировано увеличение спастичности на 0,5 балла после курса ЧЭССМ. В нашем исследовании также и в контрольной группе наблюдался прирост спастичности в конце курса у 2 пациентов. Представляется маловероятным, что это связано именно со стимуляцией спинного мозга. Известно, что в некоторых случаях электрическую эпидуральную стимуляцию спинного мозга применяют для уменьшения спастичности. В частности, было проведено исследование возможности использования электрической стимуляции спинного мозга для уменьшения спастичности у пациентов с детским церебральным параличом и заболеваниями и травмой спинного мозга [17]. Показано, что стимуляция на уровне Th11 с частотой 100—130 Гц, длительностью импульса 120—300 мс, амплитудой 1,5—4 В на протяжении нескольких лет приводила к снижению спастичности в обеих группах. У спинальных пациентов спастичность уменьшилась с 3,71±0,61 балла перед имплантацией стимулятора до 2,26±0,56 балла после 1—9 лет стимуляции. Однако авторы недавно опубликованного обзора [18] большого числа публикаций, в которых были описаны случаи уменьшения спастичности нижних конечностей вследствие электрической стимуляции спинного мозга, сомневаются в обоснованности выводов этих исследований из-за недостатков методологии проведенных исследований, из-за технологических ограничений имплантируемого оборудования и отсутствия полного понимания механизмов спастичности. Таким образом, влияние ЧЭССМ на спастичность предстоит еще исследовать.
Спинальные травмы в большом числе случаев вызывают нарушения произвольного мочеиспускания [19, 20]. В норме функционирование мочевого пузыря связано с сегментами спинного мозга T11—L2 и S2—S4 [21]. Для реабилитации двигательных функций нижних конечностей, как правило, проводят электрическую стимуляцию спинного мозга на уровне T12—L4 [4—6]. В связи с этим закономерны ожидания того, что, стимулируя спинной мозга для восстановления двигательных функций, возможно влиять на выделительные функции. В исследованиях на спинальных животных было показано, что электрическая стимуляция спинного мозга с параметрами, используемыми для двигательной реабилитации, влияет на функцию мочеиспускания [12, 13]. Уродинамическое исследование было проведено на спинальных пациентах в процессе процедуры ЧЭССМ на уровне позвонка Т11 [14]. В этом исследовании было получено, что стимуляция с частотой 30 Гц уменьшает гиперактивность детрузора, диссинергию детрузора и сфинктера, а стимуляция с частотой 1 Гц инициирует опорожнение мочевого пузыря. В нашем исследовании было получено, что курс ЧЭССМ с аналогичными параметрами стимуляции приводит к частичной нормализации мочевыделительной функций у 3 из 7 пациентов. Таким образом, двигательная реабилитация с применением ЧЭССМ может сопровождаться улучшением выделительных функций и очевидно, что требуются дальнейшие исследования для того, чтобы использовать ЧЭССМ для регуляции произвольного мочеиспускания после травмы спинного мозга.
4.Имплантация и реабилитация после операции
Имплантация и внедрение всех элементов системы для эпидуральной стимуляции включает следующие этапы:
- 1. установка электродов;
- 2. тестовый период (5-7 дней);
- 3. если тестирование дало существенный положительный эффект, электроды закрепляются к интерспинальным связкам;
- 4. имплантация генератора подкожно;
- 5. соединение проводами элементов системы;
- 6. программирование генератора под конкретную клиническую ситуацию;
- 7. послеоперационная реабилитация и обучение пациента самопомощи.
Неинвазивные магнитные методы
Магнитные методы нейромодуляции обычно неинвазивны: для проникновения магнитного поля в тело не требуется хирургического вмешательства, поскольку магнитная проницаемость ткани аналогична проницаемости воздуха. Другими словами: магнитные поля очень легко проникают в тело.
Эти два основных метода тесно связаны между собой, поскольку оба используют изменения напряженности магнитного поля для создания электрических полей и ионных токов в теле. Однако есть различия в подходе и оборудовании. В рТМС (Повторяющаяся транскраниальная магнитная стимуляция (рТМС)) стимуляция имеет высокую амплитуду (0,5–3 тесла), невысокую сложность и анатомическую специфичность достигается за счет сильнофокального магнитного поля. В tPEMF (Транскраниальные импульсные электромагнитные поля (tPEMF)) стимуляция имеет низкую амплитуду (0,01–500 миллитесла), высокая сложность и анатомическая специфичность достигается за счет специфической частотной составляющей сигнала.25
Воспалительные процессы
Воспаление в основном происходит при протекании миелита. Этот синдром развивается на протяжении нескольких дней или недель. Зачастую причиной его возникновения становится вирусная инфекция. При протекании миелита человек жалуется на наличие болезненных ощущений в спине и слабость в мышцах, которая очень быстро нарастает. Кроме того, зачастую наблюдаются асимметричные парестезии в ногах.
Среди основных факторов риска развития миелита нужно выделить снижение иммунитета и переохлаждение. Развитие воспаления могут спровоцировать:
- инфекции;
- травмы;
- лучевая терапия;
- токсическое отравление;
- введение некоторых вакцин.
Для этого заболевания характерно острое и подострое протекание. При этом наблюдаются общие признаки воспаления, в частности, такие как быстрая и постоянная утомляемость, незначительное повышение температуры, ощущение слабости, боли и ломота в мышцах, головные боли.
Для проведения диагностики выполняется забор спинномозговой жидкости. Характер повреждений и оценку нервных структур можно получить путем проведения томографии. Лечение миелита спинного мозга подбирается с учетом провоцирующего фактора. Для этого могут применяться такие терапевтические методы как:
- при неинфекционном течении – глюкокортикостероиды;
- при бактериальном – антибиотики;
- миорелаксанты;
- мочегонные препараты;
- анальгетики;
- витамины.
При нарушении выделительной функции выполняют катетеризацию мочевого пузыря, а также обязательно смазывается кожа различными мазями для предотвращения развития осложнений
Очень важное значение имеет реабилитационная программа, которая включает специально подобранный курс ЛФК и сеансы массажа. Для полного восстановления может потребоваться несколько лет
К воспалительным процессам нужно также отнести арахноидит. Это болезнь, при которой происходит поражение в паутинной оболочке. Причинами этого могут быть перенесенные ранее различные острые и хронические интоксикации, болезни носовых пазух. При проведении лечения изначально нужно устранить источник инфекции. Для этого назначаются антибиотики, метаболическая и патогенетическая терапия.
Рынок нейромодуляции
Согласно исследованию рынка, проведенному Neurotech Reports, ожидается, что мировая индустрия устройств нейромодуляции вырастет с 8,4 млрд долларов в 2021 году до 13,3 млрд долларов в 2022 году. Рынок имплантированных спинномозговых стимуляторов для лечения хронической боли в 2014 году оценивался в 1,80 млрд долларов во всем мире, и ожидается, что в 2021 году он вырастет до 2,88 миллиарда долларов. Наблюдатели прогнозируют двузначные среднегодовые темпы роста отрасли в целом.
В этом нет ничего удивительного, учитывая огромную численность потенциальных пациентов для лечения, о чем свидетельствует распространенность следующих заболеваний:
- Эпилепсия: 40-50 миллионов пациентов во всем мире.
- Мигрень: 26 миллионов только в США.
- Травмы спинного мозга: 250 000 в США.
- Болезнь Паркинсона: 1,5 миллиона жителей США.
- Недержание мочи: 13 миллионов взрослых в США.
На сегодняшний день нейромодуляция только начинает рутинно применяться в качестве терапии для должным образом отобранных пациентов в этих группах. По мере того, как технологии продолжают развиваться, а количество врачей растет, вероятность того, что нейромодуляционная терапия затронет жизнь людей, резко возрастет.
Footnotes
- International Neuromodulation Society, 1 октября 2013 года
- Karas PJ, Mikell CB, Christian E, Liker MA, Sheth SA, Deep brain stimulation: a mechanistic and clinical update, Neurosurgical Focus, November 2013, https://doi.org/10.3171/2013.9.FOCUS13383
- Al-Otaibi FA, Hamani C, Lozano AM, Neuromodulation in epilepsy, Neurosurgery, October 2011, https://doi.org/10.1227/NEU.0b013e31822b30cd
- Krames, Elliot S.; Peckham, P. Hunter; Rezai, Ali R., eds. (2009). Neuromodulation, Vol. 1-2. Academic Press. p. 274. ISBN 9780123742483.
- Wu C, Sharan AD, Neurostimulation for the treatment of epilepsy: a review of current surgical interventions, Neuromodulation, 4 September 2012, doi:10.1111/j.1525-1403.2012.00501.x
- Precision™ Plus Spinal Cord Stimulator System Receives CE Mark Approval as MRI Conditional, Paris, France: Boston Scientific Corporation, August 28, 2012
- Clinical trial number NCT01559220 for “Deep Brain Stimulation for the Treatment of Alzheimer’s Disease.” at ClinicalTrials.gov
- Clinical trial number NCT01608061 for “Functional Neuromodulation Ltd. ADvance DBS-f in Patients With Mild Probable Alzheimer’s Disease.” at ClinicalTrials.gov
- Kortekaas R, van Nierop LE, Baas VG, Konopka KH, Harbers M, van der Hoeven JH, et al, A novel magnetic stimulator increases experimental pain tolerance in healthy volunteers – a double-blind sham-controlled crossover study, 2013, doi: 10.1371/journal.pone.0061926
- Shupak NM, Prato FS, Thomas AW, Human exposure to a specific pulsed magnetic field: effects on thermal sensory and pain thresholds, Neuroscience Letters, June 2004, https://doi.org/10.1016/j.neulet.2004.03.069
- Matsumura Y, Hirayama T, Yamamoto T, Comparison between pharmacologic evaluation and repetitive transcranial magnetic stimulation-induced analgesia in poststroke pain patients, Neuromodulation, 2013, https://doi.org/10.1111/ner.12019
- Feng WW, Bowden MG, Kautz S, Review of transcranial direct current stimulation in poststroke recovery, Topics in Stroke Rehabilitation, https://doi.org/10.1310/tsr2001-68
- Krames, Elliot S.; Peckham, P. Hunter; Rezai, Ali R., eds. Neuromodulation, Vol. 1-2. Academic Press. pp. 1–1200. ISBN 9780123742483
- Sun FT, Morrell MJ, Wharen RE, Responsive cortical stimulation for the treatment of epilepsy, Neurotherapeutics, January 2008, doi: 10.1016/j.nurt.2007.10.069
- Deer TR, Krames E, Mekhail N, Pope J, Leong M, Stanton-Hicks M, et al., The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Appropriateness Consensus Committee, Neuromodulation, August 2014, https://doi.org/10.1111/ner.12204
- Mekhail NA, Cheng J, Narouze S, Kapural L, Mekhail MN, Deer T, Clinical applications of neurostimulation: forty years later, Pain Practice, 2010, https://doi.org/10.1111/j.1533-2500.2009.00341.x
- Bailey, Madeleine, A remote control turns off my spine, The Express. London, UK, May 14, 2013
- Deer TR, Mekhail N, Provenzano D, Pope J, Krames E, Leong M, et al, The appropriate use of neurostimulation of the spinal cord and peripheral nervous system for the treatment of chronic pain and ischemic diseases: the Neuromodulation Appropriateness Consensus Committee, Neuromodulation, August 2014, https://doi.org/10.1111/ner.12208
- Bronstein JM, Tagliati M, Alterman RL, Lozano AM, Volkmann J, Stefani A, et al., Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues, Archives of Neurology, February 2011, doi:10.1001/archneurol.2010.260
- Williams NR, Okun MS, Deep brain stimulation (DBS) at the interface of neurology and psychiatry, The Journal of Clinical Investigation, November 2013, doi: 10.1172/JCI68341
- Medtronic Receives European CE Mark Approval for Deep Brain Stimulation Therapy for Refractory Epilepsy Further Clinical Study Required for Application to U.S. Food and Drug Administration, (Press release), 16 September 2010
- Wilner A, Thalamic Stimulation: New Approach to Treatment of Epilepsy, Medscape Neurology, 22 April 2010
- Lozano AM, Lipsman N, Probing and regulating dysfunctional circuits using deep brain stimulation, Neuron, February 2013, DOI:https://doi.org/10.1016/j.neuron.2013.01.020
- George MS, Nahas Z, Borckardt JJ, Anderson B, Burns C, Kose S, Short EB, Vagus nerve stimulation for the treatment of depression and other neuropsychiatric disorders, Expert Review of Neurotherapeutics, January 2007, https://doi.org/10.1586/14737175.7.1.63
- Whissell PD, Persinger MA, Emerging synergisms between drugs and physiologically-patterned weak magnetic fields: implications for neuropharmacology and the human population in the twenty-first century, Current Neuropharmacology, December 2007, DOI : 10.2174/157015907782793603
- Hariz MI, Blomstedt P, Zrinzo L, Deep brain stimulation between 1947 and 1987: the untold story, Neurosurgical Focus, August 2010, https://doi.org/10.3171/2010.4.FOCUS10106
- Wall PD, Melzack R (1996). The challenge of pain (2nd ed.). New York: Penguin Books. pp. 61–69. ISBN 0-14-025670-9.
- Lozano AM, Gildenberg PL, Tasker RR, eds. (2009). Textbook of Stereotactic and Functional Neurosurgery. 1. pp. 16–20.
- Bittar RG, Kar-Purkayastha I, Owen SL, Bear RE, Green A, Wang S, Aziz TZ, Deep brain stimulation for pain relief: a meta-analysis, Journal of Clinical Neuroscience, June 2005, https://doi.org/10.1016/j.jocn.2004.10.005
- Benabid AL, Chabardes S, Torres N, Piallat B, Krack P, Fraix V, Pollak P, Functional neurosurgery for movement disorders: a historical perspective, Neurotherapy: Progress in Restorative Neuroscience and Neurology, Progress in Brain Research, 175. pp. 379–91, 2009, https://doi.org/10.1016/S0079-6123(09)17525-8
- Cookson C, Healthcare: Into the cortex Scientific advances on the brain promise to transform the pharmaceutical industry, Financial Times. London. Retrieved 11 October 2014
- Famm K, Litt B, Tracey KJ, Boyden ES, Slaoui M, Drug discovery: a jump-start for electroceuticals, Nature, April 2013, doi: 10.1038/496159a
- Carroll J, GlaxoSmithKline stakes a pioneering effort to launch ‘electroceutical’ R&D, Fierce Biotech. Retrieved 11 October 2014
- Birmingham K, Gradinaru V, Anikeeva P, Grill WM, Pikov V, McLaughlin B, et al., Bioelectronic medicines: a research roadmap, Nature Reviews, Drug Discovery (published 30 May 2014), doi:10.1038/nrd435