Депрессия альфа-ритма
➥ Основная статья: Депрессия альфа-ритма
Депрессия альфа-ритма (недостаток альфа-волн) возникает тогда, когда человек открывает глаза или думает над задачей, которая требует определённых зрительных представлений. При повышении функциональной активности мозга амплитуда альфа-ритма уменьшается вплоть до полного исчезновения. Также может быть признаком беспокойства, гнева, страха, тревоги, вызывающие депрессию; нарушений, связанных в той или иной мере с изменениями в деятельности активирующих систем мозга и, как следствие, с повышенным уровнем активации вегетативной и центральной нервной системы.
Критерии патологии при оценке α-ритма
Нарушения функционального или морфологического характера в первую очередь сказываются на параметрах α-ритма.
- Постоянное наличие α-ритма (индекс >50%) в лобных отделах мозга при биполярной регистрации с электродов, наложенных с малыми межэлектродными расстояниями (рис. 2; 3).
- Амплитудная межполушарная асимметрия >30% (рис. 4).
- Частотная асимметрия >1 колебаний/с (рис. 5).
- Нарушение образа: нарушение синусоидальности волн, отсутствие модуляции, появление пароксизмального ритма (рис. 4, 6, 7). Наличие аркообразного α-ритма (рис. 6, 7).
- Изменения количественных параметров, отсутствие стабильности по частоте, снижение амплитуды <20 мкВ или повышение >90 мкВ, снижение индекса α-ритма <50% вплоть до его полного отсутствия (рис. 5).
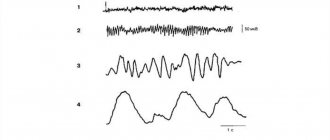
Рис. 2. Мужчина, 45 лет. Киста правой височной области.
На электроэнцефалограмме отмечаются постоянное наличие α-ритма (индекс >50%) в лобных отделах мозга, отсутствие модуляции, появление пароксизмального α-ритма, нарушение синусоидальности волн (А — монополярный монтаж; Б — продольный биполярный монтаж)
Рис. 3. Женщина, 60 лет. Панические атаки, резкая смена настроения.
На электроэнцефалограмме отмечаются амплитудная межполушарная асимметрия α-ритма >30%, снижение зональных различий, нарушение синусоидальности, наличие пароксизмальных α-волн
Рис. 4. Мужчина, 16 лет. Киста правой передней области.
На электроэнцефалограмме отмечаются амплитудная межполушарная асимметрия α-ритма >30%, отсутствие модуляции, появление пароксизмальных α-волн
Рис. 5. Мальчик, 12 лет. Абсансы.
На электроэнцефалограмме отмечаются отсутствие стабильности по частоте, частотная асимметрия α-ритма >1 колебания/с, отсутствие модуляции, нарушение синусоидальности волн, повышение амплитуды >90 мкВ
Рис. 6. Женщина, 23 года. Киста правой передней области.
На электроэцефалограмме отмечаются постоянное наличие α-ритма в лобно-центрально-теменных отделах мозга, отсутствие модуляции, появление аркообразного α-ритма
Рис. 7. Женщина, 63 года.
Жалобы на сильные головные боли и подъем артериального давления. При электроэнцефалограмме отмечаются наличие аркообразного α-ритма в затылочных отделах мозга и отсутствие модуляции. При ультразвуковой допплерографии выявлено нарушение кровообращения в бассейне среднемозговой артерии слева
Гамма-ритм
В последнее время электрофизиологи полагают, что большинство психических процессов связано с наиболее высокочастотным ритмом ЭЭГ — гамма-ритмом (30 — 40 Гц и выше). Считается, что высокочастотный гамма-ритм, выявляющийся с помощью нейрофизиологических исследований и возникающий синхронно в различных областях мозга при определенном уровне функционирования систем нейромедиаторных лежит в основе когнитивных процессов.
Гамма — ритм является отражением образования и развития взаимосвязанных нейронных ансамблей, играющих важную роль в когнитивных процессах.
При шизофрении локализация максимума гамма-активности заметно отличается от нормы. Уже при первых эпизодах психоза при выполнении когнитивного теста больные шизофренией демонстрируют избыток спектральной мощности гамма-ритма только в префронтальных областях, которая на более отдаленных этапах болезни сменяется его недостаточностью, редукцией мощности во всем правом полушарии.
Функциональные межполушарные взаимосвязи у больных шизофренией ослаблены как в фоновом состоянии, так и при выполнении когнитивных тестов.
Представляют интерес работы, посвященные межполушарной асимметрии и доминированию активности какой-либо из гемисфер мозга.
Магнитноэнцефалографические исследования, направленные на анализ активности левого и правого полушарий мозга с помощью акустически вызванных нейромагнитных полей, показали изменения диполей в области верхнего отдела височной извилины. Более выраженные отклонения касались не локальных изменений, а ориентации диполей. У мужчин, страдающих шизофренией, отчетливые изменения в ориентации диполей отмечались в левом полушарии, у женщин — в правом. Результаты подобных исследований свидетельствуют о половых различиях активности полушарий мозга у больных шизофренией (Sauer H. et al., 1998).
Результаты электрофизиологических и нейропсихологических исследований свидетельствуют, что при шизофрении в патологический процесс преимущественно вовлечены префронтальные и заднелобные (премоторные) отделы мозга и связанные с ними глубокие структуры ретикуло-фронтального комплекса.
Полное отсутствие альфа-ритмов
В 1949 г. Moizzi и Magoun впервые показали, что стимуляция ретикулярной формации ствола мозга активизирует кору и переводит высокоамплитудную, низкочастотную ЭЭГ (т.е. ЭЭГ с заметными альфа-ритмами) в низкоамплитудную, высокочастотную ЭЭГ. В нормальном мозге альфа-ритмы ЭЭГ имеют наибольшую амплитуду. Когда альфа-ритмы отсутствуют, запись ЭЭГ выглядит и называется низкоамплитудной. Если более высокочастотные ритмы не подавлены по сравнению с нормой, запись ЭЭГ называют низкоамплитудной высокочастотной ЭЭГ. На спектрах мощности таких ЭЭГ отсутствуют существенные пики альфа-частот в любых состояниях (и с открытыми, и с закрытыми глазами). Эмпирически низкоамплитудная запись, определяемая как запись в состояниях с открытыми и с закрытыми глазами с амплитудой ЭЭГ в монтаже относительно объединенных ушных электродов, не больше чем 20 мкВ во всех корковых областях. Как можно видеть, это определение весьма субъективно и очень пространно.
Низкоамплитудные ЭЭГ обнаруживаются у 4— 10 % здоровых взрослых субъектов в зависимости от критериев оценки и едва ли могут рассматриваться как отклонение от нормы. Скорее низкоамплитудные ЭЭГ могут быть связаны с некоторой индивидуальной особенностью. Низкоамплитудные ЭЭГ найдены в семьях алкоголиков и наркоманов. Потребление алкоголя, похоже, работает как прием «самолечения» у этой части населения с целью уменьшить гиперактивацию коры.
Межполушарные взаимосвязи
Многочисленные исследования показали нарушения структуры и функциональной активности мозолистого тела при шизофрении. Межполушарное взаимодействие в значительной мере определяется церебральной латерализацией или асимметрией. Она является эволюционно более новой и высокоорганизованной функцией мозга, одновременно и более уязвимой для патологических процессов.
Как известно, межполушарное взаимодействие формируется на основе церебральной латерализации в процессе нормального развития мозга. Здесь важную роль играет питание, адекватная стимуляция, гормональный фон, отсутствие значительных стрессов как в пери-, так и постнатальный период развития ребенка. Кроме того, церебральная латерализация определяет структуру и размеры мозолистого тела, позднее — характер межполушарных взаимодействий. Анализ когерентности в гамма-диапазоне показал, что полное отсутствие функциональных межполушарных взаимосвязей на ранних этапах шизофрении в дальнейшем сменяется формированием системы межполушарных взаимодействий в задних отделах мозга. Это может свидетельствовать о развитии компенсаторных процессов в работе нейронных ансамблей мозга. Справедливо предположение, согласно которому при шизофрении межполушарные взаимосвязи (межполушарный обмен информацией) осуществляются не через мозолистое тело, как в норме, а через подкорковые структуры (Стрелец В.Б. с соавт., 2006).
Отсутствие межполушарных взаимодействий, феномен «функционального расщепления полушарий», обнаруживается уже при первых эпизодах заболевания.
Можно говорить о нарушении интегративной деятельности мозга при шизофрении, которая в ограниченном диапазоне на отдаленных этапах течения болезни возможна лишь в задних отделах полушарий.
Во время обострения шизофрении на фоне выраженной позитивной симптоматики количество когерентных связей, отражающих степень синхронизации различных областей коры, значительно снижено. Межполушарное взаимодействие практически отсутствует. При выраженной негативной симптоматике на фоне резкого уменьшения коркового взаимодействия, вероятно, компенсаторно формируется другая система связей-только в задних областях мозга (в том числе одна межполушарная). Больные шизофренией на отдаленных этапах течения заболевания сохраняют способность к выполнению когнитивных тестов, не за счет межполушарного взаимодействия на уровне мозолистого тела, которое разрушено при шизофрении, а за счет межполушарного взаимодействия через подкорковые структуры. Поэтому больные шизофренией выполняют задания более медленно, чем здоровые люди (Стрелец В.Б. с соавт., 2006).
Результаты нейрофизиологических исследований позволяют высказать гипотезу, согласно которой мозг больных шизофренией оперирует в искаженном функциональном состоянии, которое характеризуется избыточной фрактальной размерностью. Это может приводить к нарушению координации между различными областями коры мозга, сенсорной перегрузке, специфическим нарушениям мышления и аффективной сферы. Кроме того, у больных шизофренией с неблагоприятным течением с трудом формируются автоматические реакции на повторные стимулы.
Дезорганизация α-ритма
Дезорганизация (Disorganization) – общее изменение в частотном составе, форме, топографии и/или количестве физиологических ритмов ЭЭГ в отдельной записи по отношению к предыдущей записи ЭЭГ одного и того же субъекта либо ритмов в одноименных участках разных полушарий головы. Дезорганизация или заострение альфа-ритма, дизритмия рассматриваются как проявление ирритативных нарушений, которые чаще всего связаны с рефлекторным влиянием со стороны раздраженных оболочек сосудистой системы головного мозга. В начальных и неглубоких стадиях комы, характеризующихся спутанностью сознания, сонливостью, частичной утратой контакта с окружающим, иногда определяемых как сопор, наблюдаются исчезновение или существенная дезорганизация α-активности и появление на этом фоне θ- и δ-волн амплитудой до 50-60 мкВ.
Электроокулография
Достаточно информативен при шизофрении тест с антисаккадами, определяемый, исходя из появления горизонтальных саккад, при слежении за перемещением светового стимула от периферии к центру — в точку, симметричную мишени относительно центра зрительного поля.
Тест с антисаккадами можно регистрировать не только во время записи электроокулограммы (ЭОГ), но и с помощью инфракрасной окулометрии.
В норме глаза двигаются гладко и по синусоидальной орбите. При шизофрении, особенно у длительно страдающих этим психическим расстройством больных, и при некоторых хронически протекающих психозах — движения глаз прерываются частыми остановками, появляются «догоняющие саккады».
В процессе проведения исследования пациент должен следить глазами за световым раздражителем на маятнике, при этом маятник раскачивается сначала медленно, затем быстрее. Переход от последовательных движений глаз к саккадическим — скачкообразным, опережающим у здоровых людей составляет от 0,5 до 0,7 Гц, у больных шизофренией более раннее, и более заметное появление саккад наблюдается даже во время ремиссии, что связывается с дефицитом внимания и нарушением процессов восприятия — невозможностью фиксировать слабо выраженные и кратковременные сигналы. Неспособность больных шизофренией плавно следить за движением маятника является следствием возникающих трудностей дифференцировки стимулов, в частности, значимых от латентных.
У больных шизофренией при выполнении этого теста регистрируется в 5-6 раз больше ошибок, чем у здоровых лиц.
| | Своевременная диагностика способствует эффективному лечению шизофрении |
Нарушение плавности, прерывистость следящих движений глаз — диагностически значимый признак шизофрении, отмечаемый почти в 80% случаев. Согласно данным исследователей разных стран, в какой-то мере нарушение плавности движения глаз отличается у разных народов. Вследствие вышесказанного в специальной литературе можно встретить большой разброс, касающийся диагностической значимости результатов этого теста (70-90%).
Данный тест также положителен у родственников больных шизофренией, что может свидетельствовать о его информативности в отношении генетических особенностей шизофрении (Киренская А.В., 2006).
Множественные остановки при движения глаз отмечаются у 45% родственников больных шизофренией первой степени родства, причем данный тест чаще положителен у монозиготных близнецов, чем у гетерозиготных, и в норме регистрируется лишь у 10% людей (Mather J., 1985).
Эксперименты на животных, у которых повреждались отдельные участки коры фронтальной доли мозга, показали, что дисфункция фронтального кортекса приводит к нарушению процессов специфического торможения, исходящего из фронтально локализованных полей зрения на субкортикальные центры, ответственные за движения глаз.
Эта гипотеза была подтверждена и несколько модифицирована с помощью метода функциональной магнитно-резонансной томографии. Оказалось, что во время торможенния саккады, когда пациентов просили прекратить слежение за световым стимулом, находящимся на периферии, субкортикальный центр стриатума не усиливал свою активность, как это наблюдалось в норме. Исходя из данных, полученных в результате такого эксперимента, можно полагать, что при шизофрении имеет место первичная дисфункция стриатума, которая локально нарушает фронто-стриарный поток информации. Иными словами, нарушается процесс переключения нейронных связей в области стриатума. Отчасти такая гипотеза, подтверждается данными психофармакологических и нейрохимических исследований шизофрении, свидетельствующими, что блокада D2-рецепторов в области стриатума существенно улучшает состояние больных шизофренией. Кроме того, изучение показателей уровня метаболических процессов в области стриатума при шизофрении, говорит о снижении процента обмена веществ в этой зоне.
Скорее всего, при шизофрении мы имеем дело с поражением не только стриатума, но и других областей головного мозга. Патологический процесс можно представить как обширное сетевое расстройство, проявляющее себя в виде нарушений функций переключения между фронтальной областью мозга, стриатумом и таламусом. Согласно этой гипотезе, «запрещающий сигнал» оказывается невозможным из-за повреждения нейрональных связей между фронтальной долей мозга и таламусом. Нельзя не отметить, что подобные изменения в ряде случаев наблюдаются и при других психических расстройствах, что несомненно сказывается на границах шизофрении, даже на уровне ее патогенеза.
Альфа-ритмы в необычных участках
У детей и молодых взрослых альфа-активность ЭЭГ может быть обнаружена в затылочных областях (О1, О2), теменной области (Pz) и в сенсомоторной зоне (СЗ, С4). Однако скальповое распределение альфа-активности (особенно в состоянии с открытыми глазами) изменяется с возрастом, и у пожилых людей становятся заметными височные альфа-ритмы. Niedermeyer (1997) описал височный альфоподобный ритм, обнаруженный главным образом в передне- и средневисочных областях, характеризующийся умеренной анормальностью, и предположил, что он может быть признаком начальных цереброваскулярных нарушений. Он также упоминает, что в период полового созревания этот паттерн, обнаруживаемый в височной доле, может скрывать очаг эпилептогенеза. Ритмичная альфа-активность также может маскировать ритмичные пароксизмальные вспышки, без проявления каких-либо острых компонент.
Рисунок 8. Случай аномальной локализации альфаподобных ритмов
Вверху слева — фрагмент ЭЭГ в состоянии с открытыми глазами. Представлены отклонения от нормы спектров ЭЭГ и соответствующие топограммы. Внизу — sLORETA-изображения генераторов аномальных ритмов.
Наш опыт работы со здоровыми испытуемыми и пациентами позволяет сделать следующее заключение: если у отдельного пациента: 1) максимум ритмичной активности в пределах диапазона 7— 13 Гц локализован в отведениях, отличных от упомянутых для нормы, 2) сам ритм заметен настолько, что наблюдается существенное отклонение от нормы и в абсолютной, и в относительной мощности, — тогда этот ритм можно считать анормальным. В нашей практике максимумы распределений анормальных альфа-ритмов были обнаружены в задневисочных областях (например, в связи со звоном в ушах или травмой позвоночника), в теменных областях левого полушария (в связи с дислексией), в средних и в передних височных областях (в связи с возрастными цереброваскулярными нарушениями). Только в немногих случаях анормальные альфа-ритмы были обнаружены в лобных областях.
Пример спектральных характеристик ЭЭГ пациента с аномальными альфа-ритмами представлен на рис. 8. На сырой записи ЭЭГ проявляются два типа ритмов в пределах альфа-частот: первый с частотой 9,5 Гц, расположенный в левой средней височной области, и второй с частотой 7,3 Гц, расположенный в зоне отведения Fz. Результаты сравнения с нормативной базой данных и изображениями sLORETA представлены на рис. 8 справа сверху.
В целом изменения в нормальном функционировании таламокортикальных путей могут заканчиваться рядом неврологических расстройств, например, эпилептическими припадками и тремором при болезни Паркинсона, оба эти расстройства имеют ритмичные компоненты. Стимуляция или разрушение соответствующей части таламуса (например, зон вентральных ядер) — один из принятых методов облегчения тремора, по всей видимости, связанный с разрушением ритмической активности таламокортикальных сетей. Аномальная ритмическая активность таламических клеток (как показано на пациентах со вживленными электродами) может наблюдаться при некоторых неврологических расстройствах, связанных с нарушением поведения, которые не обязательно имеют ритмическую природу. Например, регистрация активности таламических нейронов у пациентов, страдающих хронической болью, как результата сенсорной деафферентации (так называемые фантомные боли) демонстрирует присутствие аномальных ритмических вспышек потенциалов действия. В этом случае стереотактические лизисы таламических ядер ведут к уменьшению фантомных болей.
Характеристики альфа-ритма электроэнцефалограммы у больных бронхиальной астмой
Приблизительно 300 млн человек в мире имеют диагноз бронхиальной астмы (БА) [1]. При этом заболеваемость продолжает возрастать, и к 2025 году ожидается увеличение популяции больных БА еще на 100 млн человек [1, 2]. Распространенность в разных возрастных группах, прогрессирующее повышение заболеваемости и затрат на лечение приводят к увеличению бремени этой болезни как для бюджета здравоохранения, так и для общества и самих пациентов, что делает БА значительной медицинской и социальной проблемой [1-3]. При современном уровне доказательной медицины системный подход к проблеме БА возможен только на основе междисциплинарных исследований на стыке различных областей знания — пульмонологии, психиатрии, физиологии, психофизиологии, нейропсихологии, социологии. В этом направлении нужен определенный научный и практический прорыв, который позволит нам приблизиться к разработке необходимых при БА методов персонализированной медицины.
БА многие годы трактовалась как одна из классических психосоматических болезней. Не углубляясь в историю вопроса о трансформации самого понятия «психосоматические болезни» и прежних трактовок в этом аспекте БА, можно констатировать, что, согласно современным представлениям, БА является самостоятельной нозологической формой. БА — хроническое воспалительное заболевание дыхательных путей, характеризующееся обратимой бронхиальной обструкцией и гиперреактивностью бронхов.
Возникновение и прогрессирование БА может служить примером сложных психосоматических и соматопсихических взаимоотношений и взаимосвязей [4]. В подавляющем большинстве случаев на всех этапах развития БА в той или иной мере отмечается наличие психопатологических расстройств аффективного спектра, чаще тревожно-депрессивного комплекса. Степень выраженности психопатологических включений в основную клиническую картину заболевания создает дополнительные трудности в лечении больных БА. Одним из подходов к объективной оценке дезорганизации функционального состояния корковой мозаики ЦНС является анализ электрической активности мозга, особенно основного ритма ЭЭГ — альфа-активности [5, 6].
Многочисленные исследования показали, что развитие депрессивных состояний сопровождается нарушениями структуры всех частотных диапазонов ЭЭГ, но в большей степени изменения касаются основного ритма ЭЭГ — альфа-ритма [7-10]. Альфа-ритм — ритмические колебания с частотой 8-13 Гц и средней амплитудой 30-70 мкВ, регистрируется преимущественно в затылочных областях при закрытых глазах в состоянии спокойного бодрствования и максимально возможном расслаблении мышц. Ритм блокируется световой стимуляцией, концентрацией внимания и умственными нагрузками.
Альфа-диапазон при депрессиях может значительно усиливаться или редуцироваться, меняется пространственное распределение ритма [8, 11-13]. По современным представлениям, генерация альфа-ритма связана с реверберацией импульсной активности по интеркортикальным и таламо-кортикальными нейронным сетям, а выраженность его обусловливает синхронизацию функциональной активности различных мозговых систем, в частности определяет связь получаемой от афферентной системы организма информации с механизмами оперативной памяти, регулируя адаптационные процессы.
Поэтому альфа-диапазон ЭЭГ традиционно привлекает повышенное внимание исследователей благодаря его высокой чувствительности к разнообразным внешним воздействиям и тонким изменениям функционального состояния коры мозга, сопровождающим сенсорные, моторные, когнитивные и мнестические процессы [14, 15].
Характер изменений альфа-активности при депрессивных расстройствах зависит в первую очередь от особенностей депрессивного синдрома. Так, повышение индекса альфа-ритма свойственно больным с «большой депрессией», а его снижение в десинхронизированном типе ЭЭГ выявляется при дистимических расстройствах, т. е. при депрессиях невротического уровня [16-18]. Рядом авторов предложена нейрофизиологическая модель депрессии, постулирующая изменение фронтальной асимметрии — снижение левополушарной активности [19-25]. Исследователи связывают особенности изменения альфа-активности с доминированием тоскливого, тревожного или апатического аффекта, подтверждая тем самым общепринятое положение о связи структуры ЭЭГ с функциональной активностью корковых зон. Наблюдаемые при этом особенности профиля вегетативной нервной системы позволяют предположить, что одним из механизмов перестройки корковой ритмики является дисфункция диэнцефальных подкорковых структур [26].
Цель исследования: провести сравнительный анализ параметров основного ритма ЭЭГ человека — альфа-ритма — у больных БА и здоровых людей.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании при условии добровольного информированного согласия участвовали 57 пациентов (38 женщин и 19 мужчин) с частично контролируемой БА легкой и средней тяжести и с расстройствами аффективного спектра. Диагноз БА устанавливался в соответствии с международными согласительными документами (Global Initiative for Asthma, 2017). Возраст пациентов варьировал от 18 до 65 лет (средний возраст — 53,7 ± 10,9 года). Группу контроля составили 50 практически здоровых лиц, сопоставимых по возрасту и полу.
Проводилось комплексное клинико-инструментальное обследование: функциональное исследование легких (спирометрия, функция внешнего дыхания), ЭЭГ. Для оценки и анализа психопатологических расстройств аффективного спектра использовалась клинико-психопатологическая карта, разработанная В.Н. Красновым [27]; шкалы Гамильтона для оценки тревоги и депрессии; тест-контроль БА.
Общей психопатологической характеристикой обследованных больных БА была гипотимия с тревожным компонентом, при этом прослеживалась тенденция трансформации тревоги в тревожно-тоскливое состояние. Количество баллов по шкале депрессии Гамильтона составило 13-17.
Литературные данные свидетельствуют о различных профилях нейрофизиологических показателей у правшей и левшей, поэтому по опроснику латеральных признаков [28] в группы испытуемых отбирались правши.
ЭЭГ регистрировали с помощью аппаратно-программного комплекса для топографического картирования электрической активности мозга «Нейро-КМ» (Россия) с полосой пропускания от 0,1 до 45 Гц. Запись ЭЭГ осуществляли монополярно от симметричных лобных (F3, F4), центральных (C3, C4), теменных (P3, P4), затылочных (О1, O2), передне-височных (F7, F8), средне-височных (T3, T4) и задне-височных (Т5, Т6) корковых зон (схема 10-20%, четные каналы отведения — от корковых зон правого полушария, нечетные — левого). Референсным электродом служили объединенные ушные клипсы. Характеристики и топографическое распределение ритмов ЭЭГ определяли с помощью анализа ЭЭГ методом быстрого преобразования Фурье с усреднением не менее 30 эпох по 2 секунды с последующим картированием по системе BRAINSYS (Россия).
Проводили спектральный и когерентный анализы ЭЭГ. Величину когерентности (КОГ) вычисляли между всеми 14 отведениями корковых областей в диапазоне 7-13 Гц, а также с шагом 1 Гц. Определяли и величину средней когерентности (СрКОГ) каждой области со всеми остальными корковыми зонами — показателя функциональной активности выбранной зоны в интегральной деятельности мозга. При межгрупповом сравнительном анализе спектральной мощности (СМ) ритмов использовали приведение показателей к нормализованному типу через логарифмирование (LnCM), а сравнение параметров КОГ проводилось по формуле:
где КОГ2 — квадрат модуля КОГ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные визуального и спектрального анализов электроэнцефалограммы
Наиболее выраженные изменения фоновой ЭЭГ обследованных больных наблюдались в виде двух вариантов: низкоамплитудной дизритмии и усиления синхронизации в медленноволновых диапазонах. В первом случае отмечались снижение амплитуды биоэлектрической активности, редукция альфа-ритма, сглаженность регионарных различий по альфа-индексу, усиление диффузной низкоамплитудной медленноволновой активности. При втором варианте имели место билатеральные вспышки альфа- и тета-волн, возникающие синхронно во всех областях и указывающие на явления ирритации на уровне стволовых структур мозга. Характерной особенностью альфа-ритма стала слабая выраженность или полное отсутствие модуляции в веретёна.
Независимо от типа изменений ЭЭГ-картирование групповых спектральных характеристик ЭЭГ выявляло нарушения топики основного ритма — зональные различия по альфа-индексу были слабо выражены. Несмотря на то что в группу исследования включались только правши, фокус альфа-ритма у обследованных пациентов был нечетко обозначен в правой затылочной области, что характерно для нормы, а в отдельных случаях доминировал в затылочной области левого полушария, что указывало на более значительное снижение функциональной активности левого полушария.
При спектральном анализе ЭЭГ абсолютная СМ альфа-ритма у больных была ниже, чем у испытуемых контрольной группы, во всех отведениях ЭЭГ. Диффузное снижение СМ альфа-ритма приводило к тому, что при сопоставлении с остальными ритмами ЭЭГ СМ альфа-ритма не лидировала, а занимала позицию после СМ медленноволновых ритмов, чаще после тета-диапазона.
Изменение соотношений отдельных ритмов ЭЭГ у больных БА особенно наглядно можно проследить при анализе %СМ — составляющей доли в процентах альфа-ритма от совокупности СМ всех ритмов ЭЭГ в данной области коры.
На рисунке 1 показана разность %СМ между показателями у больных и испытуемых контрольной группы. Во всех корковых зонах снижение %СМ альфа-ритма составляло более 12%. Наиболее значительная редукция (около 20%) — в затылочных областях с акцентом в правом полушарии, что и отражалось в нивелировании зональных различий корковых зон по выраженности альфа-индекса.
Рис. 1. Отличия %спектральной мощности альфа-ритма у больных бронхиальной астмой от нормы (p < 0,05 при модуле 1,7)
У больных отмечено смещение модального значения СМ ведущего ритма в более низкий частотный диапазон — 8-9 Гц (против 10 Гц у здоровых испытуемых), что отражает переход корковой ритмики на функционирование в более энергосберегающих режимах (рис. 2). Следующими по значению СМ в альфа-диапазоне являлись полосы 9-10 и 10-11 Гц, а самыми низкими — высокочастотные полосы 11-12 и 12-13 Гц. Средний показатель СМ по всем корковым зонам (СрСМ) высокочастотных составляющих альфа-ритма в 4 раза ниже СрСМ доминирующей частоты 8-9 Гц.
Рис. 2. Структура альфа-ритма — средние значения 1 Гц полос спектральной мощности (СМ) по всем отведениям
По сравнению с показателями контрольной группы (рис. 3) у больных БА полоса 8-9 Гц была снижена в меньшей степени, чем остальные. Наибольшая редукция полосы 10-11 Гц отмечалась в затылочных областях с небольшим акцентом в правом полушарии. В этих корковых зонах полосы 9-10, 11-12 и 12-13 Гц были уменьшены почти в равной мере. Во фронтальных корковых зонах закономерность иная — в большей степени редуцирована полоса 9-10 Гц, затем следуют полосы 10-11, 11-12 и 12-13 Гц. Эти данные указывают на значительную деформацию структуры основного ритма у больных. Генераторы альфа-ритма у пациентов работают в особом режиме, значительно отличающемся от нормы.
Рис. 3. Изменение структуры альфа-ритма у больных бронхиальной астмой по сравнению с нормой во фронтальных (F3 слева и F4 справа) и затылочных (О1 слева и О2 справа) областях коры (p < 0,05 при модуле 1,7)
Данные когерентного анализа электроэнцефалограммы
Наиболее низкие значения КОГ у больных БА выявлены в диапазонах длиннодистантных связей. Так, лобно-затылочные величины КОГ (О1-F3, О1-F4, О2-F4 и О2-F3) колебались в диапазоне 0,05-0,08. Короткодистантные связи имели существенно более высокие значения КОГ: затылочные области с теменными зонами (О1-Р3, О2-Р4) — 0,34 и 0,48, фронтальные области с близлежащими областями (F3-С3, F4-С4) — 0,75 и 0,74. Величина СрКОГ по альфа-диапазону у больных БА по сравнению с таковой у участников контрольной группы (рис. 4) по всем корковым зонам была значительно снижена (р < 0,05).
Рис. 4. Сравнение величины средней когерентности (СрКОГ) по альфа-диапазону у больных и испытуемых контрольной группы
Во фронтальных, центральных и теменных зонах обоих полушарий уменьшение достигло полуторакратного размера, а в височных зонах — несколько меньшего. Самое большое различие СрКОГ по альфа-диапазону между нормой и больными выявлено в затылочных и задне-височных зонах, в частности в левой затылочной области — СрКОГ по альфа-диапазону у больных была почти в 2 раза ниже, чем у здоровых.
Полученные данные свидетельствуют о значительном диффузном ослаблении функциональных связей между всеми областями коры. Это касается и межполушарных связей, они уменьшены между всеми симметричными корковыми зонами по основному ритму, хотя и в разной степени. Так, между фронтальными зонами отличия от нормы менее выражены, чем между другими парами корковых областей. Особенно значительное уменьшение межполушарного взаимодействия отмечается между передне-, средне- и задне-височными зонами. Роль отдельных частотных полос альфа-ритма в связях между корковыми зонами неодинакова — основную роль играет низкочастотная полоса 8-9 Гц. Значения СрКОГ этой полосы наибольшие во фронтальных, теменно-центральных зонах, а также в височных зонах правого полушария. Следовательно, у больных БА перестройка структуры основного ритма в более замедленные режимы изменяет и снижает функциональную активность корковых зон.
Проведенное клинико-нейрофизиологическое исследование подтверждает наличие сопутствующих БА умеренных тревожно-депрессивных расстройств с тенденцией формирования тоскливого варианта аффективного спектра, на что может указывать усиление медленноволновой активности, преимущественно тета-диапазона.
ЗАКЛЮЧЕНИЕ
Исследование альфа-ритма ЭЭГ с применением спектрального и когерентного анализа позволило выявить у больных бронхиальной астмой (БА) особую мозаику пространственно-временных соотношений работы различных отделов коры и межкорковых взаимодействий. Это позволяет дифференцированно подходить к оценке функциональной активности различных корковых зон и их участия в интегративной деятельности мозга на основании спектральных и когерентных показателей альфа-диапазона. Данные показатели могут служить дополнительными характеристиками при диагностике и выборе терапевтических подходов у больных БА.