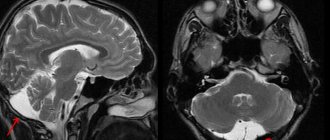
Проблемы лечения ребенка с неврологической патологией являются крайне актуальными в наше время. Это связано и с общим падением рождаемости, и с увеличением количества неблагоприятных факторов, провоцирующих поражение нервной системы, и с учащением случаев рождения нездоровых, физиологически незрелых детей.
Крайне часто непосредственными причинами поражения головного мозга служат гипоксически-ишемические процессы в результате недостаточного снабжения нервной ткани кислородом. В МКБ-10 диагноз шифруется в нескольких разделах. Наиболее близкими по патофизиологии являются коды P21.9 (неонатальная аноксия) и G 93.1 (аноксическое поражение головного мозга, не классифицированное в других рубриках).
Аноксическое поражение нервной системы у детей обусловлено отсутствием адекватного кислородоснабжения нейронов. В подобных условиях клетка быстро изменяет свои функциональные свойства и не способна полноценно работать. В последующем нарушается и морфология нейронов. Дефицит кислорода приводит к клеточному некрозу и/или апоптозу и формирует очаги ишемии в веществе головного мозга. Симптомы аноксии головного мозга могут быть крайне тяжелыми и заканчиваться смертельными исходами.
Нейроны начинают отмирать уже после 4 минут острой аноксии. В условиях гипотермии это время удлиняется до 20-30 минут, при высоких температурах снижается до 120 секунд.
Описание недуга
Проблемы терапии ребенка с неврологическими патологиями являются в наше время крайне актуальными. Это напрямую связано с общим упадком рождаемости, а кроме того, с увеличением количества всевозможных неблагоприятных факторов, которые провоцируют поражение детской нервной системы. Помимо всего прочего подобное во многом связано и с тем, что в современном мире участились случаи рождения нездоровых, а вместе с тем и физиологически незрелых детей.
Очень часто основными причинами аноксического поражения головного мозга выступают гипоксические и ишемические процессы из-за недостаточного снабжения нервных тканей кислородом. В системе МКБ-10 такой диагноз шифруют сразу в нескольких разделах. Самыми близкими по патофизиологии выступает код P21.9 (он подразумевает неонатальную аноксию) и G93.1 (в данном случае речь идет об аноксическом поражении головного мозга, не классифицированном в прочих рубриках).
Этиология и патогенез
Выделяют целый ряд неблагоприятных факторов, которые способны привести к развитию аноксического поражения нервной системы. Даже минимальные отклонения существенно нарушают работу головного мозга в силу того, что они воздействуют на незрелую нервную ткань. В последующем это может проявиться неврологическим дефицитом, замедлением темпов формирования церебральных зон и центров и задержкой общего развития. Длительная аноксия приводит к летальному исходу или формированию вегетативного состояния.
В качестве первопричин аноксии могут выступать острый тромбоз, удушье, странгуляция, утопление, удар электрического тока, остановка сердца, интоксикация алкоголем или наркотиками, нейроинфекции, а также другие факторы, препятствующие поступлению кислорода в мозг. Отдельно выделяют аноксические поражения нервной системы перинатального периода. Этому способствует:
- патологическое течение беременности (соматические заболевания матери, гестозы, угроза прерывания беременности, симптомы качественного и количественного голодания, интоксикации, общая незрелость беременной женщины и т.д);
- интранатальные (возникшие в родах) повреждающие факторы. Сюда включаются симптомы преждевременной отслойки, предлежания плаценты, обвитие пуповины вокруг шеи плода, узлы пуповины, преждевременные и запоздалые, стремительные и затяжные роды, слабость родовой деятельности;
- постнатальные (послеродовые) нарушения. К ним относятся аспирация мекония, повторные апноэ, пороки сердечно-сосудистой системы, сепсис, гемолитическая болезнь новорожденных.
Все вышеперечисленные провокаторы становятся причиной развития очагов ишемии. Параллельно в качестве компенсаторной реакции повышается проницаемость церебральных сосудов. С одной стороны это снижает церебральную перфузию и усугубляет ишемию, с другой – служит одним из механизмов развития гипоксически-геморрагических поражений. За счет него через измененную сосудистую стенку начинается процесс диапедезного пропитывания эритроцитов. Кроме того, в условиях кислородного голодания утилизация глюкозы идет по анаэробному пути с образованием лактата. При перинатальной аноксии ацидные соединения раздражают пищеварительный и дыхательный центр ствола мозга. В родах это провоцирует преждевременный выход мекония и его аспирация в дыхательные пути ребенка, что способствует еще большей гипоксии.
Морфологически наблюдаются отклонения в виде:
- отёка мозга (фокального или мультифокального);
- ишемических очагов поражения мозговой ткани, базальных ганглиев, таламуса, мозжечка;
- кортикальных и субкортикальных мелкоочаговых некрозов;
- перивентрикулярной лейкомаляции.
Классификация
В зависимости от преимущественного морфологического результата развития нарушений аноксическая патология может проявиться в форме церебральной ишемии, внутричерепных кровоизлияний, имеющих гипоксический генез, и сочетанных нетравматических ишемически-геморрагических поражений центральной нервной системы.
Механизм развития аноксии позволяет классифицировать ее на следующие виды:
- аноксическую, формирующуюся в результате прекращения поступления кислорода через дыхательные пути;
- анемическую, возникающую как следствие массивной кровопотери, сосудистого спазма, тромбоза;
- застойную, являющуюся следствием дисциркуляции мозгового кровообращения;
- обменную – проявление нарушения метаболических процессов.
Кроме того, выделяют острую аноксию, которая развивается внезапно и хроническую форму патологии при постепенном нарастании дефицита кислорода (гипоксию).
Длительность снижения кислородопоступления определяет градацию аноксии на легкую (кислородное голодание до 80 секунд), умеренную (до 120 секунд) и тяжелую (до 240 секунд) формы. Подобное разделение достаточно условно, так как выраженность аноксических проявлений будет зависеть от температуры окружающей среды, возраста пациента и состояния самого организма.
Клиника
Симптомы клинической картины преимущественно определяются причиной возникновения аноксии и длительностью ее воздействия. Острая аноксия проявляется утратой сознания, которое может сопровождаться судорожными пароксизмами. В последствие наблюдается глубокая амнезия. Тяжелая и умеренная формы аноксии провоцируют стойкие неврологические расстройства:
- Параличи и парезы;
- Нарушения чувствительности;
- Когнитивные нарушения;
- Вестибуло-мозжечковый синдром;
- Эпилептические припадки.
Грубые аноксические поражения способны привести к декортикационному синдрому – функциональному отключению коры больших полушарий, и развитию вегетативного состояния.
Анатомическая картина при данном заболевании
К сожалению, медициной до сих пор не выявлен точный механизм появления аноксического поражения головного мозга. Правда, анатомически картина этой патологии достаточно проста. Дело в том, что нервная ткань перестает получать кислород в достаточном для нее количестве, на фоне этого происходит гипоксический ишемический процесс, являющийся, даже в течение короткого временного промежутка, губительным для структуры мозга.
Другими словами, каждый нейрон как бы недополучает в ходе кровоснабжения требуемое ему количество кислорода. Нейроны у детей еще не столь развиты, как это отмечается у взрослых, поэтому и взаимосвязь их с головным мозгом находится лишь на стадии формирования. При малом снабжении клетки она попросту перестает корректно функционировать, и при этом изменяется морфологически и внутренне.
Соответственно, аноксию называют морфологическими дегенеративными процессами, оказывающими на здоровую ткань чрезвычайно пагубное воздействие. Симптомы аноксического поражения головного мозга у детей крайне тяжело переносятся, что нередко заканчивается летальным исходом. Далее разберемся, какие причины являются провоцирующими факторами возникновения этого недуга у детей и новорожденных.
Диагностика
Острая аноксия может быть диагностирована по результатам опроса самого пациента, его родственников или находящихся рядом лиц. Врач выясняет причину возникновения данного состояния и при возможности длительность воздействия травмирующего фактора. Дополнительными методами диагностики являются:
- компьютерная и магнитно-резонансная томография;
- электроэнцефалограмма;
- однофотонная эмиссионная компьютерная томография;
- оценка вызванных слуховых и зрительных потенциалов.
Причины патологии мозга
Единой первопричины для возникновения аноксического поражения головного мозга до сих пор не выявлено. Но стоит заметить, что имеется масса провоцирующих факторов, способных предшествовать столь страшному явлению. Эти факторы могут препятствовать нормальному кровоснабжению, а кроме того, и поступлению требуемого количества кислорода в мозг ребенка:
- Речь идет об остановке сердца или удушье.
- Воздействие интоксикации химическими веществами, например, порой влияние оказывает даже грязная экология. Стоит заметить, что детский организм очень чувствителен к чистоте окружающей среды.
- Разные вирусы наряду с нейроинфекциями.
- Получение солнечного (или теплового) удара и поражение электрическим током.
- Проведение хирургической операции на сердце или на мозге.
- Наступление комы или клинической смерти.
- Влияние длительной артериальной гипотонии (то есть понижение артериального давления).
Симптоматика этой опасной патологии
Аноксическое поражение головного мозга у новорожденных, как правило, проходит крайне тяжело. Дело в том, что даже наступление кратковременной гипоксии может вызывать приступ удушья наряду с судорогами и внутренним некрозом. К общей симптоматике и признакам аноксии относят:
- Наличие у ребенка эпилептических припадков и судорог.
- Присутствие непроизвольного дрожания конечностей.
- Возникновение нарушения чувствительности.
- Появление сбоя в работе органов слуха и зрения.
- Возникновение светобоязни и повышенной светочувствительности.
- Появление паралича и парезов конечностей.
- Возникновение приступов удушья и нарушения в дыхании.
- Появление сбоя сердечного ритма.
- Возникновение головных болей.
Диагностика данной патологии мозга
Диагностика аноксического поражения головного мозга у детей предполагает прежде всего проведение магнитно-резонансной и компьютерной томографии. Также может понадобиться электроэнцефалография. По результатам всех этих процедур врач может установить верный диагноз и спрогнозировать дальнейшее протекание недуга.
Лечение, как правило, включает в себя два последовательных этапа. Во-первых, это удаление первопричин заболевания наряду с восстановлением организма. На этом этапе необходимо разобраться с тем, что именно послужило причинами аноксии, чтобы устранить ее. А непосредственно на втором этапе требуется прием витаминов наряду с дыхательными тренировками и приемом сосудистых препаратов в целях восстановления работы сердца и сосудов в том числе.
Как и где лечится аноксическое поражение головного мозга?
Преждевременные роды являются главной причиной младенческой смертности и серьезным фактором утраты человеческого потенциала выживших детей в течение последующей жизни. По данным зарубежных авторов, во всем мире ежегодно рождаются несколько миллионов детей с очень низкой массой тела (ОНМТ) [1]. В США 90% из 65 000 новорожденных младенцев с ОНМТ переживают неонатальный период из-за больших успехов в интенсивной терапии, однако у 5—10% этих детей позже обнаруживают детский церебральный паралич [2].
Внедрение современных медицинских технологий в последнее десятилетие отмечено снижением перинатальной и младенческой смертности. Вместе с тем повышение коэффициента выживаемости детей с ОНМТ и экстремально низкой массой тела (ЭНМТ) при рождении влечет за собой повышение заболеваемости и формирование ранней инвалидности [3]. Среди причин детской инвалидности патология нервной системы занимает первое место, а вклад перинатальных поражений достигает 60—80% всех неврологических заболеваний [4]. В России ежегодно из числа освидетельствованных инвалидов с детства признаются трудоспособными не более 2,5—5% по сравнению с 50% за рубежом [5].
Среди факторов, неблагоприятно влияющих на антенатальный период, большое значение имеет нарушение маточно-плацентарного кровообращения, причиной которого могут быть как экстрагенитальная, так и соматическая патология матери [6]. Нарушения маточно-плацентарного кровотока в свою очередь приводят к развитию гипоксии, являющейся центральным звеном патогенеза антенатального повреждения плода, и в первую очередь центральной нервной системы (ЦНС). В работах многих авторов установлен целый комплекс физиологических приспособительных реакций плода к неблагоприятным условиям развития, в частности к гипоксии [7—10]. Однако информации о биохимическом статусе нервной ткани плода и новорожденного при данной патологии недостаточно. Большой интерес в этом плане представляет изучение метаболизма глюкозы, особенностей свободнорадикального окисления и обмена глутамата, процессов некроза и апоптоза.
Внутриутробно плод находится в состоянии гипоксии, однако эта среда для него является физиологической, более того, на ранних этапах эмбрионального периода она необходима для нормальной дифференцировки клеток. Оксигенация плода зависит от градиентов парциального давления кислорода между материнской и плацентарной кровью, плодной кровью и плодной тканью. Известно, что в первые недели после зачатия в эмбриональном периоде уровень парциального давления кислорода (рО2) чрезвычайно низок и составляет около 18—20 мм рт.ст. Предположительно, это необходимо для защиты эмбриона, который очень чувствителен к повреждающему действию реактивных форм кислорода [11]. Гипоксия в эмбриональном периоде вызывает ангиогенез и является предпосылкой для поддержания плюрипотентности стволовых клеток [12]. Примечательно, что в I триместре беременности эмбриональные стволовые клетки развиваются при уровне рО2 около 10—15 мм рт.ст., тогда как в эндометрии рО2 составляет около 25 мм рт.ст. Стволовые клетки демонстрируют более эффективный рост и дифференцировку при низких давлениях кислорода — 10—15 мм рт.ст. [13]. Длительная гипоксия будет стимулировать ангиогенез посредством транскрипционной и посттранскрипционной регуляции факторов роста: фактор роста эндотелия сосудов, эритропоэтин, фактор роста плаценты и ангиопоэтин1 [14].
Основным регулятором адаптивных ответов клетки на гипоксию является индуцированный гипоксией фактор1 (ИГФ-1), гетеродимерный транскрипционный фактор, включающий субъединицы (ИГФ-1α и ИГФ-1β). ИГФ-1α стабилизируется, когда концентрация кислорода ниже определенного критического порога, таким образом, накапливаясь в гипоксической среде. ИГФ-1β присутствует в ядре клетки, и в условиях гипоксии он димеризуется с ИГФ-1α, улучшая доставку кислорода в ткань [15, 16]. На 14—16-й неделе беременности рО2 поднимается до стабильных значений 45—50 мм рт.ст. и сохраняется таковым до конца беременности. На поздних сроках беременности скорость пролиферации и дифференцировки клеток снижается [17, 18]. Процессы перекисного окисления липидов присутствуют с самого начала беременности, что способствует нормальному развитию плода. В конце I триместра физиологический окислительный стресс вызывает регрессию ворсинок, которые были сформированы на всей поверхности хорионического мешка, чтобы сформировать окончательную дискоидную плаценту [19]. Постнатальное увеличение концентрации кислорода вызывает всплеск образования его активных форм, при этом экспрессия антиоксидантных ферментов, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, динамически увеличиваются в течение последних недель беременности. Аналогичным образом повышается доступность наиболее важных неферментативных антиоксидантов: глутатиона, гемоксигеназы, витаминов С и Е, β-каротинов и т. д. [20]. Недоношенный ребенок более подвержен риску свободнорадикального повреждения [21]. Считается, что использование высоких концентраций кислорода во время реанимации новорожденных вызывает гипероксемию. При этом была обнаружена значительная корреляция между окисленным глутатионом (GSSG), рО2 и активностью ферментов окислительно-восстановительного цикла глутатиона [22, 23]. Многие заболевания, связанные с недоношенностью, такие как ретинопатия, бронхолегочная дисплазия, внутрижелудочковые кровоизлияния, связаны со свободнорадикальным повреждением в результате незрелости антиоксидантной системы недоношенных детей [24].
Нервная ткань является наиболее уязвимой при воздействии гипоксии. Гипоксия приводит к нарушению обмена кислорода и углекислоты, что в свою очередь вызывает метаболические расстройства и гемодинамические нарушения [25]. Известны следующие механизмы, лежащие в основе церебрального повреждения при гипоксии-ишемии: местные нарушения обмена макроэргических соединений, чрезмерное перекисное окисление липидов и нарушение Na+/K+-АТФазной активности, внеклеточное накопление К+ и внутриклеточное накопление Са2+, внутриклеточный ацидоз, нарушение обмена нейротрансмиттеров [26]. Основные звенья гипоксически-ишемического стресса представлены P. Marro [27].
— Недостаток кислорода. Дефицит кислорода как акцептора электронов в тканях приводит к нарушению транспорта электронов в цикле Кребса и дыхательной цепи, восполнению энергии путем увеличения мозгового кровотока и анаэробного метаболизма [28].
— Глутамат-кальциевый каскад. Повышение концентрации глутамата активирует N-метил-D-аспартат (NMDA)-рецепторы, что сопровождается увеличением внутриклеточного Са2+ [29]. Нарушения в митохондриях и эндоплазматическом ретикулуме могут привести к дальнейшему накоплению внутриклеточного Ca2+. Повышение концентрации Са2+ внутри клетки способствует образованию свободных радикалов, что в свою очередь вызывает перекисное окисление липидов клеточной и внутриклеточной мембран. Наряду с этим накопление внутриклеточного Са2+ закономерно сопровождается повышением его концентрации в ядре клетки. Избыток внутриядерного Са2+ является фактором активации протоапоптотических генов, которые запускают генетически запрограммированную гибель клетки — апоптоз [30].
— Роль свободных радикалов. Гипоксия-ишемия вызывает неадекватное насыщение митохондриальной цитохромоксидазы, нарушение транспорта электронов в митохондриях, что приводит к повышению концентрации супероксид-аниона и поступлению свободных радикалов из митохондрий в цитоплазму [31]. Повышение концентрации внутриклеточного Са2+ активирует NO-синтетазу, циклооксигеназу и липооксигеназу, что способствует образованию свободных радикалов. Их избыток приводит к дополнительному высвобождению возбуждающих аминокислот и активации NMDA-рецепторов [32].
— Факторы воспаления. Действие гипоксии — ишемии на микроглию способствует синтезу цитокинов, интерлейкина-1β (ИЛ-1β), фактора некроза опухоли α (TNFα) [33]. Активность ИЛ-1β сопровождается продукцией специфических протеаз и развитием апоптоза. Избыточное образование TNFα обладает прямым токсическим эффектом и вызывает сосудистую инфильтрацию с высвобождением цитотоксических факторов, активных форм кислорода и цитокинов [34].
— Роль оксида азота (NO). NO-синтетаза содержится в эндотелиальных клетках, астроцитах, нейронах. Существует 3 изоформы NO-синтетазы: нейронная (регулирует синаптогенез и ремоделирование и зависит от Са2+); эндотелиальная (регулирует сосудистый тонус, особенно вазодилатацию, и зависит от Са2+); индуцируемая (присутствует в макрофагах и астроцитах, индуцируется цитокинами, независима от Са2+) [35]. Активация NMDA-рецепторов вызывает продукцию нейронной NO-синтетазы, которая способствует образованию радикала оксида азота (NO.) и повреждению нейрональной ДНК [36].
— Апоптоз. Описанные выше процессы развиваются в первые минуты острой гипоксии, после чего включается механизм апоптоза [37]. Гипоксия через ряд звеньев патогенеза способствует накоплению внутриклеточного Са2+, активации эндонуклеаз, повреждению экспрессии генов. Это приводит к растормаживанию фагоцитарной активности глиальных клеток и нейронов, которые фагоцитируют поврежденный нейрон, вызывая уменьшение его размера и секвестрацию [38].
Наиболее значительные потери клеток нервной ткани развиваются спустя 2—6—48 ч после рождения, вследствие патологического окислительного стресса. В таких условиях в первые часы и сутки жизни после рождения у новорожденных, перенесших гипоксию, развивается выраженный дисбаланс в системе регуляции церебрального кровообращения, который обостряет течение ишемического процесса [39].
Особенностью недоношенных детей является незрелость антиоксидантной системы, поскольку физиологическое увеличение антиоксидантной способности происходит в конце беременности, именно поэтому они более подвержены воздействию окислительного стресса, особенно когда их состояние требует проведения респираторной терапии [40]. В связи с этим возникает необходимость изучения окислительного стресса у этих детей, в частности путем измерения продуктов перекисного окисления липидов и компонентов антиоксидантной системы.
Известно, что антиоксиданты обладают противовоспалительной активностью, а систему глутатиона рассматривают как критический фактор развития воспаления и иммунных ответов [41, 42]. Это подтверждается изменением уровня цитокинов, острофазных белков и глутатиона во время воспаления [43, 44]. Система глутатиона включает его формы, ряд ферментов его синтеза и катаболизма, и механизмы транспорта. Все эти компоненты вносят важный вклад в изменение глутатионового статуса [45].
Изучая классификацию церебральных поражений у новорожденных, необходимо отметить, что наиболее популярной у неонатологов является классификация гипоксической энцефалопатии по H. Sarnat и M. Sarnat [46]. Она объединяет клинические признаки церебральной ишемии и результаты электроэнцефалографии (ЭЭГ). В данной классификации оцениваются основные показатели новорожденного: уровень сознания, нерво-мышечный статус, рефлексы, вегетативная функция, наличие судорог, ЭЭГ. В зависимости от выраженности церебральной дисфункции устанавливают I, II или III стадию энцефалопатии. Канадские неонатологи модифицировали классификацию Sarnat, дополнив ее расстройствами терморегуляции и исключив ЭЭГ и некоторые другие показатели [47]. Неонатологи Великобритании используют классификацию гипоксических церебральных нарушений L. Dubowitz и соавт.[48]. В международной классификации болезней 11-го пересмотра (МКБ-11) гипоксически-ишемические поражения головного мозга у новорожденных относятся к группе «неврологических расстройств, характерных для перинатального и неонатального периодов» [49]. Основным отличием от классификации 10-го пересмотра является то, что в МКБ-11 данная группа дополнена заболеваниями, которые ранее не выделяли отдельно. Например, перинатальный артериальный инсульт и неонатальный церебральный синовенозный тромбоз. В то же время из предложенной классификации была исключена врожденная гидроцефалия. Диагноз асфиксии новорожденного поместили в «группу других нарушений, возникающих в перинатальном периоде». При этом отдельно выделили асфиксию новорожденного с оценкой по шкале Апгар 0—3 балла и асфиксию новорожденного с оценкой по шкале Апгар 4—6 баллов. Что касается церебральных повреждений гипоксически-геморрагического характера, то их отнесли к группе «геморрагических и гематологических нарушений у плода и новорожденного». При этом несколько изменилась классификация внутрижелудочковых кровоизлияний. В МКБ-11 принято выделять 4 степени внутрижелудочковых кровоизлияний, в то время как в МКБ-10 3-я и 4-я степени были объединены.
Симптомы тяжелого повреждения ЦНС могут проявляться не сразу после рождения, а спустя несколько часов. При этом клиническая симптоматика не всегда отражает истинную степень тяжести заболевания. В связи с этим особую актуальность приобретает прижизненная оценка изменений, возникающих в клетках нервной ткани в раннем неонатальном периоде. Ультразвуковое исследование (УЗИ) позволяет выявить структурные изменения головного мозга новорожденных при перинатальном гипоксическом поражении ЦНС. Анализ ультразвуковых и патоморфологических данных свидетельствует о том, что характер ишемического поражения головного мозга зависит не только от тяжести перинатальной гипоксии, но и от зрелости ребенка [50]. У доношенных новорожденных ишемия мозга сопровождается возникновением избирательного нейронального некроза, субкортикальной и мультикистозной энцефаломаляциями, инфарктами мозга [51]. Тяжелая перинатальная гипоксия у недоношенных 34—37-й недель гестации, как правило, приводит к развитию перивентрикулярной лейкомаляции. В связи с выхаживанием глубоко недоношенных детей с ЭНМТ при УЗИ стали чаще выявлять такие формы ишемического повреждения, как диффузная лейкомаляция и перивентрикулярный геморрагический инфаркт. Следует отметить, что в первые 24—48 ч дебюта неонатального артериального ишемического инсульта данный метод не обладает достаточной чувствительностью и специфичностью, так как очаг ишемического поражения начинает появляться только на 2—3-и сутки от начала ишемии, что связано с ходом патогистологических процессов. Выраженность воспалительной реакции, интенсивность некроза и апоптоза достигают своего пика через 48—72 ч после нарушения кровообращения [52]. Это приводит к изменению эхогенности поврежденной мозговой паренхимы. Дальнейшая оценка эволюции ишемического очага не уступает по информативности магнитно-резонансной томографии (МРТ) [53, 54]. Повысить чувствительность УЗИ на ранних сроках церебрального повреждения помогает применение ультразвуковой допплерографии. Дуплексное сканирование позволяет объективно оценить гемодинамические характеристики церебральных сосудов. Ценность ультразвуковой допплерографической методики в остром периоде заболевания — выявление фазы вазодилатации, наиболее раннего признака ишемического повреждения, возникающего уже через 30 мин после развития сосудистой катастрофы и сохраняющегося в течение первых 5—6 сут [55]. Вазодилатация развивается в ответ на действие различных метаболитов и способствует увеличению поступления в ишемизированную ткань глюкозы и кислорода. Ее характерными признаками являются повышение скорости кровотока и снижение индексов периферического сопротивления в поврежденном сосудистом бассейне [56, 57]. МРТ стала наиболее информативным методом диагностики перинатальных повреждении головного мозга. Наличие различных импульсных последовательностей обеспечивает высокую чувствительность и специфичность, даже на ранних сроках развития сосудистой катастрофы [58, 59]. МРТ с получением диффузионно-взвешенных изображений и построением карт измеряемого коэффициента диффузии (ИКД) позволяет выявить ишемический очаг уже через 30 мин от момента его возникновения. ИКД служит количественной характеристикой диффузии в ткани и отражает наличие внутриклеточного отека [60]. Представленные диагностические методы необходимы для выявления, определения локализации, степени тяжести повреждения мозга и прогноза. Недостатками их являются короткий временной диагностический интервал и ограниченная возможность повторного исследования [61]. В течение последних 20 лет для прогнозирования исходов церебрального повреждения у новорожденных изучается диагностическая ценность биомаркеров [62, 63]. Учитывая патофизиологические изменения, происходящие в результате повреждения ткани головного мозга, были подробно изучены нейропротеины, кальций-связывающий белок, вазоактивные вещества, маркеры окислительного стресса, медиаторы воспаления и т. д. [64—67]. Однако, несмотря на перспективность изучения биомаркеров, отсутствуют данные о практическом их применении в медицине.
Лечение гипоксических поражений головного мозга является предметом жарких дискуссий и крайних мнений — от полного отказа в необходимости лечения нейротропными препаратами до агрессивной полипрагмазии [26]. Согласно современным воззрениям гипоксически-ишемическая энцефалопатия возникает при асфиксии, как правило, в структуре полиорганных расстройств, поэтому основной принцип терапии заключается в выведении ребенка из асфиксии и поддержании витальных функций [68]. Специфическое лечение гипоксически-ишемической энцефалопатии — терапия отека головного мозга и нейропротекция, которая подразумевает в первую очередь контроль объема цереброспинальной жидкости (ЦСЖ), церебральной перфузии и объема вещества мозга. Церебральная перфузия зависит от артериального притока, венозного оттока и интенсивности метаболизма нервной ткани. На этом этапе большое значение имеет адекватность проводимой искусственной вентиляции легких и эффективность гипотермии. Необходимо отметить, что гипотермия проводится у новорожденных с гестационным возрастом не менее 36 нед при наличии по крайней мере одного из признаков, изложенных в специальных критериях [69]. Контроль объема жидкости в ЦСЖ-путях осуществляется за счет торможения выработки ЦСЖ и улучшения ее оттока. Контроль объема мозга подразумевает усиление активного транспорта и стабилизацию мембран нейронов. Следует отметить, что на данный момент применение лекарственных препаратов в неонатологии ограничено из-за высокого риска развития побочных эффектов и отсутствия доказательной базы. Однако поиск таких препаратов продолжается по настоящее время. В частности, за последние два десятилетия произошли значительные изменения в понимании роли эритропоэтина в качестве нейропротектора. Доказано, что эритропоэтин участвует в нейрогенезе и ангиогенезе во время эмбрионального развития и активируется после травмы головного мозга [70], а также оказывает цитопротективное действие на эндотелиальные, глиальные клетки и нейроны [71]. Впервые нейропротективная роль эритропоэтина была выявлена в нескольких исследованиях in vitro
и
in vivo
[72]. При этом удалось выяснить, что эритропоэтин обладает антиапоптотическим [73], антиоксидантным [74] и противовоспалительным эффектами [75]. Кроме того, он ослабляет эффекты воспаления, снижая реактивный астроцитоз и подавляя активацию микроглии, и уменьшает количество иммунных клеток в месте воспаления [76]. Известно, что отсутствие эндогенного эритропоэтина увеличивало ишемическое повреждение головного мозга и ухудшало выживаемость нейронов [77]. Установленные защитные эффекты эритропоэтина во время ишемии и реперфузии побудили использовать рекомбинантный эритропоэтин у недоношенных детей с церебральной ишемией, внутрижелудочковыми кровоизлияниями и перивентрикулярной лейкомаляцией [78]. Так, в одном из исследований оценивали эффективность и безопасность применения эритропоэтина при неонатальной гипоксически-ишемической энцефалопатии. В данное исследование были включены 167 новорожденных с умеренным и тяжелым церебральным поражением. Всех детей разделили на две группы. Дети первой группы получали стандартную терапию гипоксически-ишемической энцефалопатии, а детям второй группы к стандартной терапии был добавлен эритропоэтин в дозировке 300 и 500 ЕД/кг. Препарат вводили в первые 48 ч через день в течение 2 нед. Оказалось, что летальность и инвалидность на 19,2% чаще встречалась в группе детей, не получавших эритропоэтин [79].
Таким образом, проблема церебрального повреждения ишемического типа у недоношенных новорожденных является весьма актуальной. Прежде всего это подтверждается высокой частотой встречаемости данной патологии и большим риском летального исхода и инвалидизации детей. Остается открытым вопрос комплексной диагностики церебральных нарушений у недоношенных детей, потому как не существует единого алгоритма, объединяющего данные клинической картины, инструментальных и лабораторных методов исследования. Большой интерес представляет поиск предикторов неблагоприятного исхода с целью оптимизации лечебных подходов.
Авторы заявляют
оботсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Анурьев А.М. — https://orcid.org/0000-0002-6724-5067; e-mail
Горбачев В.И. — https://orcid.org/0000-0001-6278-9332
Как цитировать:
Анурьев А.М., Горбачев В.И. Гипоксически-ишемические поражения головного мозга у недоношенных новорожденных. Журнал неврологии и психиатрии им. С.С. Корсакова.
2019;119(8 вып. 2):63-69. https://doi.org/10.17116/jnevro201911908263
Автор, ответственный за переписку:
— Анурьев Алексей Михайлович — e-mail
Методы борьбы с данным недугом
Итак, как уже стало понятно, лечение возникшего недуга предусматривает, как правило, несколько этапов. При остро возникшем заболевании необходимо в экстренном порядке полностью исключить влияние факторов, приводящих к аноксии:
- Ребенку требуется санация дыхательных путей.
- Удаление инородного тела.
- Необходимо вынести пациента из зоны действия углекислого газа.
- Требуется прекращение странгуляции.
- Препятствование воздействию электрического тока.
На этом этапе необходимо поддерживать в норме кровообращение и поступление кислорода, в некоторых случаях используют аппараты искусственного дыхания. При этом поддержка осуществляется на уровне, который не должен допускать необратимых изменений в мозге. При наличии сохраненного естественного дыхания ребенку требуются кислородные ингаляции и транспортировка в стационар. В случае неэффективности дыхания потребуется интубация.
Гипоксические поражения ЦНС
Раздел I
Гипоксические поражения ЦНС
I. А) P 91.0 Церебральная ишемия (гипоксически- ишемическая энцефалопатия, перинатальное гипоксическое поражение мозга)
Церебральная ишемия I-й степени (легкая)
а) Интранатальная гипоксия, легкая асфиксия при рождении;
б) Возбуждение ЦНС чаще у доношенных, угнетение — у недоношенных, длительностью не более 5-7 суток;
в) Умеренные гипоксемия, гиперкарбия, ацидоз;
НСГ, КТ, МРТ — без патологических отклонений;
ДЭГ- компенсаторное повышение скорости по магистральным артериям мозга;
Пример диагноза:
Р 91.0 «Церебральная ишемия I степени» или «Гипоксически-ишемическое поражение ЦНС I степени»
Церебральная ишемия II-й степени (средней тяжести)
а) Факторы, свидетельствующие о внутриутробной гипоксии плода; асфиксия средней тяжести при рождении; экстрацеребральные причины церебральной гипоксии, возникшие постнатально;
б) Угнетение ЦНС, возбуждение или смена фаз церебральной активности (длительностью более 7 дней);
Судороги у недоношенных чаще тонические или атипичные (судорожные апноэ, стереотипные спонтанные оральные автоматизмы, трепетание век, миоклонии глазных яблок, «гребущие» движения рук, «педалирование» — ног); у доношенных — мультифокальные клонические; Приступы обычно кратковременные, однократные, реже повторные;
Внутричерепная гипертензия (транзиторная, чаще у доношенных);
Вегетативно-висцеральные нарушения;
в) Нарушения метаболизма (гипоксемия, гиперкарбия, ацидоз более выражены и стойкие)
НСГ — — локальные гиперэхогенные очаги в мозговой ткани (у недоношенных чаще в перивентрикулярной области; у доношенных субкортикально.
МРТ — очаговые повреждения в паренхиме мозга определяются в виде изменения характера магнитно-резонансного сигнала на Т1 и Т2-взвешенных изображениях.
КТ-головного мозга — локальные очаги пониженной плотности в мозговой ткани (у недоношенных чаще в перивентрикулярной области; у доношенных субкортикально и/или кортикально.
ДЭГ — признаки гипоперфузии в средней мозгой артерии у доношенных и передней мозговой артерии у недоношенных. Увеличение диастолической составляющей скорости кровотока, снижение индекса резистентности.
Пример диагноза:
Р 91.0 «Церебральная ишемия II степени» или «Гипоксически-ишемическое поражение ЦНС II степени».
В случаях диагностики конкретных структурных изменений мозга выставляется дополнительный шифр (например Р 91.2 церебральная лейкомаляция новорожденного).
Церебральная ишемия III й степени (тяжелая)
а) Факторы приводящие к внутриутробной гипоксии плода и/или тяжелой перинатальной асфиксии; экстрацеребральные причины стойкой гипоксии мозга (ВПС, тяжелые формы СДР, гиповолемический шок и др.);
б) Прогрессирущая потеря церебральной активности — свыше 10 дней
(в первые 12 часов жизни глубокое угнетение или кома, в период с 12-24 кратковременное нарастание уровня бодрствования, с 24-72 часов- нарастание угнетения или кома
- Повторные судороги, возможен эпистатус.
- Дисфункция стволовых отделов мозга (нарушения ритма дыхания, зрачковых реакций, глазодвигательные расстройства).
- Поза декортикации или децеребрации (зависит от обширности поражения).
- Выраженные вегетативно висцеральные нарушения.
- Прогрессирующая внутричерепная гипертензия.
в) Стойкие метаболические нарушения.
НСГ — диффузное повышение эхогенности мозговой паренхимы — характерно для доношенных. Повышение эхогенности перивентрикулярных структур — характерно для недоношенных. Сужение боковых желудочков. В последующем образуются кистозные перивентрикуляные полости (ПВЛ) у недоношенных, и появляются признаки атрофии больших полушарий головного мозга с пассивным расширением ликворных пространств.
КТ — снижение плотности мозговой паренхимы, сужение ликворных пространств, мультифокальные кортикальные и субкортикальные очаги пониженной плотности, изменение плотности базальных ганглиев и таламуса — преимущественно у доношенных, перивентрикулярные кистозные полости — у недоношенных ( Уточнить у рентгенолога)
МРТ — поражения в паренхиме мозга определяются в виде изменения магнитно-резонансного сигнала на Т1 и Т2-взвешенных изображениях.
ДЭГ- паралич магистральных артерий мозга, с переходом в стойкую церебральную гипоперфузию. Снижение диастолической скорости кровотока, изменение характера кривой (лизинговый или маятникообразный ее характер). Увеличение индекса резистентности.
Пример диагноза:
Р 91.0 «Церебральная ишемия III степени» или «Гипоксически-ишемическое поражение ЦНС III степени».
В случаях диагностики конкретных структурных изменений мозга выставляется дополнительный шифр (см. приложение).
I. Б) Р 52 ВНУТРИЧЕРЕПНЫЕ КРОВОИЗЛИЯНИЯ
(гипоксические, нетравматические)
Р 52.0 Внутрижелудочковое кровоизлияние I степени (субэпендимальное)
а) Анте- и — интранатальная гипоксия, легкая асфиксия при рождении, повторные приступы апноэ, струйное введение гиперосмомолярных растворов.
б) Развивается преимущественно у недоношенных или незрелых новорожденныхю Течение: бессимтомное, отсутствие специфических неврологических нарушений
в) Транзиторные метаболические нарушения
НСГ — гиперэхогенные участки, одно- или двусторонней локализации в талямо-каудальной вырезке или в области головки хвостатого ядра. Сроки трансформации субэпендимальной гематомы в кисту -10-14 дней и более.
КТ, МРТ — не имеют диагностических преимуществ перед НСГ.
ДЭГ — без патологических изменений.
Р 52.1 Внутрижелудочковое кровоизлияние II степени
(субэпендимальное + интравентрикулярное)
Развивается преимущественно у недоношенных (в 35-65%).
а) Факторы свидетельствующие о внутриутробной гипоксии плода и/или асфиксия средней тяжести при рождении. Дефекты при оказании первичной реанимационной помощи, артериальная гипертензия или флюктуация системного АД вследствие СДР, ятрогенных факторов (неадекватные режимы ИВЛ, быстрое введение больших объемов или гиперосмомолярных растворов, функционирующие фетальные коммуникации, пневмоторакс и др.). Коагулопатии.
б) Встречаются 2 основных варианта течения: постепенное (волнообразное) и катастрофическое.
- Катастрофическое течение: кратковременное двигательное возбуждение внезапно сменяется прогрессирующим угнетением церебральной активности с переходом в кому. Глубокое апноэ, нарастающие цианоз и «мраморностью» кожных покровов. Тонические судороги, глазодвигательные расстройства, брадиаритмия, нарушения терморегуляции свидетельствуют о нарастающей внутрижелудочковой гипертензии.
- Постепенное течение (волнообразное): периодическая смена фаз церебральной активности, приступы повторных апноэ, мышечная гипотония, атипичные судорожные приступы.
в) Флюктуация, а затем быстрое снижение системного АД (ср. АД < 30 mm Hg)
Падение гематокрита и снижение уровня гемоглобина
Нарушения метаболизма: гипоксемия, гиперкабия, ацидоз, гипокальцемия, колебания уровня глюкоз0ы в сыворотке крови
СМЖ — с примесью крови (по микроскопической характеристике и количеству эритроцитов судят о времени возникновения кровотечения и его интенсивности), реактивный плеоцитоз, повышение уровня белка, снижение глюкозы. При люмбальной пункции давление чаще повышено.
НСГ -изменения зависят от времени проведения исследования, на начальных стадиях определяются гиперэхогенные зоны в области герминативного матрикса, затем развивается вентрикуломегалия, в последующем визуализируются эхопозитивные образования (тромбы) в просветах желудочков. В отдельных случаях возможна блокада ликворных путей с развитием острой гидроцефалии.
КТ, МРТ, ПЭТ — не имеют диагностических преимуществ в периоде новорожденности перед НСГ
ДЭГ — флюктуация кровотока в главных артериях мозга до развития интраветрикулярного кровотечения, стабилизация — после кровоизлияния, при прогрессировании вентрикуломегалии (обычно через 10-12 дней) — нарастающая гипоперфузия.
Р 52.2 Внутрижелудочковое кровоизлияние III степени
(субэпендимальное + интравентрикулярное+ перивентрикулярное)
Среди всех вариантов ВЖК на их долю приходится от 12 до 17%.
б) Наиболее часто наблюдается у недоношенных с экстремально низкой массой тела.
- Типично катастрофическое течение. Стремительное угнетение церебральной активности с развитием комы, прогрессирующее расстройство витальных функций (брадикардия, аритмия, апноэ, патология ритма дыхания).
- Тонические судороги, глазодвигательные расстройства возникают вследствие дислокации ствола головного мозга. Высокая частота летальных исходов в первые дни жизни.
в) Тяжелые, трудно поддающиеся коррекции, нарушения метаболизма (гипоксемия, гиперкарбия, ацидоз, электролитные нарушения), ДВС- синдром.
Прогрессирующее падение системного АД и нарушения сердечного ритма. Критическое падение гематокрита и уровня гемоглобина
СМЖ — со значительной примесью крови (по микроскопической характеристике и количеству эритроцитов судят о времени возникновения кровотечения и его интенсивности), часто отмечается реактивный плеоцитоз, повышение уровня белка, давление ликвора чаще бывает повышено.
Диагностическая люмбальная пункция проводится по строгим показаниям и крайне осторожно, вследствие высокого риска вклинения ствола головного мозга в большое затылочное отверстие.
НСГ — обширная гиперэхогенная область перивентрикулярной локализации (геморрагический инфаркт — чаще односторонний в лобно-теменной области), боковой желудочек на стороне кровоизлияния практически не визуализируется, позднее выявляется вентрикуломегалия и деформация бокового желудочка за счет формирования порэнцефалической постгеморрагической кистозной полости. Часто в просвете желудочков визуализируются тромбы, в комбинации с выраженной дилятацией желудочковой системы. В последующем повышение эхогенности стенок желудочков обусловленное развитием асептического вентрикулита и гемосидероза перивентрикулярной паренхимы. В значительном проценте случаев формируется окклюзионная гидроцефалия.
КТ, МРТ, ПЭТ — не имеют диагностических преимуществ в периоде новорожденности перед НСГ
ДЭГ — на начальных стадиях снижение систолодиастолической скоростей кровотока, увеличение индекса резистентности
Снижение диастолической скорости кровотока, снижение индекса резистентности.
Р 52. 5 Первичное субарахноидальное кровоизлияние (нетравматическое)
Частота около 20%, из них в 75% — у недоношенных и незрелых
а) Интранатальная гипоксия, асфиксия при рождении. Малый срок гестации, незрелость. Коагулопатии.
б) Варианты клинического течения:
- Бессимптомное,
- Синдром возбуждения с гиперестезией и острой внутричерепной гипертензией (напряжение и выбухание большого родничка, расхождение стреловидного и венечного швов, обильные срыгивания, непостоянный симптом Грефе);
- Судороги, внезапно возникающие на 2-3 сутки жизни (фокальные клонические — чаще у доношенных), атипичные судороги (у недоношенных).
в) Метаболические нарушения не типичны
НСГ — мало информативна для диагностики ПСК. В отдельных случаях визуализируется расширение Сильвиевой борозды и/или межполушарной щели.
КТ и МРТ — обнаруживается скопление крови в различных отделах субарахноидального пространства, но чаще в височных областях.
ДЭГ — мало информативна (первичный и вторичный вазоспазм).
СМЖ — давление повышено, увеличено содержание эритроцитов (в том числе и измененных), повышена концентрация белка, нейтрофильный плеоцитоз.
Р 52.4 Кровоизлияние в вещество головного мозга (нетравматическое)
паренхиматозное
Р 52.6 кровоизлияние в мозжечок и заднюю черепную ямку
(встречаются редко)
а) Внутриутробная гипоксия плода, тяжелая или средней тяжести асфиксия при рождении. Коагулопатии. Недоношенность. Сосудистые мальформации.
б) Клиническая картина зависит от локализации и объема геморрагического инфаркта.
- При рассеянных петехиальных кровоизлияниях субкортикальной локализации возможно бессимптомное течение.
- При обширных паренхиматозных гематомах полушарной локализации клиническое течение сходно с ВЖК III степени. Прогрессирующая потеря церебральной активности с переходом в ступор или кому, очаговая неврологическая симптоматика контрлатерально очагу поражения (отчетливая асимметрия мышечного тонуса, фокальные или тонические судороги, глазодвигательные нарушения и др.); нарастающая внутричерепная гипертензия.
- Кровоизлияния в заднюю черепную ямку и мозжечок характеризуются нарастающими признаками внутричерепной гипертензии (напряжение родничков, расхождение затылочного шва, возбуждение, частые тонические судороги) и стволовыми нарушениями (дыхательные, сердечно-сосудистые нарушения, глазодвигательные расстройства, бульбарный синдром).
в) Тяжелые, метаболические нарушения, трудно корригируемые (гипоксемия, гиперкарбия, ацидоз, ДВС- синдром) обычно сопутствуют массивным гематомам. Прогрессирующее повышение системного АД, в последующем сменяется его падением. Нарушения сердечного ритма. Снижение гематокрита и уровня гемоглобина коррелирует с объемом кровотечения.
СМЖ — давление повышено, увеличено содержание эритроцитов (в том числе и измененных), повышена концентрация белка, нейтрофильный плеоцитоз в ликворе. За исключением случаев мелкоочаговых паренхиматозных кровоизлияний.
НСГ — мало информативна при мелкоточечных кровоизлияниях, массивные геморрагические инфаркты визуализируются как асимметричные гиперэхогенные очаги в мозговой паренхиме. Через 2-3 недели на их месте формируются эхонегативные полости (псевдокисты, лейкомаляции). Возможно контрлатеральное смещение межполушарной щели и гомолатеральная компрессия бокового желудочка.
КТ — очаги повышенной плотности в паренхиме мозга, различные по размерам и локализации, сопутствующая деформация ликворных пространств.
МРТ — изменение МР-сигнала от очагов кровоизлияния не в острой стадии.
ДЭГ — асимметричная гипоперфузия в церебральных артериях на стороне поражения.
I. В) Сочетанные ишемические и геморрагические
поражения ЦНС (нетравматические)
Встречаются значительно чаще,
чем все рассмотренные выше изолированные формы повреждений ЦНС
(возникают преимущественно у недоношенных)
а) Внутриутробная гипоксия и асфиксия при рождении. Недоношенные с малой массой тела (1000-1500 г). Дефекты при оказании первичной реанимационной помощи, артериальная гипотензия, гипертензия или флюктуация системного АД. Коагулопатии, ДВС-синдром.
Б) Клиническая картина зависит от ведущего типа повреждения ЦНС (ишемии или кровоизлияния), его тяжести и локализации. Отмечается значительная вариабельность неврологической симптоматики и ее динамики. Данные виды повреждений являются наиболее тяжелыми.
в) Трудно поддающиеся коррекции, нарушения метаболизма.
СМЖ — давление, как правило, повышено; морфологическая характеристика зависит от степени кровоизлияния в ликворные пространства.
НСГ, КТ, МРТ- различные варианты деформации ликворопроводящей системы, очаги измененной плотности, отличающиеся по интенсивности, преимущественно перивентрикулярной локализации.
ДЭГ — флюктуация церебрального кровотока; паралич магистральных артерий мозга, снижение кровотока.
Пример диагноза:
«Сочетанное (нетравматическое) ишемически-геморрагическое поражение ЦНС.»
В случаях диагностики конкретных структурных изменений мозга выставляются комбинации шифров, соответствующих ишемическим и геморрагическим внутричерепным повреждениям (см. приложение).
Раздел II
Травматические повреждения нервной системы.
II. А) P 10 Внутричерепная родовая травма
(Разрыв внутричерепных тканей и кровоизлияние вследствие родовой травмы)
Р 10.8 Эпидуральное кровоизлияние
(встречается преимущественно у доношенных,
с частотой около 2% среди всех внутричерепных кровоизлияний).
а) Аномалии родов: несоответствие родовых путей размерам головки плода, аномалии предлежания, инструментальное родоразрешение.
б) Быстро нарастающая внутричерепная гипертензия в первые часы жизни;
- Гипервозбудимость;
- Судороги;
- На стороне гематомы иногда расширение зрачка. Часто сочетается с кефалгематомой.
в) Нарушения метаболизма при изолированной эпидуральной гематомы не типичны.
СМЖ — не информативна.
НСГ — мало информативна (зависит от локализации и объема гематомы).
КТ — лентовидной формы высокоплотное образование между твердой мозговой оболочкой и покровными костями черепа. В ряде случаев область гематомы имеет форму «двояковыпуклой линзы», прилегающей к покровным костям черепа.
ДЭГ — не информативна.
Р 10.0 Субдуральное супратенториальное кровоизлияние
(Истинная распространенность не известна, чаще у доношенных
свыше 4000 г. и переношенных, в 40% случаев двусторонние, )
а) См. раздел «Эпидуральное кровоизлияние»
б) Встречаются следующие варианты клинических проявлений:
- Бессимптомное течение;
- Очаговые неврологические нарушения, развивающиеся в первые 72 часа жизни: гемипарез (на стороне противоположной гематоме); отклонение глаз в сторону, противоположную гемипарезу («глаза смотрят» на гематому); расширение зрачка на стороне повреждения;
- Фокальные (очаговые) судороги
- Различный по степени выраженности гипертензионный синдром или гипервозбудимость.
в) Нарушения метаболизма при изолированной субдуральной гематоме конвекситальной локализации не типичны.
Трансиллюминация черепа — доступный и информативный метод диагностики. Определяется ограниченный очаг пониженного свечения над гематомой.
НСГ — при малых и плоских субдуральных гематомах конвекситальной локализации, мало информативна, при значительных по размерам кровоизлияниях отмечаются признаки сдавления гомолатерального полушария и смещение срединных структур в сторону противоположную очагу.
КТ и МРТ — наиболее информативные методы диагностики СДК надполушарной локализации. Кровоизлияние визуализируется в виде «серпообразной» зоны повышенной плотности, прилежащей к своду черепа.
ДЭГ — снижение скорости кровотока в средней мозговой артерии на стороне гематомы.
СМЖ — изменения мало специфичны, люмбальную пункцию следует проводить с большой осторожностью вследствие высокого риска вклинения миндалин мозжечка в большое затылочное отверстие, либо височной доли в вырезку намета мозжечка.
Р 10.4 Субдуральное субтенториальное (инфратенториальное) кровоизлияние
(Встречаются редко, чаще у доношенных массой
свыше 4000 г. и переношенных)
а) Аномалии родов: (несоответствие родовых путей размерам головки плода, ригидные родовые пути и др.), патологические варианты предлежания плода (чаще ягодичное), инструментальное родоразрешение.
б) Варианты течения:
- Катастрофическое — с первых минут и часов жизни развиваются признаки сдавления ствола головного мозга: прогрессирующая потеря церебральной активности — кома, поза опистотонуса, расходящееся косоглазие, нарушение зрачковых реакций, плавающие движения глазных яблок, фиксированный взор. Прогрессирование дыхательных и сердечно-сосудистых нарушений.
- Отсроченное или подостро-прогрессирующее — после периода относительного благополучия (продолжительностью от нескольких часов или дней, реже недель), нарастают признаки внутричерепной гипертензии (напряжение родничков, расхождение затылочного шва, возбуждение, частые тонические судороги) и компрессии ствола мозга (дыхательные и сердечно-сосудистые нарушения, глазодвигательные, бульбарный синдром).
Наиболее частый исход — летальный.
в) Трудно поддающиеся коррекции, нарушения метаболизма. Прогрессирующие снижение АД, брадиаритмия, анемия.
НСГ — деформация IV желудочка, в отдельных случаях определяются зоны повышенной эхогенности в области структур задней черепной ямки. Определяются тромбы в большой цистерне мозга.
КТ — позволяет выявлять обширные гематомы задней черепной ямки, которые визуализируются как зоны повышенной плотности
МРТ- наиболее информативна для обнаружения незначительных по объему гематом при подостром течении.
СМЖ — люмбальная пункция не показана ввиду высокого риска вклинения миндалин мозжечка в большое затылочное отверстие.
ДЭГ — не информативна.
Р 10.2 Внутрижелудочковое кровоизлияние травматические
(встречаются редко, преимущественно у доношенных)
а) Затяжные роды, особенно в сочетании с перинатальной гипоксией, быстрая ротация головки, форсированное извлечение плода. Коагулопатии.
б) Манифестация — 1-2 дни жизни (у новорожденных с травмой и/или асфиксией) у новорожденных с неясной этиологией, (у 25% ) — иногда на 2 — 4 неделе жизни.
- Гипервозбудимость сменяющаяся угнетением, судороги (фокальные или мультифокальные), нарушения ритма дыхания (вторичные апноэ).
- Прогрессирующая внутричерепная гипертензия (рвота, выбухание родничка, расхождение черепных швов).
- Гидроцефалия
в) Специфических метаболических нарушений не имеется.
НСГ — вентрикуломегалия, неравномерное повышение эхогенности сосудистых сплетений, деформация их контуров и увеличение размеров. Определение эхопозитивных тромбов в просветах желудочков.
КТ, МРТ — не имеют очевидных диагностических преимуществ.
ДЭГ — не информативна
СМЖ — давление повышено, примесь крови определяется в случаях проникновения крови в субарахноидальные пространства, повышен уровень белка, смешанный плеоцитоз (см. выше).
P 10.1 Паренхиматозное кровоизлияние (геморрагический инфаркт)
(Встречаются редко, чаще у доношенных массой
свыше 4000 г. и переношенных)
а) Аномалии родов: (несоответствие родовых путей размерам головки плода, ригидные родовые пути и др.), патологические варианты предлежания плода, инструментальное родоразрешение. (Предрасполагающие факторы — гипоксия, очаги ишемии коагулопатии, сосудистые мальформации, опухоли)
б) Клиническая картина зависит от локализации и объема кровоизлияния.
Кровоизлияния в полушария мозга — течение:
- Асимптомное;
- Нарастающее угнетение с постепенной потерей церебральной активности, переходом в кому, нередко с очаговой симптоматикой (гемисиндромы, фокальные клонические судороги),
- Внутричерепная гипертензия (за счет перифокального отека мозга).
Кровоизлияния внутримозжечковые — течение
- Бессимптомное (при кровоизлиянии в краевые отделы полушарии мозжечка);
- Нарастающая внутричерепная гипертензия (напряжение родничков, расхождение затылочного шва, возбуждение, частые тонические судороги).
- Компрессия ствола мозга (дыхательные и сердечно-сосудистые нарушения, глазодвигательные, бульбарный синдром) — при массивных кровоизлияниях в полушария мозжечка.
в) Метаболические нарушения не специфичны.
НСГ — различные по величине и локализации асимметричные гиперэхогенные участки в полушариях мозга, при массивной гематоме — признаки компрессии гомолатерального желудочка и смещение межполушарной щели. В полушариях мозжечка визуализируются — гиперэхогенные очаги (при значительных внутримозжечковых кровоизлияниях).
КТ, МРТ — более информативны для выявления различных по локализации и размерам паренхиматозных гематом (особенно субкортикальных и небольших по размерам).
ДЭГ — мало информативна в остром периоде, в дальнейшем признаки церебральной гипоперфузии.
Р 10.3 Субарахноидальное кровоизлияние травматическое
(встречаются редко преимущественно у доношенных)
а) Аномалии родов: (несоответствие родовых путей размерам головки плода, быстрые роды, ригидные родовые пути и др.), патологические варианты предлежания плода, инструментальное родоразрешение, сочетаются в 25% случаев с линейными и вдавленными переломами черепа. (Предрасполагающие факторы — гипоксия, коагулопатии, сосудистые мальформации, опухоли)
б) В течение первых 12 часов жизни нарастает угнетение церебральной активности вплоть до комы. В отдельных случаях наблюдается «бодрствующая» кома: глаза широко открыты, пронзительный мозговой крик, поза декортикации (флексия рук, экстензия ног).
- Гиперестезия;
- Гипервозбудимость;
- Быстро нарастающая наружная гидроцефалия (расхождение черепных швов, выбухание родничков);
- Генерализованные судороги (возникающие в первые часы жизни).
в) Метаболические нарушения не специфичны. Постгеморрагическая анемия, АД снижено (сосудистый шок) в первые часы, в последующем не контролируемая системная артериальная гипертензия.
НСГ — возможно повышение эхоплотности субкортикального белого вещества на стороне кровоизлияния, расширение межполушарной щели и/или Сильвиевой борозды базальных субарахноидальных пространств. В дальнейшем отмечается прогрессирующее расширение конвекситальных субарахноидальных пространств.
КТ — повышение плотности субарахноидальных пространств, с последующим их расширением.
МРТ — мало информативна в остром периоде.
ДЭГ — мало информативна в остром периоде, в дальнейшем признаки церебральной гипоперфузии.
СМЖ — давление высокое, ликвор геморрагический, часто реактивный плеоцитоз, уровень белка повышен, к 3 — 6 суткам выражена реакция макрофагов.
II. Б) Родовая травма спинного мозга
Р 11.5 Кровоизлияние в спинной мозг
(растяжение, разрыв, надрыв с травмой или без травмы позвоночника)
(редко, около 1% и преимущественно у доношенных )
а) Аномалии предлежания плода (ягодичное и ножное), неправильное выполнение акушерских пособий (например, избыточные боковые тракции или ротация туловища при фиксированной головке). Предрасполагающие факторы — гипоксия, коагулопатии, сосудистые мальформации.
б) Три варианта клинического течения:
- Катастрофический — мертворождение или летальный исход в первые часы после рождения на фоне прогрессирующих дыхательных и сердечно-сосудистых расстройств. Наблюдается при краниоспинальном уровне повреждения.
- Тяжелый — сопровождается картиной спинального шока, продолжающегося от нескольких дней до нескольких недель (адинамия, арефлексия, атония), живот вздут, парез кишечника, «парадоксальное» диафрагмальное дыхание, атония анального сфинктера и мускулатуры мочевого пузыря, отсутствие болевой чувствительности ниже уровня поражения. Иногда — синдром Клода Бернара — Горнера. Рефлекторные реакции и чувствительность в области лица и головы сохранены.
Прогрессирование дыхательной недостаточности часто приводит к летальному исходу в периоде новорожденности. Наблюдается при поражении средне — и нижнешейных, верхне-грудных отделов спинного мозга.
- Средне тяжелый — клиника спинального шока более кратковременна, двигательные и рефлекторные нарушения менее выраженные.
в) Метаболические нарушения, характерные для тяжелой дыхательной недостаточности. Снижение системного АД, брадикардия, гипотермия.
НСГ — мало информативна.
КТ, МРТ — позволяют визуализировать область и характер повреждения (МРТ — более предпочтительна).
ЭНМГ — признаки денервации скелетных мышц на уровне поражения.
СМЖ — при кровоизлиянии, надрывах, разрывах — ликвор геморрагический, при ишемии — может быть повышение уровня белка.
II. В) Р 14 Родовая травма периферической нервной системы
Частота встречаемости 0,1%, преимущественно у доношенных
а) Неправильное выполнение акушерских пособий, оказываемых при затрудненном выведении плечиков и головки, запрокидывании рук плода.
Травматические повреждения плечевого сплетения
б) Р 14.0 Проксимальный (верхний) тип Эрба-Дюшенна
Вялый парез проксимального отдела руки: рука приведена к туловищу, разогнута во всех суставах, предплечье пронировано, кисть в положении ладонного сгибания, голова наклонена к больному плечу, движения в плечевом и локтевом суставах ограничены, отсутствует рефлекс с двуглавой мышцы плеча, болевая и тактильная чувствительность снижены.
Приблизительно в 5% случаев сочетается с парезом диафрагмального нерва.
Р 14.1 Дистальный (нижний) тип Дежерина-Клюмпке
Вялый парез дистального отдела руки: рука разогнута во всех суставах, лежит вдоль туловища, пронирована, кисть пассивно свисает. Спонтанные движения в локтевом и лучезапястном суставах отсутствуют, движения в пальцах ограничены. Хватательный и ладонно-ротовой рефлексы на стороне поражения не вызываются. Часто трофические нарушения (отек, цианоз, и др.). Иногда данному повреждению сопутствует синдром Клода Бернара-Горнера на стороне поражения.
Р 14.3 Тотальный тип (пареза плечевого сплетения).
Спонтанные движения во всех отделах руки полностью отсутствуют, диффузная гипотония мышц, арефлексия, нарушение всех видов чувствительности, трофические расстройства. Часто сочетается с синдромом Клода Бернара-Горнера на стороне поражения.
в) Характерных метаболических нарушений нет.
НСГ, КТ, МРТ, ДЭГ — не информативны.
СМЖ — не информативна
ЭНМГ- спонтанная биоэлектрическая активность в режиме покоя отсутствует, при активном мышечном усилии регистрируется интерференционный тип кривой со сниженной амплитудой колебаний в паретичных мышцах.
Р 14.2 Травматические повреждения диафрагмальных нервов
В 80-90% случаев сочетается с травматическими повреждениями плечевого сплетения
(тотальный и проксимальный тип), изолированные парезы крайне редки.
б) Односторонние парезы клинически протекают практически бессимптомно или с минимальными проявлениями дыхательной недостаточности.
Двусторонний парез диафрагмы приводит к выраженным дыхательным нарушениям с первых часов жизни, что требует в отдельных случаях проведения респираторной поддержки.
в) Нарушения метаболизма характерные для дыхательной недостаточности.
УЗИ, рентгеноскопия грудной клетки — высокое стояние и малая подвижность (релаксация) купола диафрагмы на пораженной стороне/сторонах.
Р 11.3 Травматическое повреждение лицевого нерва
а) Аномальное предлежание плода, оперативное родоразрешение — неправильное наложение полостных и выходных акушерских щипцов.
б) На стороне поражения:
- Лагофтальм;
- Сглаженность носогубной складки;
- При крике рот перетягивается в здоровую сторону, поисковый рефлекс ослаблен.
в) НСГ, КТ, МРТ — не информативны.
ЭНМГ — выявляет снижение проводимости по лицевому нерву.
Р 14.8 Травматические повреждения других периферических нервов
(встречаются редко)
а) Аномалии предлежания плода (ягодичное и ножное), неправильное выполнение акушерских пособий. В постнатальном периоде — как правило, ятрогенного генеза или вторичного характера (воспалительные и травматические изменения в костях и суставах конечностей).
б) Повреждение нервов конечностей клинически проявляется нарушением движений и мышечного тонуса в соответствующих зонах иннервации: локтевого, лучевого, седалищного, запирательного и берцовых нервов.
в) При выявлении симптоматики, характерной для повреждения того или иного периферического нерва, необходимо провести комплексное обследование для исключения травматических и гнойно — воспалительных процессов в костях, суставах и мягких тканях.
Продолжение >>
<< Назад
Восстановление витальных функций
Следующий этап предполагает восстановление витальных функций. Таким образом, необходимо восстановление кровяной циркуляции, дыхания и нормальной работы сердца. Дальше терапию направляют на восстановление всех ранее утраченных функций. В этих целях назначают нейрометаболиты наряду с ноотропами, сосудистыми препаратами, нейропротекторами и антиоксидантами.
Симптоматическая терапия направлена на устранение основного проявления последствий аноксии. В случае наличия выраженной головной боли используются анальгетики, а на фоне эпилептических припадков требуются антиконвульсанты и так далее.