Главная → Информация о заболеваниях → Гидроцефалия (гипертензионно-гидроцефальный синдром ГГС)
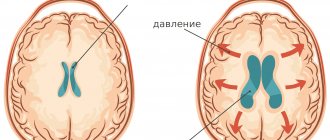
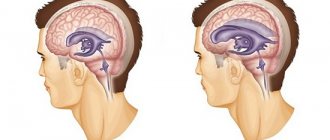
Абсолютно у всех людей в полости черепа есть небольшое количество жидкости, которая омывает головной мозг. Жидкость эта называется «ликвор». Ликвор постоянно вырабатывается и всасывается (обновляется). Если у человека вырабатывается ликвора больше, чем всасывается, то он начинает накапливаться в полости черепа, и внутричерепное давление повышается. Лишняя жидкость начинает давить на головной мозг, вызывая различные нарушения его работы. Это и называется гидроцефалией (повышенное внутричерепное давление, гипертензионно-гидроцефальный синдром или «водянка мозга»).
Что такое Гипертензионно-гидроцефальный синдром (ГГС)?
Гипертензионно-гидроцефальный синдром (ГГС) обусловлен избыточным накоплением спинномозговой жидкости (ликвора) в желудочках мозга и под оболочками мозга, возникающий в результате препятствия оттоку, избыточного образования и нарушения обратного всасывания ликвора. Это один из наиболее частых синдромальных диагнозов в детской неврологии, особенно у детей раннего возраста с перинатальной энцефалопатией (ПЭП). Следует отметметить, что термин «гипертензионно-гидроцефальный синдром» — понятие, используемое исключительно в России. Причинами возникновения ГГС могут быть: неблагоприятное течение беременности и родов, гипоксически-ишемическое повреждение мозга, глубокая недоношенность, внутричерепные кровоизлияния и внутриутробные инфекции, врожденные пороки развития головного мозга, нейроинфекции. Методы исследования, позволяющие судить об уровне давления ликвора, весьма ограничены. В настоящее время единственно достоверным и относительно доступным из них является проведение поясничной пункции спинномозговой жидкости (СМЖ) с целью измерения давления СМЖ, являющегося диагностическим критерием для данной патологии. ГГС может являться как одним из проявлений гидроцефалии, так и множества других неврологических заболеваний. В диагностические критерии ГГС заложены клинические симптомы, косвенно свидетельствующие о повышении ликворного давления и о расширении желудочков мозга.
Какова распространенность гидроцефалии? По данным официальной статистики до 70% вновь рожденных детей страдают явной (гидроцефалия) или скрытой формой (гипертензионно-гидроцефальный синдром) данного заболевания.
В чем причина массовости заболевания гидроцефалией?
- Ослабленность нервной системы детей родившихся от родителей, выросших в экологически не благополучных условиях.
- Большое количество «спасенных» недоношенных детей.
- Частое применение оперативного родоразрешения, которое так же способствует развитию гидроцефалии.
- Напряженный график прививок до 1 года способствует обострению скрытого гипертензионно-гидроцефального синдрома.
Ранняя диагностика (УЗИ, Электропунктурная), так же способствуют выявлению скрытых форм заболевания гидроцефалией головного мозга. Причин можно найти еще много. Но факт остается фактом: необходимо выявлять и лечить гидроцефалию, не дожидаясь обострений болезни и осложнений.
Каковы проявления гидроцефалии? У детей до 1 года: повышенная возбудимость, «беспричинный» плач, нарушение сна, частые срыгивания, запрокидывание головы назад во сне, повышение мышечного тонуса (ручки держат в кулачках, опора ножками на носочки и с перекрестом), слабая опора ногами, отсутствие шагового рефлекса, задержка моторного и психического развития. У дошкольников: гиперподвижность, агрессивность, истерические проявления, заикание, энурез, косоглазие, частые простудные заболевания, задержка психоречевого развития (бедный словарный запас, нарушение дикции, затруднено построение сложных предложений). У школьников: носовые кровотечения и головные боли, снижена память и концентрация внимания, отмечается расторможенность и невротизация, затруднено усвоение школьного материала: медленно выполняют задания, допускают большое количество ошибок, быстро устают руки, подчерк не ровный, читают медленно и плохо усваивают прочитанный материал, затрудняются в составлении грамотного рассказа.
Самые страшные осложнения гидроцефалии? СУДОРОГИ, ДЕТСКИЙ ЦЕРЕБРАЛЬНЫЙ ПАРАЛИЧ, ДЕБИЛЬНОСТЬ.
Какие факторы вызывают обострение гидроцефалии? Любые нагрузки на организм (вирусные инфекции, стресс, психическое и физическое переутомление, сотрясение головного мозга, прививки) могут приводить к обострению повышенного внутричерепного давления — особенно их сочетания. Например: учеба в гимназии + грипп + стресс, может привести к обострению гидроцефалии, появлению головных болей и снижению успеваемости и агрессивности.
Что делать если у вашего ребенка есть какие-либо проявления гидроцефалии? Своевременно обратиться за консультацией в детское отделение неврологии и рефлексотерапии «Реацентра», чтобы уточнить нужно ли обследовать и лечить ребенка.
Медицинские интернет-конференции
Первичная легочная гипертензия (ПЛГ) – болезнь Айэрсы – является редким тяжелым прогрессирующим заболеванием неизвестной этиологии и характеризуется неблагоприятным прогнозом [1, 2]. Легочная артериальная гипертензия (ЛАГ) диагностируется при повышении среднего давления в легочной артерии до и более 25 мм рт. ст. в покое и 30 мм рт. ст. при нагрузке [3].
По данным литературы встречаемость идиопатической легочной гипертензии составляет 1 – 1,7 случаев на миллион человек населения [2], причем заболевание встречается чаще у женщин, чем у мужчин почти в 2 раза. Возраст пациентов с таким диагнозом в среднем составляет 36,4 года [1]. Не утешительны данные статистики выживаемости пациентов с ПЛГ – при отсутствии интенсивного лечения средняя продолжительность жизни составляет около 3 лет с момента постановки диагноза [2].
Несмотря на активное изучение проблемы, этиология ПЛГ остается невыясненной, однако исследователи предполагают важную роль генетических нарушений в развитии заболевания [4]. В частности, развитие ПЛГ ассоциируют с мутацией гена BMPR2, локализованном во второй хромосоме, однако патогенетическая связь между данным нарушением и ПЛГ не открыта [11].
Несмотря на то, что факторы, приводящие к запуску патологических изменений в легочных сосудах, точно не установлены, на сегодняшний день исследователи основной в вопросах этиологии и патогенеза данного заболевания считают теорию эндотелиальной дисфункции (ЭД), которая свидетельствует, что повреждение и дисфункция эндотелия легочных сосудов приводит к развитию вазоконстрикции и ремоделированию сосудистого русла. В патогенезе выделяют четыре основных патофизиологических феномена: вазоконстрикция, редукция легочного сосудистого русла, снижение эластичности легочных сосудов, их облитерация вследствие тромбоза и пролиферация гладкомышечных клеток (ГМК). Эти процессы индуцируются возникающим при ЭД дисбалансе выработки вазоактивных медиаторов, который заключается в усиленном синтезе эндотелиоцитами вазоконстрикторных веществ (тромбоксан А2, эндотелин-1) и дефиците выработки вазодилатирующих (NO, простациклин). Играет роль также нарушение работы потенциал-зависимых калиевых каналов ГМК, которое вызывает вазоконстрикцию и пролиферацию ГМК вследствие повышенного внутриклеточного содержания ионов кальция. Ключевое значение в развитии и прогрессировании ЛАГ отводится дефициту NO, который способствует хроническому вазоспазму, клеточной пролиферации, внутрисосудистому тромбообразованию [5].
Таким образом, замыкается порочный круг – прогрессирующее повреждение эндотелия приводит к ремоделированию сосудов [11].
Патологические процессы при ЛАГ затрагивают все слои сосудистой стенки, различные типы клеток (эндотелиальные, ГМК, фибробласты). Структурные нарушения начинаются с артерий мышечного типа и артериол легких. Процесс начинается с гипертрофии и мускуляризации средней оболочки артериол. Кроме того, наблюдается миграция ГМК в интиму сосуда, в которой происходит активная пролиферация клеточных элементов. Сначала утолщение интимы обратимо, однако вскоре развиваются необратимые изменения – фиброз и фиброэластоз. В ряде случаев концентрический фиброз интимы полностью закрывает просвет сосуда. При этом могут определяться плексогенные и плексиморфные структуры, которые, как правило, возникают проксимальнее места обтурации. В адвентиции наблюдается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Секреция медиаторов выраженного сосудосуживающего действия трансформирует состояние сосудистого русла из обычного антикоагулянтного в прокоагулянтное и способствует развитию тромбоза [10, 11].
Современные функциональные исследования с помощью различных неинвазивных методик оценки состояния периферического кровотока не подтверждают генерализацию эндотелиальной дисфункции у пациентов с ПЛГ, однако отмечается повышенная констрикторная способность ГМК [6].
Рост сосудистого сопротивления в малом круге кровообращения (МКК) инициирует возникновение синдрома гипердинамии миокарда с развитием гипертрофии правого желудочка (ПЖ). Данное явление обусловлено физиологической реакцией, описанной Старлингом, которая заключается в увеличении силы сердечного сокращения в ответ на нагрузку объемом или сосудистым выходным сопротивлением [7]. Легочное сердце (ЛС) развивается при первичной или вторичной ЛАГ, возникшей в результате нарушения функции эндотелиоцитов сосудов легких, структурных и функциональных изменений легочных сосудов [8]. В развитии легочного сердца выделяют несколько стадий. В начальную стадию происходит увеличение резистентности легочных сосудов, является следствием ЛАГ. Во вторую стадию выявляются изменения в ПЖ в ответ на повышение легочного артериального давления. Третья стадия заключается в выраженной гипертрофии и дилатации ПЖ, происходят изменения в васкуляризации последнего, может наблюдаться правожелудочковая сердечная недостаточность (ПЖСН) [9].
При формировании ЛС наблюдаются изменения миокарда в виде гипертрофии, дистрофии, атрофии и некроза кардиомиоцитов ПЖ. В мышечных волокнах ПЖ могут наблюдаться атрофически-склеротические процессы, в правом предсердии и ПЖ – выраженный фиброэластоз эндокарда. Реже отмечается расширение полости левого желудочка [12].
Диагностика ПЛГ затруднена, поскольку жалобы пациентов носят неспецифический характер и могут напоминать врожденный порок сердца. В большинстве случаев клинические проявления формируются после развития необратимых изменений в легких. Отмечают слабость, усталость, одышку, кровохарканье, ангинозную боль в области сердца, головокружение, абдоминальный дискомфорт. При осмотре обнаруживаются пульсация шейных вен, гепатомегалия, периферические отеки, асцит. Пальпаторно определяется пульсация в четвертом межреберье слева от грудины, увеличение правого желудочка. Аускультируется усиление второго тона во втором межреберье справа [13].
Консервативное лечение ПЛГ предусматривает, в первую очередь, назначение антагонистов кальция, проведение антикоагулянтной терапии, применение диуретиков при ПЖСН. Силденафила цитрат (действующее вещество «Виагры») имеет одинаковые вазодилатирующие способности как в сосудах гениталий, так и легких, в связи с чем был одобрен в США в качестве препарата для лечения ПЛГ [4]. Возможно и хирургическое лечение – трансплантация органокомплекса «сердце-легкие» [11]. Однако полное устранение ПЛГ на данный момент не представляется возможным, лечение носит поддерживающий характер.
В отдельную категорию относят персистирующую легочную гипертензию новорождённых (ПЛГН) в связи с наличием характерных патогенетических и клинико-морфологических аспектов, связанных с особенностями кровообращения плода и отличающими её от ПЛГ. ПЛГН – заболевание, характеризующееся аномально повышенным давлением в легочных сосудах и, как следствие, право-левым шунтированием крови через овальное отверстие и (или) открытый артериальный проток при отсутствии других пороков сердца. Среди вариантов ПЛГН, в свою очередь, выделяют идиопатическую (первичную) и осложняющую различные неонатальные сердечно-легочные осложнения (вторичную) [14]. ПЛГН встречается в 0,2-0,3 случаях на 1000 новорождённых, однако идиопатический вариант составляет до 20% от всех случаев ПЛГН [15].
Ведущей этиологией идиопатической ПЛГН является длительная внутриутробная гипоксия, которая приводит к ремоделированию сосудистого русла, которое выражается в гиперплазии гладких мышц сосудов, распространяющейся на внутридольковые артерии, что приводит к повышению сосудистого сопротивления [15].
У здоровых новорождённых в ответ на многочисленную стимуляцию, происходящую во время рождения, в том числе на увеличение парциального давления кислорода, изменения pH крови, меняется активность вазоактивных веществ [14]. Основным патогенетическим звеном идиопатической ПЛГН также считается дисбаланс синтеза вазоконстрикторных и вазодилатирующих веществ [15].
Таким образом, первичная легочная гипертензия – редкое и тяжелое, с крайне неблагоприятным прогнозом заболевание. Однако накопившийся клинический опыт предоставляет возможности открывать механизмы его патогенеза и разрабатывать новые методы диагностики и лечения, позволяющие не только продлить жизнь пациентам, но и улучшить ее качество. В этой связи актуальным является описание клинических случаев идиопатической легочной гипертензии.
Клинический случай
Из анамнеза известно, что мальчик Е.Д. родился от пятой беременности (вторые роды), протекающей на фоне угрозы прерывания беременности, отеков беременных, низкой плацентации, частичной прогрессирующей отслойки низкорасположенной плаценты, отягощённого акушерско-гинекологического анамнеза, хронической внутриутробной гипоксии плода. Преждевременные роды при сроке гестации 32-33 недели были разрешены путем операции кесарева сечения в экстренном порядке.
Новорождённый находился в тяжелом состоянии с оценкой по шкале Апгар 4-5-6-6 баллов. Тяжесть состояния была обусловлена дыхательными нарушениями, неврологической симптоматикой на фоне недоношенности и морфофункциональной незрелости. Антропометрические данные ребенка при рождении: масса тела 2530 г, рост 47 см, окружность груди 31 см, окружность головы 33 см.
С рождения находился на ИВЛ. На этапе родильного дома проводилась респираторная, инфузионная, антибактериальная и гемостатическая терапия. С целью дальнейшего обследования, лечения и выхаживания мальчик был переведён бригадой санитарной авиации из роддома в отделение реанимации и интенсивной терапии новорождённых Саратовской Областной Детской Клинической больницы (СОДКБ).
На основании проведенных обследований был поставлен основной конкурирующий клинический диагноз: 1. Врождённая пневмония. 2. Церебральная ишемия 3 степени, острый период. Синдром угнетения. Осложнения: синдром полиорганной недостаточности (отек головного мозга, кома 3 степени; дыхательная недостаточность 3 степени; острая сердечно- сосудистая недостаточность 3 степени; острая почечная недостаточность в стадии олигоанурии; отечный синдром; геморрагический синдром; легочная гипертензия). Сопутствующие заболевания: дефект перимембранозный подтрикуспидальный межжелудочковой перегородки 0,24 см; открытый артериальный проток: 0,30см; открытое функционирующее овальное окно: 0,42см, лево-правый сброс. Фоновый диагноз: респираторный дистресс-синдром новорождённых; недоношенность 32-33 недели.
В условиях проводимой терапии (инотропная поддержка, сурфактанты, увеличение параметров вентиляции до максимально возможных) состояние ребенка оставалось тяжелым с динамикой ухудшения. На фоне прогрессирующей полиорганной недостаточности была отмечена асистолия, констатирована биологическая смерть ребенка.
При вскрытии грудной полости отмечено обычное расположение органов, однако легкие полностью выполняют плевральную полость. Форма сердца конусовидная, расположение обычное. Величина и расположение вилочковой железы без особенностей. В мягких тканях имеются кровоизлияния ярко-красного цвета размерами до 1 см.
При исследовании дыхательных путей отмечены обычных размеров отечные розовые небные миндалины. В просвете гортани, трахеи и бронхов определяется небольшое количество слизистого содержимого. Слизистая оболочка указанных органов отечная, гладкая по всей длине. Листки париетальной и висцеральной плевры гладкие, бледно-розового оттенка. Легкие темно-красного цвета, плотной консистенции, легочная ткань на разрезе однородная, обильно пропитана кровью, при надавливании выделятся жидкая кровь и отечная жидкость. Масса левого легкого 40 грамм, правого легкого 37 грамм. Кусочки, вырезанные из легких, при погружении в воду тонут. На гистологическом исследовании легких в просветах альвеол обнаружены очаговые скопления эритроцитов, формирующиеся гиалиновые мембраны; в сосудах отмечена гипертрофия мышечного слоя артерий и вен более чем на 25%, выявлены пролиферация интимы с фиброзом, а также тромботические массы.
При исследовании органов кровообращения обнаружено небольшое количество желтоватой прозрачной жидкости в сердечной сорочке. Листки перикарда гладкие, блестящие. Сердце массой 20 г. Миокард розово-красный, упругой консистенции. Клапанный и пристеночный эндокард на всем протяжении тонкий, полупрозрачный, блестящий, с сероватым оттенком. Толщина миокарда левого желудочка 0,7 см, правого 0,3 см (норма 0,2 см). Периметр легочного ствола над клапанами 2,2 см, аорты – 1,9 см. Интима аорты гладкая, блестящая, красновато-желтого цвета. В полостях сердца и в крупных сосудах темная жидкая кровь. Клапаны сердца развиты правильно, не изменены. Межжелудочковое сообщение размером 0,2 см; овальное окно размером около 0,3 см открыто; открытый артериальный проток размером 0,3 см. На гистологическом исследовании обнаружены дистрофия и гипертрофия кардиомиоцитов.
При вскрытии полости черепа обнаружено, что твердая мозговая оболочка тонкая, с перламутровым блеском. Мягкие мозговые оболочки отечные, полнокровные. Извилины головного мозга уплощены, борозды сглажены. Боковые желудочки немного увеличены в размерах, содержат прозрачный ярко-желтый ликвор. В полости правого желудочка имеется небольшой сверток крови ярко-красного цвета объемом около 5 мл. Сосудистые сплетения полнокровные, с прозрачным содержимым. Белое и серое вещество больших полушарий различимо, на поверхности разрезов определяются темно-красные точки, легко смываемые водой. Остальные структуры головного мозга без видимых изменений. Масса головного мозга 265 грамм. На гистологическом исследовании выявлено неравномерное кровенаполнение сосудов головного мозга.
При вскрытии брюшной полости выделилось около 5 мл желтой жидкости. Петли тонкого кишечника в нижних отделах темно-красного цвета, немного увеличены в размерах; сосуды кишечника полнокровны. Слизистая тонкого кишечника со сглаженным рисунком, темно-красного цвета. В просвете нижних отделов тонкого кишечника геморрагическое содержимое. Печень массой 105 грамм красного цвета, на поверхности и на разрезе имеет обычную структуру. На гистологическом исследовании печени обнаружена дистрофия гепатоцитов, полнокровие печеночных синусов.
При вскрытии почек отмечено, что на разрезе корковое вещество синюшно-красного цвета, а мозговое – темно-красное; паренхима плотной консистенции; слизистая лоханок гладкая, чистая с единичными мелкими кровоизлияниями. Слизистая оболочка мочеточников и мочевого пузыря без особенностей. На гистологическом исследовании почек обнаружена дистрофия эпителия извитых почечных канальцев, а также неравномерное кровенаполнение сосудов.
При вскрытии остальных органов и систем значимых особенностей выявлено не было.
На основе проведенного вскрытия и гистологического исследования был поставлен патологоанатомический диагноз – первичная легочная гипертензия; осложнения основного заболевания – гипертрофия миокарда правого желудочка сердца; вторичные гиалиновые мембраны; кровоизлияния в легких; паренхиматозная дистрофия внутренних органов.
Обсуждение
В данном случае ПЛГ у новорожденного сочеталась с открытым овальным окном и открытым артериальным протоком, а также перимембранозным дефектом межжелудочковой перегородки, что привело к существенным изменениям гемодинамики в неонатальном периоде. Следствием длительной гипоксии стало ишемическое повреждение различных органов, развитие паренхиматозной дистрофии и полиорганной недостаточности, что и обуславливало тяжесть состояния пациента. Непосредственной причиной смерти больного стала дыхательная недостаточность.
Заключение
Таким образом, ПЛГ – тяжелое прогрессирующее заболевание, плохо поддающееся лечению, – у новорожденных осложняется особенностями гемодинамики и неминуемо приводит к летальному исходу. Изучение этиологии и патогенетических механизмов идиопатической легочной гипертензии позволит найти новые пути помощи больным, страдающим от данной болезни.
Методы лечения гидроцефалии
Хирургический метод лечения гидроцефалии — применяется только в крайних случаях (декомпенсированные формы внутренней гидроцефалии), из полости черепа лишняя жидкость отводится в брюшную полость с помощью трубки (шунта), данная операция, как и любая другая достаточно травматична, в дальнейшем могут потребоваться еще несколько оперативных вмешательств по замене и проверке работы шунта.
Медикаментозный метод лечения гидроцефалии — применение мочегонных препаратов, например диакарба, часто используется неврологами в поликлинической практике. Диакарб выводит жидкость не только из полости черепа, но и в целом из организма, одновременно происходит потеря микроэлементов, эффект от данного метода лечения временный, после его прекращения, жидкость вновь начинает накапливаться и внутричерепное давление повышается.
Фитотерапия – применение мочегонных трав (хвощ, фенхель, брусничный лист), не вызывает привыкания и потери микроэлементов. Используется, как правило, в профилактических целях: для избежания обострения гидроцефалии во время простудных заболеваний, при смене климатических поясов, в осеннее-весенний период при выраженных перепадах метеоусловий.
Массаж — метод эффективен у детей с отклонениями в двигательной сфере (повышенный мышечный тонус, задержки моторного развития), направлен в основном на расслабление напряженных мышц. Целесообразно применять только в комплексном лечении, так как массаж не влияет на основную причину заболевания — гидроцефалию и гипоксию коры головного мозга.
МИКРОТОКОВАЯ РЕФЛЕКСОТЕРАПИЯ — метод эффективен у детей с различными проявлениями гидроцефалии, позволяет устранять не только внешние проявления (истерики, задержки развития и т.д.), но и лечить саму гидроцефалию, то есть оказывает комплексное лечебное воздействие на организм. Эффект от лечения стабильный, он не прекращается после окончания лечения.