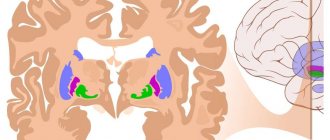
МРТ сосудов головного мозга — диагностическая процедура, позволяющая оценить состояние сосудов головы. При проведении МРТ отсутствуют вредные факторы, такие как облучение. Процедура предназначена для выявления различных заболеваний, речь о которых пойдет далее. Также вы узнаете, что показывает МРТ сосудов головного мозга и когда она назначается.
Точность МРТ обусловлена тем, что томограф работает с сигналами от ядер водорода (протонов). Пока человек находится в магнитном поле устройства, протоны его тела испускают электромагнитные волны. С их помощью аппарат строит изображение внутренних органов на экране компьютера.
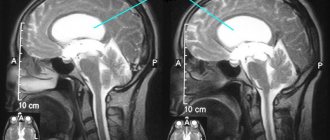
Кроме стандартной МРТ, которая применяется при подозрении на опухоль, рассеянный склероз и другие патологии мозга, применяется разновидность метода, предназначенная для обследования сосудов мозга. Магнитно-резонансная ангиография (МРА) показывает артерии, магнитно-резонансная венография (МРВ) показывает вены. Со стороны кажется, что в этих исследованиях нет разницы. На самом деле это отдельные процедуры в различных режимах работы томографа.
Изображение сосудов головы при проведении МРТ
Заболевания сосудов головного мозга
Головная боль часто не принимается во внимание. Пациенты полагают, что на такую боль, если она не слишком интенсивна, можно не обращать внимания. Люди годами живут с «обычной» головной болью, а в это время в их мозге происходят патологические процессы. МРТ позволяет отличить мигрень от, например, аневризмы, а психосоматическую головную боль от опухолей и нарушения кровоснабжения мозга.
Какие же заболевания выявляются с помощью МРТ сосудов головного мозга?
Чаще всего сосуды головного мозга страдают из-за трех патологий: атеросклероз, повышенное артериальное давление, сахарный диабет 2 типа, которые могут приводить к развитию серьезных осложнений.
Инсульт
Инсульт — это острое нарушение кровообращения в головном мозге, очень опасное состояние, способное привести к тяжелым последствиям для здоровья. Для диагностики инсультов часто применяется МРТ как высокотехнологичный способ, позволяющий получить точные изображения патологии.
Инсульт подразделяется на несколько типов в зависимости от причины возникновения:
- Ишемический. Возникает тогда, когда участок мозга перестает получать кровь из-за закупорки сосуда тромбом или холестериновой бляшкой. Вещество мозга отмирает, не получая кислород с током крови. Возникновению заболевания могут способствовать сердечная недостаточность, сахарный диабет и атеросклероз.
- Геморрагический. Возникает вследствие кровоизлияния в мозговую ткань из поврежденного сосуда. Фактором риска развития этого типа инсульта является гипертония.
Своевременная диагностика инсульта очень важна. Вовремя принятые меры по выявлению и оценке последствий инсульта помогают начать скорейшую реабилитацию и восстановить поврежденные функции.
В случае возникновения инсульта МРТ дает четкую и развернутую картину течения заболевания, локализации и объема поражения мозга.
Атеросклероз
Данное заболевание в той или иной мере развивается практически у каждого взрослого человека, однако степень тяжести болезни и скорость ее развития строго индивидуальны. При заболевании в стенке артерий откладываются холестерин и жиры, образуется бляшка. Возможны следующие варианты развития болезни:
- бляшка сужает просвет сосуда, мозгу не хватает крови;
- образуется расширение стенок артерии (аневризма);
- стенка сосуда разрывается с последующим кровотечением;
- на месте бляшки образуется тромб, еще сильнее мешая движению крови;
- содержимое бляшки и/или тромб отрывается и закупоривает сосуд.
Возникновению и быстрому прогрессированию атеросклероза способствуют следующие заболевания:
- Повышенное артериальное давление (артериальная гипертензия, гипертоническая болезнь) повреждает стенку сосуда, которая становится менее эластичной и не может справиться с нагрузкой. В ней легче откладываются жиры и развивается атеросклероз. Из-за высокого давления разрываются тонкие или сильно поврежденные сосуды, например, сосуды с аневризмой.
- Сахарный диабет 2 типа. Избыток глюкозы тоже повреждает стенку сосуда. У людей, больных сахарным диабетом 2 типа, быстрее развиваются атеросклероз и гипертоническая болезнь. Часто у одного человека сочетаются атеросклероз, гипертоническая болезнь и сахарный диабет 2 типа. Они усиливают друг друга и повышают риск инсульта.
- Заболевания сердца (нарушения сердечного ритма, инфаркт миокарда, пороки сердца).
Состояния, которые встречаются реже: аутоиммунные заболевания (васкулиты, системная красная волчанка, сахарный диабет 1 типа и т. д.), инфекционные болезни, сепсис, черепно-мозговые травмы.
Церебральная болезнь мелких сосудов
Новый метод диагностики иногда открывает целый мир болезней, о которых раньше не так много знали. Технология МРТ помогает изучать группу заболеваний мелких сосудов головного мозга, диаметр которых менее 2 мм.
Болезнь мелких сосудов головного мозга опасна снижением когнитивных способностей и/или инсультом. Примерно четверть ишемических инсультов происходят из-за повреждения капилляров. Причин поражения мелких сосудов много и они еще изучаются.
У некоторых людей пожилого возраста может развиваться церебральная амилоидная ангиопатия. Ею страдают примерно 20% людей 61-70 лет; чем старше возраст, тем чаще ее выявляют. В сосудах мозга откладывается особый белок амилоид, постепенно кровоснабжение мозга нарушается и нейроны погибают.
Аневризма
Аневризма — патологическое расширение артерии, которое встречаются в среднем у 2-3 человек из 100. Заболевание чаще возникает у женщин, а также в возрастной группе старше 30 лет. Аневризмы могут быть врожденными, но со временем стенку сосуда также деформируют атеросклероз, давление крови, травма, инфекционный процесс, что усугубляет течение заболевания.
Пораженный аневризмой сосуд может лопнуть. Чаще всего разрыв происходит в возрасте 20-40 лет. До этого человек может страдать от головных болей, похожих на приступ мигрени. МРТ незаменима для ранней диагностики заболевания. Современные томографы с большой точностью способны визуализировать даже малейшие патологические очаги в головном мозге.
К факторам риска образования аневризм относят курение, повышенное артериальное давление, применение гормональной заместительной терапии в период постменопаузы, а также если в семье есть люди с аневризмами и другими заболеваниями сердечно-сосудистой системы.
Ангиома (сосудистая мальформация)
Доброкачественная опухоль, состоящая из разросшихся и переплетенных вен и артерий головного мозга. Образование не представляет угрозы для жизни, но по мере разрастания может сдавливать структуры мозга, в результате чего возникают головные боли и нарушается нормальное функционирование участков мозга, рядом с которым расположена патология.
По размеру мальформации подразделяют на:
- Капиллярные. Состоят из мельчайших сосудов и, как правило, не вызывают симптомов.
- Венозные. Включают в себя более крупные вены и артерии. Могут вызывать специфические симптомы.
- Каверозные. Сосуды переплетаются так тесно, что образуют целые полости, в которых накапливается кровь. Такое новообразование может разрастаться достаточно сильно и сдавливать мозговые ткани.
Причины возникновения ангиом так до конца и не изучены. Часто заболевание является врожденным или возникает в раннем детском возрасте. Небольшой процент ангиом возникает после перенесенных инфекционных заболеваний.
МРТ сосудов головного мозга с точностью покажет не только локализацию, размер и форму новообразования, но и степень сдавления окружающих тканей. Благодаря магнитно-резонансной томографии лечащему врачу удастся разработать эффективный план последующей терапии.
Изменения дисциркуляторного характера
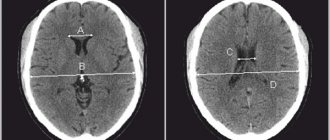
Очаговые изменения белого вещества мозга вследствие нарушения сосудистой трофики — наиболее частое явление при анализе МР-томограмм у возрастных пациентов. Причиной их считают хроническую гипоксию и дистрофию на фоне поражения мелких артерий и артериол.
снижение кровотока – одна из основных причин возрастных изменений в мозге
МР-признаки поражения сосудистого генеза:
- Множественные очаговые изменения белого вещества, преимущественно в глубоких структурах мозга, не вовлекающие желудочки и серое вещество;
- Лакунарные или пограничные участки некроза;
- Диффузные очаги поражения глубоких отделов.
очаги лакунарных микроинсультов в мозге
Описанная картина может напоминать таковую при возрастной атрофии, поэтому связывать ее с дисциркуляторной энцефалопатией можно только при наличии соответствующей симптоматики. Лакунарные инфаркты обычно возникают на фоне атеросклеротического поражения сосудов мозга. Как атеросклероз, так и гипертония дают сходные изменения на МРТ при хроническом течении, могут сочетаться и характерны для людей после 50-летия.
Заболевания, сопровождающиеся демиелинизацией и диффузным дистрофическим процессом, нередко требуют тщательной дифференциальной диагностики с учетом симптоматики и анамнеза. Так, саркоидоз может симулировать самую разную патологию, включая рассеянный склероз, и требует проведения МРТ с контрастированием, которая показывает характерные очаговые изменения в базальных ядрах и оболочках мозга.
При лайм-боррелиозе важнейшими фактами считаются укус клеща незадолго до появления неврологической симптоматики и кожная сыпь. Очаговые изменения в мозге похожи на таковые при рассеянном склерозе, имеют размеры не более 3 мм и сочетаются с изменениями в спинном мозге.
Как делают МРТ сосудов головного мозга
После того как пациент заходит в кабинет врача-радиолога, доктор задает несколько вопросов о беспокоящих симптомах и противопоказаниях к процедуре. Пациента просят снять с себя все металлические предметы, лечь на ложе томографа. Нормальная работа томографа сопровождается шумом, стуком и другими громкими звуками, этого не надо пугаться. В нашем медицинском центре каждому пациенту выдаются наушники, в которых во время исследования звучит приятная, спокойная музыка.
Подготовка к проведению МРТ головы и сосудов
Пациенту в руку дают специальную кнопку, нажав на которую во время процедуры, можно сообщить врачу о внезапном ухудшении самочувствия.
МРТ сосудов головного мозга — показания и противопоказания
Магнитно-резонансная томография сосудов головного мозга применяется при наличии широкого спектра симптомов, которые могут свидетельствовать о сосудистой патологии и нарушении кровообращения.
- головные боли разной продолжительности и силы;
- головокружения;
- шум в ушах;
- приступы, похожие на эпилептические;
- шаткая походка, потеря координации;
- изменения ощущения температуры, прикосновений;
- ухудшение внимания, памяти;
- трудности с пониманием речи, произношением слов;
- черепно-мозговые травмы.
При возникновении одного или нескольких из вышеописанных симптомов стоит обратиться к врачу и пройти МР-сканирование, чтобы убедиться в отсутствии патологий сосудов головного мозга.
Несмотря на свою безопасность, у МРТ все же имеется ряд противопоказаний, при наличии которых проведение процедуры невозможно.
- Томограф не рассчитан на массу тела более 130 кг или обхват груди (бедер, живота) более 150 см.
- Магнитное поле томографа может нарушить работу кардиостимулятора, нейростимулятора, кохлеарного имплантата — наличие этих устройств служит абсолютным противопоказанием к исследованию.
- Магнитный металл (осколки, дробь, металлическая стружка) внутри тела может сдвигаться под действием магнитного поля и повреждать окружающие ткани.
- МРТ не делают в 1 триместре беременности и детям до 5 лет.
Протезы из неферромагнетиков позволяют делать МРТ, если соблюдены следующие условия:
- есть документы на протез;
- прошло более 3 месяцев после установки;
- протез установлен не в области сканирования.
Существуют МРТ совместимые кардиостимуляторы и другие электронные имплантаты. При наличии любых устройств медицинского назначения в теле пациента необходимо изучить паспорт изделия на предмет возможности проведения магнитно-резонансной томографии.
Проявления очаговых изменений вещества мозга
Головной мозг снабжается кровью из двух сосудистых бассейнов — сонных и позвоночных артерий, которые уже в полости черепа имеют анастомозы и образуют Виллизиев круг. Возможность перетока крови из одной половины мозга в другую считается важнейшим физиологическим механизмом, позволяющим компенсировать сосудистые расстройства, поэтому клиника диффузных мелкоочаговых изменений появляется далеко не сразу и не у всех.
Вместе с тем, мозг очень чувствителен к гипоксии, поэтому длительная гипертония с поражением артериальной сети, атеросклероз, затрудняющий кровоток, воспалительные изменения сосудов и даже остеохондроз могут привести к необратимым последствиям и гибели клеток.
Поскольку очаговые изменения мозговой ткани возникают в связи с самыми разными причинами, то и симптоматика может быть различной. Дисциркуляторные и старческие изменения имеют сходные черты, но стоит помнить, что очаги у относительно здоровых людей вряд ли будут иметь какие-либо проявления.
Часто изменения в ткани мозга вообще никак не проявляются, а у пожилых пациентов и вовсе расцениваются как возрастная норма, поэтому при любом заключении МРТ трактовать его результат должен опытный врач-невролог в соответствии с симптоматикой и возрастом пациента.
Если в заключении указаны очаговые изменения, но при этом нет никаких признаков неблагополучия, то и лечить их не нужно, однако показаться врачу и периодически контролировать МР-картину в мозге все же придется.
Нередко пациенты с очаговыми изменениями жалуются на упорные головные боли, которые тоже совершенно необязательно связаны с выявленными изменениями. Всегда следует исключать другие причины, прежде чем начинать «бороться» с МР-картиной.
В случаях, когда у пациента уже диагностирована артериальная гипертензия, атеросклероз сосудов мозга или шеи, диабет или их сочетания, весьма вероятно, что МРТ покажет соответствующие очаговые изменения. Симптоматика при этом может складываться из:
- Расстройств эмоциональной сферы — раздражительность, переменчивость настроения, склонность к апатии и депрессии;
- Бессонницы ночью, сонливости днем, нарушения суточных ритмов;
- Снижения умственной работоспособности, памяти, внимания, интеллекта;
- Частых головных болей, головокружения;
- Расстройств двигательной сферы (парезы, параличи) и чувствительности.
Начальные признаки дисциркуляторных и гипоксических изменений не всегда вызывают беспокойство у пациентов. Слабость, чувство усталости, плохое настроение и головную боль нередко связывают со стрессами, переутомлением на работе и даже плохой погодой.
По мере прогрессирования диффузных изменений мозга отчетливее становятся поведенческие неадекватные реакции, изменяется психика, страдает общение с близкими. В тяжелых случаях сосудистой деменции становится невозможным самообслуживание и самостоятельное существование, нарушается работа тазовых органов, возможны парезы отдельных групп мышц.
Когнитивные нарушения практически всегда сопутствуют возрастным дегенеративным процессам с дистрофией мозга. Тяжелая деменция сосудистого генеза с множественными глубокими очагами разрежения нервной ткани и атрофией коры сопровождается нарушением памяти, снижением мыслительной активности, дезориентацией во времени и пространстве, невозможностью решения не только интеллектуальных, но и простых бытовых задач. Пациент перестает узнавать близких, теряет способность воспроизводить членораздельную и осмысленную речь, впадает в депрессию, но может быть агрессивным.
На фоне когнитивных и эмоциональных расстройств прогрессирует патология двигательной сферы: походка становится неустойчивой, появляется дрожание конечностей, нарушается глотание, усиливаются парезы вплоть до паралича.
Очаговые изменения постишемического характера обычно связаны с инсультами, перенесенными в прошлом, поэтому среди симптомов — парезы и параличи, расстройства зрения, речи, мелкой моторики, интеллекта.
В некоторых источниках очаговые изменения делят на постишемические, дисциркуляторные и дистрофические. Нужно понимать, что это деление весьма условно и далеко не всегда отражает симптоматику и прогноз для больного. Во многих случаях дистрофические возрастные изменения сопутствуют дисциркуляторным из-за гипертонии или атеросклероза, а постишемические очаги вполне могут возникнуть при уже имеющихся рассеянных сосудистого генеза. Появление новых участков разрушения нейронов будет усугублять проявления уже имеющейся патологии.
Контрастное МРТ сосудов головного мозга
Магнитно-резонансная ангиография (МРА) создает изображения на основе сигналов от атомов водорода, которых очень много в крови и других жидкостях. Изображение на экране монитора получается очень четким, поэтому контрастное вещество требуется редко. При проведении компьютерной томографии, в отличие от МРТ, контрастирование применяется значительно чаще.
В МР-диагностике используют вещества на основе гадолиния. Контрастное вещество вводится в вену, на короткое время меняя магнитные свойства тканей, и выводится через почки. Удалось создать соединения гадолиния, которые редко вызывают нежелательные и аллергические реакции. Нет доказательств, что после контакта с организмом человека они вызывают неврологические проблемы. Однако их с осторожностью применяют при тяжелых заболеваниях почек.
Перед исследованием с контрастом обязательно нужно сообщить врачу о:
- беременности (подтвержденной или вероятной);
- грудном вскармливании;
- болезнях почек;
- случавшихся ранее аллергических реакциях на любые лекарственные препараты.
Контрастирование облегчает расшифровку снимков, так как подробнее показывает состояние сосудов.
Контрастный препарат на основе гадолиния
Клиника, диагностика и лечение синдрома хронической усталости
Н.В. ПИЗОВА
, д.м.н., профессор,
кафедра неврологии и медицинской генетики с курсом нейрохирургии Ярославского государственного медицинского университета
В статье обсуждаются причины, клинические проявления и современные подходы к диагностике и лечению пациентов, страдающих синдромом хронической усталости (СХУ). Приводятся данные исследований, подтверждающих положительное влияние мультивитаминных комплексов на когнитивные и другие неврологические функции у пациентов с СХУ.
Синдром хронической усталости (СХУ) — это распространенное заболевание, главным признаком которого является немотивированная выраженная общая слабость, на длительное время выводящая человека из активной повседневной жизни, и связанное со значительными социально-экономическими проблемами [1, 2]. Распространенность СХУ колеблется от 0,007 до 2,8% среди взрослого населения [3—5] и зависит от различных дефиниций [6], от целевой группы населения и используемых методов исследования [7]. При СХУ поражаются преимущественно молодые, наиболее трудоспособные люди тех профессий, где требуется повышенный интеллект, высокий уровень эмоциональной нагрузки, а нередко — быстрота реагирования и сообразительность (врачи, учителя, преподаватели, журналисты, менеджеры и т. д.). Большинство людей с диагнозом СХУ — это люди возрасте 25—45 лет, и большинство исследований показывают, что страдают преимущественно женщины [3, 5]. Частота СХУ у женщин составляет 522 случая на 100 000 и 291 — у мужчин [5]. СХУ возникает также у детей и подростков, но более редко [8]. Впервые такие разнообразные симптомы, как хроническая (рецидивирующая, но всегда изнуряющая) усталость, мышечноскелетные боли, нарушение сна, ухудшение кратковременной памяти и концентрации, головная боль, были объединены в единый синдром под названием «неврастения» в 1860 г. George Beard. Как самостоятельное заболевание СХУ впервые был выделен в 1988 г. Центром по контролю заболеваний (The Centers for Disease Control — CDC, Атланта, США). В последние годы он определен в качестве отдельной нозологической единицы (код МКБ10 D86.9).
Причины СХУ до настоящего времени остаются неизвестными. Одной из них остается инфекционная, или вирусная, теория. Вирус Эпштейна — Барр, цитомегаловирус, вирусы простого герпеса I, II, VI типов, вирус Коксаки, гепатит С, энтеровирус, ретровирус могут служить триггерными факторами СХУ [9]. В большинстве исследований в качестве основных этиологических причин отмечено снижение церебрального кровотока в определенных участках головного мозга [10—13], повышение лактата в цереброспинальной жидкости [14], нарушен ритм выделения кортизола и снижено его количество в крови больных в связи с повышенной активностью гипоталамо-гипофизарно-надпочечниковой системы [15—17], уменьшение мозгового нейротрофического фактора (BDNF) [18, 19], изменения в серотонинергической нейромедиаторной системе [20—22], активация системы цитокинов мозга [23, 24].
Многочисленные данные указывают на роль иммунологических нарушений при СХУ [25]. В литературе среди объективных показателей описывают снижение IgG за счет прежде всего G1- и G3-классов, числа лимфоцитов с фенотипом CD3 и CD4, естественных киллеров, повышение уровня циркулирующих комплексов и антивирусных антител разного типа, повышение β-эндорфина, интерлейкина-1 и интерферона, а также фактора некроза опухолей [26].
Некоторыми исследователями отмечено наличие разбалансировки вегетативной нервной системы при СХУ. M. Pagani с соавт. (1999) показали, что при СХУ наблюдается превалирование симпатической стимуляции из синоатриального узла в покое и снижение ответа сердечной мышцы на возбуждающие стимулы [27]. Получены данные о недостатке эндорфинов и других нейротрансмиттеров у лиц с СХУ.
Дефицит магния играет важную роль в патогенезе СХУ. Значительная часть магния (39%) находится внутри клеток, причем около 80—90% внутриклеточного магния образуется в комплексе с АТФ. Магний является кофактором более чем 300 ферментов, регулирующих различные функции организма [28]. Он играет ведущую роль в энергетическом, пластическом и электролитном обмене, выступает в качестве регулятора клеточного роста, необходим на всех этапах синтеза белка. Считают, что симптомы СХУ, по крайней мере частично, являются следствием нарушения клеточного метаболизма [29]. Для выработки АТФ необходимо несколько нутриентов, в т. ч. магний, яблочная кислота и активные формы витамина В. Недостаток этих ингредиентов способствует переключению метаболизма на менее эффективный анаэробный путь [30]. Это, в свою очередь, способствует патологическому нарастанию уровня молочной кислоты даже после небольшого физического напряжения, что клинически проявляется усталостью, слабостью, болью и мышечными спазмами.
Ряд исследований показывают, что оксидативный стресс играет центральную роль в развитии СХУ [31—33]. Оксидативный стресс приводит к повреждению наиболее важных полимеров — нуклеиновых кислот, белков и липидов клеточных мембран, полиненасыщенных жирных кислот, инактивации эндогенного оксида азота (NO) с образованием токсичных пероксинитритов. Недавние исследования показали, что пациенты с СХУ имеют более низкие уровни плазменного трансферрина и более высокую окисляемость липопротеидов [34]. Pall с соавт. [35] считают, что порочный клеточный цикл с избыточным накоплением нитрита азота, продуктов его окисления, пероксинитрита лежит в основе проявлений СХУ.
В результате исследований пациентов с СХУ установлена четкая связь между уровнем карнитина в плазме крови и риском развития СХУ. Более того, выявлено, что степень дефицита карнитина прямо связана со степенью выраженности симптомов СХУ. То есть чем меньше карнитина (и его эфиров) содержится в плазме крови человека, тем ниже его работоспособность и тем хуже самочувствие [36].
В ранних работах показано наличие изменений в белом веществе головного мозга у лиц с СХУ [37—40]. В последние годы появились исследования о состоянии серого вещества головного мозга у таких лиц (табл. 1
) [41—45].
| Таблица 1. Изменения объема серого вещества головного мозга при СХУ по данным различных исследований | ||||
| Год, автор | Результат | Результат | ||
| Серое вещество | Регион | Белое вещество | Регион | |
| Okada et al, 2004 [41] | Уменьшение | Билатерально префронтально | Незначимо | |
| de Lange et al, 2005 [43] | Уменьшение | Глобально, никаких особых регионов | Незначимо | |
| de Lange et al, 2008 [44] | Увеличение | Префронтально | Незначимо | |
| Barnden et al, 2011 [45] | Незначимо | Незначимо | ||
| Puri et al, 2012 [42] | Уменьшение | Затылочные доли, правая угловая извилина и задние отделы левой парагиппокампальной извилины | Уменьшение | Левая затылочная доля |
По данным литературы последних лет суммированы важные аспекты, связанные с объемом серого вещества головного мозга у больных с СХУ и такими его признаками, как наличие хронической боли, личность, стресс, психические расстройства, физическая активность и нарушения сна (табл. 2
).
| Таблица 2. Изменение объема серого вещества головного мозга при различных факторах | |
| Фактор | Регион |
| Хроническая боль | Поясная кора, префронтальная кора, островок, дорсальная часть варолиева моста [46] |
| Особенности личности | Орбитофронтальная область, затылочная и теменная кора, передняя префронтальная кора (у женщин) [47] |
| Стресс | Правая орбитофронтальная область префронтальной коры [48—50] |
| Психические расстройства | Амигдала, гиппокамп и парагиппокампальная область, вентральные, медиальные височной доли, кора островка [51] |
| Физическая активность | Правая префронтальная и поясная кора, левая префронтальная кора, поясная кора, двусторонние затылочно-височные регионы, мозжечок, правая передняя лобная кора, средние префронтальные извилины, передняя поясная кора, дополнительные моторная зона [52, 53] |
| Нарушения сна | Левая орбитофронтальная кора, билатерально передние отделы предклинья теменной коры, затылочно-теменная кора [54] |
Типичными факторами риска развития СХУ являются неблагоприятные экологогигиенические условия проживания, частые и длительные стрессы, приводящие к дезадаптации, нарушению физиологической реакции на стресс, однообразная напряженная работа, гиподинамия при избыточном нерациональном питании, отсутствие жизненных перспектив и широкого круга интересов в жизни.
Для диагностики СХУ используются критерии Центра контроля за заболеваниями (США), которые включают в себя комплекс больших, малых и объективных критериев (табл. 3
) [55, 56]. Диагноз СХУ устанавливается при наличии больших критериев, а также малых симптоматических критериев: 6 (или больше) из 11 симптоматических критериев и 2 (или больше) из 3 физикальных критериев или 8 (или больше) из 11 симптоматических критериев.
| Таблица 3. Критерии для диагностики СХУ | |
| Большие критерии | 1) немотивированная усталость и снижение работоспособности, двигательной активности (не менее чем на 50%) у ранее здоровых людей в течение последних четырех месяцев у взрослых и трех месяцев у детей 2) исключение других причин или болезней, которые могут вызвать хроническую усталость |
| Малые критерии | — повышение температуры тела до 38 °С — боли в горле, першение — небольшое увеличение (до 0,3—0,5 см) и болезненность шейных, затылочных и подмышечных лимфатических узлов — необъяснимая генерализованная мышечная слабость — миалгии — полиартралгии — периодические головные боли нового, необычного для больного характера — быстрая физическая утомляемость с последующей продолжительной (более 24 ч) усталостью — расстройства сна (гипо- или гиперсомния) — нейропсихологические расстройства (фотофобия, снижение памяти и невозможность концентрации внимания, повышенная раздражительность, депрессия) — быстрое развитие (в течение часов или дней) всего симптомокомплекса |
| Объективные критерии | 1) субфебрильная лихорадка 2) неэкссудативный фарингит 3) пальпируемые шейные или подмышечные лимфоузлы (до 2 см в диаметре) |
В сыворотке крови 20—25 % больных СХУ отмечается лейкоцитоз, приблизительно в таком же проценте случаев имеет место лимфоцитоз, почти у половины больных — моноцитоз и у трети больных — лимфопения. В 20% случаев наблюдается повышение СОЭ и/или активности трансаминаз в сыворотке крови. При анализе данных лабораторного обследования 579 больных СХУ, находящихся в 4 клиниках в США, не удалось получить специфический лабораторный профиль, характерный для этого заболевания [57]. Иммунограмма характеризовалась хронически низким уровнем активности гуморального и клеточного звена иммунитета. Биохимическое исследование мочи у пациентов с СХУ выявило уменьшение экскреции аминокислот, особенно аспарагиновой аминокислоты, фенилаланина, янтарной кислоты при увеличении 3-метилгистидина и тирозина, что является отражением нарушения метаболизма в мышечной ткани, имеющего место при СХУ [58].
К возможным осложнениям СХУ, что делает прогноз при этом заболевании достаточно серьезным, относятся депрессия, выраженные когнитивные нарушения, социальная дезадаптация, потеря трудоспособности, побочные эффекты и реакции вследствие медикаментозной терапии.
Больные с жалобами на необъяснимую усталость нуждаются в детальном и углубленном обследовании. Это необходимо не только для исключения других причинных заболеваний, но и для выбора тактики лечения. Диагноз СХУ может быть поставлен только при исключении множества других заболеваний: инфекционных и паразитарных процессов, заболеваний щитовидной железы, сопровождающихся гипофункцией, слип-апноэ, аутоиммунных заболеваний, онкологических заболеваний, гематологических заболеваний, неврологических заболеваний, психиатрических заболеваний (депрессия, шизофрения, злоупотребление алкоголем, снотворными или наркотиками), отравления тяжелыми металлами, промышленными ядами, последствий лучевого облучения и химиотерапии, метаболических миопатий (дефекты энзимов, недостаточность витамина D, витаминов группы В, железа и т. д.), медикаментозных миопатий (кортикостероиды, анестетики, клофибрат, аллопуринол, хлорохин, Д-пеницилламин, винкристин и др.).
Если выраженность усталости или другие симптомы не соответствуют критериям СХУ, то такую усталость следует относить к идиопатической хронической усталости. Термин «пролонгированная усталость» применяется в случаях, когда она наблюдается в течение 1 мес. и более (но меньше 6 мес.), что соответствует международным рекомендациям (табл. 4
).
| Таблица 4. Разграничения различных типов усталости | |
| 0 Необъяснимая усталость | Обычная оценка острых соматических и психологических заболеваний. Контроль через 1 мес. |
| 1 мес. Длительная усталость | Детальная оценка распространенных соматических (например, гипотиреоидизм, анемия) и психологических заболеваний (депрессии и др.). Контроль каждый месяц |
| 3 мес. Хроническая усталость | Детализированная диагностика усталости: соматический анамнез и обследование, психологический анамнез и обследование, лабораторные исследования. Контроль каждый месяц |
| 6 мес. Синдром хронической усталости | Диагностика и ведение СХУ: постановка специфического диагноза СХУ, доступ к информации по СХУ, контакт с группами поддержки (если они имеются). Контроль динамики и лечения ежемесячно |
Лечение пациента с СХУ должно быть рациональным и комплексным. Одними из важных условий лечения являются также соблюдение охранительного режима и постоянный контакт больного с лечащим врачом. В программу лечения синдрома хронической усталости в обязательном порядке должны включаться: нормализация режима отдыха и физической нагрузки, разгрузочно-диетическая терапия, витаминотерапия препаратами витаминов В1, В6, В12 и С, общий или сегментарный массаж совместно с гидропроцедурами и лечебной физкультурой, аутогенная тренировка или другие активные методы нормализации психоэмоционального фона, психотерапия, иммунокорректоры общего плана с адаптогенным эффектом, иные вспомогательные средства (дневные транквилизаторы, энтеросорбенты, ноотропные средства, антигистаминные средства при наличии аллергии).
На сегодняшний день недостаточно доказательств о пользе применения витаминов В12, С, КоQ10, магния или мультивитаминных комплексов или минералов для людей с СХУ. Однако ряд исследователей, выявивших дефицит антиоксидантов, L-карнитина, витаминов группы В, магния, считают, что добавление препаратов, содержащих эти нутриенты, может существенно уменьшить симптомы СХУ [59—61].
Универсальным средством являются поливитамины с макро- и микроэлементами. Из них подходящим для лечения СХУ является Берокка Плюс [62]. Фармакологическое действие определяется комплексом витаминов и минеральных веществ, входящих в состав препарата. Препарат содержит 7 витаминов группы В, витамин С, кальций и магний. В состав одной шипучей таблетки поливитаминного комплекса Берокка Плюс входит 500 мг аскорбиновой кислоты (витамина С), 15 мг тиамина (витамина В1), 15 мг рибофлавина (витамина B2), 23 мг пантотеновой кислоты (витамина В5), 10 мг пиридоксина гидрохлорида (витамина B6), 40 мг фолиевой кислоты (витамина B9), 10 мг цианокобаламина (витамина B12), 50 мг никотинамида (витамина B3), 15 мг биотина (витамина B8), 100 мг кальция, 100 мг магния и 10 мг цинка. Витамин В1 нормализует деятельность сердца и способствует нормальному функционированию нервной системы. Витамин В2 способствует процессам регенерации тканей, в т. ч. клеток кожи. Витамин В6 способствует поддержанию структуры и функции костей, зубов, десен, нормальному функционированию нервной системы, влияет на эритропоэз. Витамин С (аскорбиновая кислота) является биологическим антиоксидантом и играет важную роль в инактивации свободных радикалов, повышает абсорбцию железа в тонком кишечнике, влияет на метаболизм фолиевой кислоты и функцию лейкоцитов. Стимулирует формирование соединительной и костной ткани, нормализует проницаемость капилляров. Кальций участвует во многих физиологических процессах, ферментных системах, в комплексе с магнием и витамином В6 — в процессе передачи нервного импульса. Магний участвует в различных реакциях, включая синтез протеина, метаболизм жирных кислот, окисление сахаров. Цинк в качестве катализатора активирует более 200 ферментов и является компонентом многих белков, гормонов, нейропептидов, гормональных рецепторов, а также непосредственно участвует в синтезе коэнзимов, производных витамина В6. Препарат рекомендуется в качестве вспомогательной терапии при тяжелых или хронических заболеваниях, сопровождающихся состояниями усталости, раздражительности, бессонницы, длительного стресса, продолжительного инфекционного заболевания, лихорадки.
В последние годы наблюдается растущий интерес к возможным модулирующим эффектам поливитаминов на настроение и когнитивную деятельность [63, 64]. Было показано, что в случаях пограничного или более тяжелого дефицита поливитамины усиливают когнитивные функции [65]. Более поздние данные свидетельствуют о том, что такие добавки могут улучшать поведенческие функции (т. е. настроение и когнитивные функции/производительность) даже при отсутствии дефицита витаминов. Одно исследование показало, что прием поливитаминов в течение 33 дней улучшил настроение и внимание у мужчин [66, 67]. В том же исследовании уровень ощутимого стресса сократился в группе активного лечения, что согласуется с данными нескольких других исследований. Например, прием поливитаминных добавок снижал оценку по шкале по депрессии, тревожности и стресса в восьминедельном исследовании (DASS (Depression, Anxiety and Stress) [68],уменьшал профессиональный стресс в 90-дневном испытании [69] и улучшал плохое настроение в ответ на острые лабораторные факторы, вызывающие стресс, через девять недель приема добавок [70].
О роли витаминов группы В в поддержании и улучшении когнитивных функций убедительные данные представили C. McGarel и соавт. (2015) [71]. Согласно двойному слепому плацебо-контролируемому рандомизированному сбалансированному перекрестному дизайну исследования, 20 участников (средний возраст 29 ± 5,54 года) принимали поливитаминные препараты (Берокка®) и плацебо. Через 30 мин после принятия препаратов они проходили оценку когнитивных функций, состоящую из 10-минутной батареи тестов на определение познавательной способности, непосредственно до и после нее у участников оценивали настроение по шкале оценки настроения. Пять дополнительных участников прошли сканирование фМРТ после лечения во время активирующих заданий на быструю обработку визуальной информации (Rapid Visual Information Processing — RVIP) и время осмотра (Inspection Time — IT). Терапию поливитаминами связывали со значительно улучшающейся производительностью в тесте последовательного вычитания троек и личным удовлетворением согласно самооценке участника. ФМРТ показала, что оба типа поливитаминной терапии повышали активацию в зонах, связанных с кратковременной памятью для обработкой внимания. Кроме того, в первый раз была продемонстрирована повышенная активация мозга после приема поливитаминных препаратов по измерениям с помощью фМРТ. Таким образом, A. Scholey и соавт. убедительно показали, что витаминно-минеральные комплексы Берокка объективно оказывают положительный эффект на когнитивные функции индивидов, что подтверждается данными нейрокогнитивного и функционального МРТ-исследований [72].
Помимо витаминной составляющей, в препарате Берокка Плюс представлены такие минеральные вещества, как кальций (Ca), магний (Mg) и цинк (Zn), положительное влияние которых на когнитивные и иные неврологические функции неоднократно описывалось в литературе [73—75].
Берокка Плюс назначается по одной шипучей таблетке ежедневно, растворенной в достаточном количестве жидкости. Продолжительность лечения до 30 дней и определяется индивидуально, в среднем составляет 7—10 дней. Берокка Плюс в таблетках, покрытых оболочкой, — детям в возрасте 15 лет и старше, а также взрослым назначается внутрь по 1 таблетке (запивать водой). Повторные курсы назначаются по усмотрению врача.
Для всех больных СХУ рекомендуются обязательные ежедневные пешие прогулки в течение 2—3 ч, курсы ЛФК, массаж, гидротерапия и аутогенная тренировка, поскольку последняя, как и другие активные методы нормализации психоэмоционального фона, исходя из патогенеза СХУ, являются важнейшими патогенетическими элементами терапии соответствующей категории пациентов.
Прогноз для больного синдромом хронической усталости при обратном развитии симптомов в течение первых лет заболевания (1—2 года) обычно благоприятный. При длительном течении синдрома, появлении его после 40 лет, признаках депрессии шансы на полное выздоровление уменьшаются.
Таким образом, с учетом сложности диагностики и лечения СХУ актуальными являются профилактика и раннее лечение, поиск эффективных при данном синдроме лекарственных средств, дополнительных клинических исследований лечебных возможностей различных медикаментозных и нелекарственных схем лечения.
Литература
1. Bombardier CH, Buchwald D. Chronic fatigue, chronic fatigue syndrome, and fibromyalgia. Medical Care, 1996, 34(9): 924–930. 2. Buchwald D, Pearlman T, Umali J, Schmaling K, Katon W. Functional status in patients with chronic fatigue syndrome, other fatiguing illnesses, and healthy individuals. The American Journal of Medicine, 1996, 101(4): 364–370. 3. Steele L, Dobbins JG, Fukuda K et al. The epidemiology of chronic fatigue in San Francisco. The American Journal of Medicine, 1998, 105(3): 83–90. 4. Fukuda K, Dobbins JG, Wilson LJ, Dunn RA, Wilcox K, Smallwood D. An epidemiologic study of fatigue with relevance for the chronic fatigue syndrome. Journal of Psychiatric Research. 1997, 31(1): 19–29. 5. Jason LA, Richman JA, Rademaker AW et al. A community-based study of chronic fatigue syndrome. Archives of Internal Medicine. 1999, 159(18): 2129–2137. 6. Christley Y, Duffy T, Martin CR. A review of the definitional criteria for chronic fatigue syndrome. Journal of Evaluation in Clinical Practice. 2012, 18(1): 25–31. 7. Richman JA, Flaherty JA, Rospenda KM. Chronic fatigue syndrome: have flawed assumptions been derived from treatment-based studies? The American Journal of Public Health. 1994, 84(2): 282–284. 8. Jordan KM, Landis DA, Downey MC, Osterman SL, Thurm AE, Jason LA. Chronic fatigue syndrome in children and adolescents: a review. Journal of Adolescent Health. 1998, 22(1): 4–18. 9. Manian F.A. Simultaneous measurement of antibodies to Epstein-Barr virus, human herpesvirus 6, herpes simplex virus types 1 and 2, and 14 enteroviruses in chronic fatigue syndrome: is there evidence of activation of a nonspecific polyclonal immune response? Clin Infect Dis. 1994 Sep, 19(3): 448-53. 10. Biswal B, Kunwar P, Natelson BH. Cerebral blood flow is reduced in chronic fatigue syndrome as assessed by arterial spin labeling. Journal of the Neurological Sciences. 2011, 301(1-2): 9–11. 11. Yoshiuchi K, Farkas J, Natelson BH. Patients with chronic fatigue syndrome have reduced absolute cortical blood flow. Clinical Physiology and Functional Imaging. 2006, 26(2): 83–86. 12. Schmaling KB. Single-photon emission computerized tomography and neurocognitive function in patients with chronic fatigue syndrome. Psychosomatic Medicine. 2003, 65(1): 129–136. 13. Lewis DH, Mayberg HS, Fischer ME et al. Monozygotic twins discordant for chronic fatigue syndrome: regional cerebral blood flow SPECT. Radiology. 2001, 219(3): 766–773. 14. Mathew SJ, Mao X, Keegan KA et al. Ventricular cerebrospinal fluid lactate is increased in chronic fatigue syndrome compared with generalized anxiety disorder: an in vivo 3.0 T 1H MRS imaging study. NMR in Biomedicine. 2009, 22(3): 251–258. 15. Jerjes WK, Taylor NF, Wood PJ, Cleare AJ. Enhanced feedback sensitivity to prednisolone in chronic fatigue syndrome. Psychoneuroendocrinology. 2007, 32(2): 192–198. 16. Jerjes WK, Taylor NF, Peters TJ, Wessely S, Cleare AJ. Urinary cortisol and cortisol metabolite excretion in chronic fatigue syndrome. Psychosomatic Medicine. 2006, 68(4): 578–582. 17. Cleare AJ. The HPA axis and the genesis of chronic fatigue syndrome. Trends in Endocrinology & Metabolism. 2004, 15(2): 55–59. 18. Chen R, Moriya J, Yamakawa J-I et al. Brain atrophy in a murine model of chronic fatigue syndrome and beneficial effect of Hochu-ekki-to (TJ-41) Neurochemical Research. 2008, 33(9): 1759–1767. 19. Tang SW, Chu E, Hui T, Helmeste D, Law C. Influence of exercise on serum brain-derived neurotrophic factor concentrations in healthy human subjects. Neuroscience Letters. 2008, 431(1): 62–65. 20. Katafuchi T, Kondo T, Take S, Yoshimura M. Brain cytokines and the 5-HT system during poly I:C-induced fatigue. Annals of the New York Academy of Sciences. 2006, 1088: 230–237. 21. Cleare AJ, Messa C, Rabiner EA, Grasby PM. Brain 5-HT1A receptor binding in chronic fatigue syndrome measured using positron emission tomography and [11C]WAY-100635. Biological Psychiatry. 2005, 57(3): 239–246. 22. Yamamoto S, Ouchi Y, Onoe H et al. Reduction of serotonin transporters of patients with chronic fatigue syndrome. NeuroReport. 2004, 15(17): 2571–2574. 23. Rostène W, Kitabgi P, Parsadaniantz SM. Chemokines: a new class of neuromodulator? Nature Reviews Neuroscience. 2007, 8(11): 895–903. 24. Natelson BH, Weaver SA, Tseng C-L, Ottenweller J. E. Spinal fluid abnormalities in patients with chronic fatigue syndrome. Clinical and Diagnostic Laboratory Immunology. 2005, 12(1): 52–55. 25. Buchwald D, Komaroff AL. Review of laboratory findings for patients with chronic fatigue syndrome. Rev Infect Dis. 1991, 13(1): 12-8. 26. Мороз И.Н, Подколзин А.А. Новое в диагностике и лечении синдрома хронической усталости. Профилактика старения. 1999, 1: 45-47. 27. Pagani M, Ospedale L. Sacco. Chronic fatigue syndrome: a hypothesis focusing on the autonomic nervous system. Clin. Sci (Colch). 1999, 96 (1): 117-125. 28. Altura BM. Basic biochemistry and physiology of magnesium: a brief review. Magnesium & Trace Elements. 1991, 10: 167-171. 29. Manuel y Keenoy B, Moorkens G, Vertommen J, Noe M, Nuve J, De Leeuw I. Magnesium status and parameters of the oxidant-antioxidant balance in patients with chronic fatigue: effects of supplementation with magnesium. J. Am. Coll. Nutr. 2000, 19 (3): 374-82. 30. Abraham G, Flechas J. Management of fibromyalgia: Rationale for the use of magnesium and malic acid. J. Nutr. Med. 1992, 3: 49-59. 31. Fulle S, Mecocci P, Fanó G, Vecchiet I, Vecchini A, Racciotti D, Cherubini A, Pizzigallo E, Vecchiet L, Senin U, Beal MF. Specific oxidative alterations in vastus lateralis muscle of patients with the diagnosis of chronic fatigue syndrome. Free Radic Biol Med. 2000, 29(12): 1252-9. 32. Richards RS, Roberts TK, McGregor NR, Dunstan RH, Butt HL. Blood parameters indicative of oxidative stress are associated with symptom expression in chronic fatigue syndrome. Redox Rep. 2000, 5(1): 35-41. 33. Logan AC, Wong C. Chronic fatigue syndrome: oxidative stress and dietary modifications. Altern Med Rev. 200, 6(5): 450-9. 34. Manuel y Keenoy B1, Moorkens G, Vertommen J, De Leeuw I. Antioxidant status and lipoprotein peroxidation in chronic fatigue syndrome. Life Sci. 2001, 68(17): 2037-49. 35. Pall ML, Satterlee JD. Elevated nitric oxide/peroxynitrite mechanism for the common etiology of multiple chemical sensitivity, chronic fatigue syndrome, and posttraumatic stress disorder. Ann N Y Acad Sci. 2001 Mar, 933: 323-9. 36. Kuratsune H, Yamaguti K, Takahashi M, Misaki H, Tagawa S, Kitani T. Acylcarnitine deficiency in chronic fatigue syndrome. Clin. Infect. Dis. 1994, 18(1): 62-7. 37. Lange G, Deluca J, Maldjian JA, Lee H-J, Tiersky LA, Natelson BH. Brain MRI abnormalities exist in a subset of patients with chronic fatigue syndrome. Journal of the Neurological Sciences. 1999, 171(1): 3–7. 38. Lange G, Holodny AI, DeLuca J et al. Quantitative assessment of cerebral ventricular volumes in chronic fatigue syndrome. Applied Neuropsychology. 2001, 8(1): 23–30. 39. Cope H, Pernet A, Kendall B, David A. Cognitive functioning and magnetic resonance imaging in chronic fatigue. The British Journal of Psychiatry. 1995, 167: 86–94. 40. Cope H, David AS. Neuroimaging in chronic fatigue syndrome. Journal of Neurology Neurosurgery and Psychiatry. 1996, 60(5): 471–473. 41. Okada T, Tanaka M, Kuratsune H, Watanabe Y, Sadato N. Mechanisms underlying fatigue: a voxel-based morphometric study of chronic fatigue syndrome. BMC Neurology. 2004, 4(1, article 14). 42. Puri BK, Jakeman PM, Agour M et al. Regional grey and white matter volumetric changes in myalgic encephalomyelitis (chronic fatigue syndrome): a voxel-based morphometry 3 T MRI study. The British Journal of Radiology. 2012, 85(1015): e270–e273. 43. de Lange FP, Kalkman JS, Bleijenberg G, Hagoort P, van der Meer JWM, Toni I. Gray matter volume reduction in the chronic fatigue syndrome. NeuroImage. 2005, 26(3): 777–781. 44. de Lange FP, Koers A, Kalkman JS et al. Increase in prefrontal cortical volume following cognitive behavioural therapy in patients with chronic fatigue syndrome. Brain. 2008, 131, part 8: 2172–2180. 45. Barnden LR, Crouch B, Kwiatek R et al. A brain MRI study of chronic fatigue syndrome: evidence of brainstem dysfunction and altered homeostasis. NMR in Biomedicine. 2011, 24(10): 1302–1312. 46. May A. Chronic pain may change the structure of the brain. Pain. 2008, 137(1): 7–15. 47. Gardini S, Cloninger CR, Venneri A. Individual differences in personality traits reflect structural variance in specific brain regions. Brain Research Bulletin. 2009, 79(5): 265–270. 48. Geuze E, Vermetten E, Bremner JD. MR-based in vivo hippocampal volumetrics: 1. Review of methodologies currently employed. Molecular Psychiatry. 2005, 10(2): 147–159. 49. Kitayama N, Vaccarino V, Kutner M, Weiss P, Bremner JD. Magnetic resonance imaging (MRI) measurement of hippocampal volume in posttraumatic stress disorder: a meta-analysis. Journal of Affective Disorders. 2005, 88(1): 79–86. 50. Smith ME. Bilateral hippocampal volume reduction in adults with post-traumatic stress disorder: a meta-analysis of structural MRI studies. Hippocampus. 2005, 15(6): 798–807. 51. Sprengelmeyer R, Steele JD, Mwangi B et al. The insular cortex and the neuroanatomy of major depression. Journal of Affective Disorders. 2011, 133(1-2): 120–127. 52. Colcombe S, Kramer AF. Fitness effects on the cognitive function of older adults: a meta-analytic study. Psychological Science. 2003, 14(2): 125–130. 53. Colcombe SJ, Erickson KI, Scalf PE et al. Aerobic exercise training increases brain volume in aging humans. Journals of Gerontology A: Biological Sciences and Medical Sciences. 2006, 61(11): 1166–1170. 54. Altena E, Vrenken H, van der Werf YD, van den Heuvel OA, van Someren EJW. Reduced orbitofrontal and parietal gray matter in chronic insomnia: a voxel-based morphometric study. Biological Psychiatry. 2010, 67(2): 182–185. 55. Fukuda K, Straus SE, Hickie I et al. The chronic fatigue syndrome: a comprehensive approach to its definition and study. Ann. Intern. Med. 1994, 121: 953-9. 56. Turnbull N, Shaw EJ, Baker R, Dunsdon S, Costin N, Britton G, Kuntze S. and Norman R. Chronic fatigue syndrome/myalgic encephalomyelitis (or encephalopathy): diagnosis and management of chronic fatigue syndrome/myalgic encephalomyelitis (or encephalopathy) in adults and children. London: Royal College of General Practitioners, 2007. 57. Bates DW, Buchwald D, Lee J et al. Clinical Laboratory Test Findings in Patients with Chronic Fatigue Syndrome. Arch. Intern. Med. 1995, 155: 97-103. 58. Suzanne H. Niblett, Katrina E. King, R. Hugh Dunstan, Phillip Clifton-Bligh, Leigh A. Hoskin, Timothy K. Roberts, Greg R. Fulcher, Neil R. McGregor, Julie C. Dunsmore, Henry L. Butt, Iven Klineberg and T.B. Rothkirch. Hematologic and Urinary Excretion Anomalies in Patients with Chronic Fatigue Syndrome. Experimental Biology and Medicine. 2007, 232: 1041-1049. 59. Jacobson W, Saich T, Borysiewicz LK, Behan WM, Behan PO, Wreghitt TG. Serum folate and chronic fatigue syndrome. Neurology. 1994, 44(11): 2214-5. 60. Vecchiet J, Cipollone F, Falasca K, Mezzetti A, Pizzigallo E, Bucciarelli T, De Laurentis S, Affaitati G, De Cesare D, Giamberardino MA. Relationship between musculoskeletal symptoms and blood markers of oxidative stress in patients with chronic fatigue syndrome. Neurosci Lett. 2003, 335(3): 151-4. 61. Werbach MR. Nutritional strategies for treating chronic fatigue syndrome. Altern. Med. Rev. 2001, 6 (1): 4-6. 62. www.berocca.ru. 63. Grima NA, Pase MP, Macpherson H, Pipingas A. The effects of multivitamins on cognitive performance: A systematic review and meta-analysis. J. Alzheimer’sDis. 2012, 29: 561-569. 64. Kennedy DO, Haskell CF. Vitamins and cognition: What is the evidence? Drugs 2011, 71, 1957-1971. 65. Heseker H, Kubler W, Pudel V, Westenhofer J. Interaction of vitamins with mental performance. Bibl. Nutr. Dieta 1995, 52, 43-55. 66. Kennedy DO, Veasey R, Watson A, Dodd F, Jones E, Maggini S, Haskell CF. Effects of high-dose B vitamin complex with vitamin C and minerals on subjective mood and performance in healthy males. Psychopharmacology 2010, 211, 55-68. 67. Kennedy DO, Veasey RC, Watson AW, Dodd FL, Jones EK, Tiplady B, Haskell CF. Vitamins and psychological functioning: A mobile phone assessment of the effects of a B vitamin complex, vitamin C and minerals on cognitive performance and subjective mood and energy. Hum. Psychopharmacol. Clin. Exp. 2011, 26, 538-547. 68. Harris E, Kirk J, Rowsell R, Vitetta L, Sali A, Scholey AB, Pipingas A. The effect of multivitamin supplementation on mood and stress in healthy older men. Hum. Psychopharmacol. Clin. Exp. 2011, 26, 560-567. 69. Stough C, Scholey A, Lloyd J, Spong J, Myers S, Downey LA. The effect of 90 day administration of a high dose vitamin B—Complex on work stress. Hum. Psychopharmacol. Clin. Exp. 2011, 26, 470-476. 70. Haskell C.F, Robertson B, Jones E, Forster J, Jones R, Wilde A, Maggini S, Kennedy DO. Effects of a multi—Vitamin/mineral supplement on cognitive function and fatigue during extended multi—Tasking. Hum. Psychopharmacol. Clin. 2010, 25, 448-461. 71. McGarel C, Pentieva K, Strain JJ, McNulty H. Emerging roles for folate and related B-vitamins in brain health across the lifecycle. Proc. Nutr. Soc. 2015. 74(1): 46-55. 72. Scholey A, Bauer I, Neale C, Savage K, Camfield D, White D, Maggini S, Pipingas A, Stough C, Hughes M. Acute effects of different multivitamin mineral preparations with and without Guaraná on mood, cognitive performance and functional brain activation. Nutrients. 2013. 5(9). 3589-3604. 73. Студеникин В.М., Курбайтаева Э.М. Кальциопенические состояния и их коррекция. Лечащий врач, 2010, 10: 54-56. 74. Студеникин В.М., Турсунхужаева С.Ш., Шелковский В.И. Цинк в нейропедиатрии и нейродиетологии. Лечащий врач. 2012: 44-47. 75. Студеникин В.М., Турсунхужаева С.Ш., Звонкова Н.Г., Пак Л.А., Шелковский В.И. Магний и его препараты в психоневрологии. Эффективная фармакотерапия. Неврология и психиатрия. 2012. 4: 8-12, 58-60.
Источник:
Медицинский совет, № 2, 2015
Кроме МРТ, как проверить сосуды головы?
Для исследования вен и артерий головного мозга применяются также ультразвуковые методы исследования, которые легко переносятся, не имеют противопоказаний и не требуют специальной подготовки.
Самое простое исследование — ультразвуковая допплерография (УЗДГ) показывает в каких основных артериях и венах головы нарушено движение крови. Основной метод ультразвуковой диагностики самых разных заболеваний сосудов мозга — дуплексное сканирование. Оно выявляет нарушения кровоснабжения, когда еще нет никаких симптомов. Транскраниальная ультразвуковая допплерография (ТКУЗДГ или ТКДГ) дополнительно оценивает кровоток в крупных внутричерепных сосудах.
Сравнение изображений, полученных с помощью: УЗИ (слева), МРТ (по центру), КТ (справа)
Ультразвуковое исследование безопасно, но не дает объемной картины и значительно проигрывает МРТ в информативности.
Для исследования сосудов применяют также компьютерную томографию (КТ) — это сканирование рентгеновскими лучами. Мультиспиральная КТ является более продвинутым видом исследования и способна воссоздать трехмерные изображения на экране компьютера. Недостатком данного метода является лучевая нагрузка на организм.
МРТ или КТ сосудов головного мозга?
МРТ и КТ имеют свои преимущества в разных ситуациях. Людям, у которых в теле есть электронные устройства (кардиостимулятор) или предметы из магнитных металлов, разрешена только КТ.
На МР-исследование уходят десятки минут, при этом нужно лежать неподвижно. На проведение КТ уходит меньше времени, но данная процедура проходит с применением рентгеновского излучения. КТ нельзя делать слишком часто. Процедура противопоказана беременным на любом сроке. МРТ проводится столько раз, сколько это нужно, она противопоказана лишь в 1 триместре беременности.
МРТ сосудов головного мозга — это безопасная процедура, которая позволит получить развернутую картину заболевания. В медицинском можно пройти МР-сканирование по предварительной записи в любой удобный день и время.