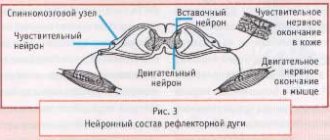
Определение
«Синдром фиксированного спинного мозга» является адаптацией англоязычного термина «the tethered spinal cord syndrome» (Yamada S., 1981). Использование в оригинальном названии слова «tether», означающего в дословном переводе привязь для домашних животных, связано с желанием наиболее точно отразить суть патологического процесса, описываемого им. Именно растяжение спинного мозга, развивающееся в результате ограничения его подвижности, то есть фиксации, приводит к негативному воздействию и развитию клинических проявлений СФСМ.
Yamada, S. (Ed.). (2010). 3 Pathophysiology of Tethered Cord Syndrome. Tethered Cord Syndrome in Children and Adults. doi:10.1055/b-0034-80501
Впервые термин «tethered spinal cord» (фиксированный спинной мозг) был использован Hoffman при описании результатов лечения 31 больного, страдающего тазовыми расстройствами в сочетании с двигательными нарушениями и снижением чувствительности в нижних конечностях. Симптоматика у всех больных регрессировала после иссечения утолщенной конечной нити. На основании полученных данных авторы заключили, что патологический процесс развивается в результате растяжения каудальных отделов спинного мозга (Hoffman H.J., 1976).
Утолщения и борозды
В рассматриваемой части нервной системы выделяют два утолщения:
- шейное утолщение;
- пояснично-крестцовое утолщение.
Разделительными границами считают переднюю срединную щель и заднюю борозду. Эти границы расположены между половинами спинного мозга, симметрично расположенными.
Срединная щель с обеих сторон окружена передней латеральной бороздой. Двигательный корешок берет свое начало из передней латеральной борозды.
Орган обладает боковыми и передними канатиками. Передняя латеральная борозда эти канатики разделяет между собой. Немаловажна роль и задней латеральной борозды. Сзади она играет роль своеобразной границы.
Патогенез
Известно, что от чрезмерного растяжения спинной мозг предохраняют так называемые «зубовидные связки», фиксирующие спинной мозг в просвете позвоночного канала (Tunituri A.R., 1977). Тогда как на уровне шейного и грудного отделов позвоночника они значительно развиты (Breig A., 1970; Tubbs R.S., 2001), на уровне поясничного отдела их нет, и растяжению каудальных отделов спинного мозга препятствуют лишь эластические свойства конечной нити (Tani S., 1991).
Yamada, S. (Ed.). (2010). 3 Pathophysiology of Tethered Cord Syndrome. Tethered Cord Syndrome in Children and Adults. doi:10.1055/b-0034-80501
При растяжении конечной нити у больных с СФСМ наблюдалось ее удлинение не более чем на 10%, при этом в норме она удлиняется на 50% и больше (De Vloo P., 2016). Световая микроскопия участка патологически измененной конечной нити у больных с СФСМ выявила преобладание фиброзной ткани, при окрашивании на эластин его содержание было минимальным (Hendson G., 2016). На основании полученных данных было выдвинуто предположение о том, что СФСМ развивается в результате натяжения каудальных отделов спинного мозга между последней парой зубовидных связок и любой неэластичной структурой, фиксирующей его каудально (Yamada S., 1981).
Yamada, S. (Ed.). (2010). 3 Pathophysiology of Tethered Cord Syndrome. Tethered Cord Syndrome in Children and Adults. doi:10.1055/b-0034-80501
В 1981 году S. Yamada в эксперименте на кошках продемонстрировал замедление метаболизма в тканях каудальных отделов спинного мозга при растяжении и последующее его восстановление при устранении натяжения. Спустя несколько лет в 1987 г. официально было предложено считать «синдром фиксированного спинного мозга» (tethered spinal cord syndrome) научно обоснованным клиническим диагнозом (McLone D., 1987), с этого момента этот термин все чаще стал появляться в литературе.
В настоящее время большинство отечественных и зарубежных специалистов характеризуют СФСМ как сочетание двигательных, чувствительных, трофических нарушений в нижних конечностях, а также тазовых расстройств и скелетно-мышечных деформаций, развивающихся в результате иммобилизации и растяжения каудальных отделов спинного мозга при патологиях конечной нити (“tight filum terminale” – неэластичная конечная нить, липома конечной нити и др.), миелодисплазиях (ММЦ, спинальные липомы), комплексных спинальных дизрафиях (диастематомиелия, дермоид, эпидермоид, энтеральные кисты, дермальный синус), а также при поствоспалительных и послеоперационных рубцово-пролиферативных изменений терминальной цистерны (лептопахи-менингит, арахноидальные кисты и др.) (McLone D.G., 1997; Iskandar B.J., 1998; Tortori–Donati P., 2000;).
Причины развития СФСМ — чаще всего последствия коррекции спинномозговой грыжи, а также Spina Bifida Occulta
Как устроено донорство костного мозга: мифы, страхи, побочные эффекты
Для трансплантации необязательна совместимость групп и резус-факторов крови, важнее именно генетическая совместимость. Среди идеально подходящего неродственного донора и родственного донора, совпадающего не по всем пунктам, врачи выберут, скорее всего, последнего, потому что с ним ниже вероятность отказа от донации.
Порой больному подходят сразу 50-70 доноров, но бывает, что «генетический близнец» в регистре вовсе не находится. В последнем случае можно попробовать организовать донорские акции, чтобы больше людей прошли типирование, но в любом случае, если подходящего донора нет в банке, помочь пациенту не получится. Каждый год не менее трех тысяч людей умирают, потому что не смогли найти себе подходящего донора.
Пациент и донор с одним и тем же этническим происхождением вероятнее подойдут друг другу. Чем больше людей проходит типирование, тем больше в регистрах разных генетических данных, а значит, выше вероятность совместимости пациента и донора.
По данным американской компании Be The Match, больше всего проблем с поиском донора костного мозга у темнокожих людей, индейцев, уроженцев Аляски, азиатов, коренных гавайцев и других жителей островов Тихого океана, латиноамериканцев и метисов. Американский Институт юстиции сообщает, что афроамериканцы, у которых нет родственного донора, находят себе подходящего только в 25 % случаев, при этом, если донора нашли, в 80 % случаев это единственный вариант в реестре. Для азиатов этот показатель равен 40 %, для латиноамериканцев — 45 %, для европейцев — 75 %. Конкретный процент для метисов в статистике не приводится, но институт уточняет, что для них ситуация гораздо хуже.
Зачем нужны доноры костного мозга?
Трансплантация костного мозга ежегодно требуется более чем 5 тысячам россиян, из них 4214 пересадок нужны взрослым и 900 — детям. В России нет общего регистра данных для доноров, каждый банк считает своих доноров сам. По словам онколога-гематолога Сергея Семочкина, самый большой банк стволовых клеток в России находится в Кирове в . В нем зарегистрировано 35 787 человек.
Еще один большой реестр доноров костного мозга в нашей стране находится в ведении «Русфонда» — Национальный регистр доноров костного мозга имени Васи Перевощикова. Он существует с 2013 года и объединяет 12 региональных российских регистров и один казахский. На 31 октября 2021 года в нем состояли 29 178 доноров костного мозга.
Во всемирном банке костного мозга (Bone Marrow Donors Worldwide) зарегистрировано 35,6 миллиона человек. Однако найти там совместимого с россиянином донора сложно — в нашей стране много национальностей и генетических сочетаний, которых нет больше нигде в мире. Вероятность, что русский человек найдет подходящего донора в отечественном регистре, выше, чем в зарубежных.
Семочкин приводит пример, что зачастую кавказцы не могут найти своего «генетического двойника» в европейской базе. Но у них больше детей в семье, поэтому выше вероятность найти родственного донора. Огромная проблема с поиском доноров и у малочисленных этносов, например, жителей Крайнего Севера. Как правило, найти донора им не удается.
Единственное решение проблемы — вступление в национальный регистр как можно большего количества людей разных национальностей. Как объясняет Семочкин, затраты на трансплантацию клеток и все остальные процедуры российского пациента с российским же донором не превышают 160 000 рублей. В то же время процедуры и трансплантация с донором из европейского банка требуют порядка 20 000 евро. Государство не может выделить такие деньги, у пациентов их тоже, как правило, нет — финансирование ложится на благотворительные фонды.
Как стать донором?
В России стать донором может любой здоровый гражданин РФ без хронических заболеваний в возрасте от 18 до 45 лет, в некоторых случаях — до 50 лет. Возраст имеет значение: чем моложе донор, тем выше концентрация клеток в трансплантате и их «качество».
Студентка магистратуры МГИМО Ирина стала донором костного мозга в конце октября этого года. До этого она с 18 лет регулярно сдавала кровь и тромбоциты в донорских организациях. Три года назад она прочитала колонку Валерия Панюшкина «Встреча» о том, как познакомились донор и реципиент, и окончательно решила сдать костный мозг.
Первый шаг — сдача крови на типирование. Это можно сделать в любой из крупных частных медицинских лабораторий или в лабораториях некоторых медицинских центров или регистров. Посмотреть полный список центров, позволяющих попасть в банк «Русфонда», можно здесь.
Ирина выбрала Национальный медицинский исследовательский центр гематологии. Там она сдала около 10 миллилитров крови на типирование и подписала соглашение о вступлении в регистр. Оно ни к чему не обязывает донора — можно отказаться в любой момент. Но это важно для реципиента — за 10 дней до пересадки стволовых клеток проводится высокодозная химиотерапия, которая полностью уничтожает кроветворную и иммунную системы. Поэтому отказ в последнюю минуту может быть губителен для того, кто ждет трансплантации.
Через полтора месяца после типирования на электронную почту Ирины пришло сообщение, что с анализами все в порядке и ее занесли в регистр.
Классификация
Очевидно, что существенный вклад в развитие клинической симптоматики при спинальных дизрафиях, помимо растяжения, могут вносить объемные воздействия (сдавление), деформация, а также врожденные нарушения цито- и ангиомиелоархитектоники (Kumar R., 2010). На основании представления о СФСМ как об обратимом патологическом состоянии S. Yamada и D.J. Won предложили разделять процессы, обусловленные ограничением подвижности спинного мозга (истинный СФСМ) и состояния, имеющие сходные с СФСМ клинические проявления, заключающие в своем патогенезе, помимо растяжения, иные факторы неблагоприятного воздействия (компрессия, деформация и др.), а также патологии, вовсе не относящиеся к СФСМ, вызванные преимущественно нарушением формирования спинного мозга и имеющие неблагоприятный прогноз операции, направленной на устранение фиксации спинного мозга (Yamada S., 2007). К первой категории отнесли больных с аномалиями конечной нити, грыжами крестцовой локализации и каудальными липомами небольших размеров, при которых основной вклад в патогенез клинических проявлений вносит продольное растяжение спинного мозга. Ко второй категории — больных с миеломенингоцеле поясничного отдела позвоночника, липомиелоцеле и повторной рубцовой фиксацией спинного мозга. У этих больных, очевидно, только часть из предъявляемой симптоматики относится к СФСМ и может регрессировать после операции. К третьей категории больных отнесли детей со спинномозговыми грыжами грудного отдела позвоночника, сопровождаемыми врожденной параплегией и недержанием (Yamada, 2007).
Классификация СФСМ по Yamada, Won 2007
В соответствии с описанными категориями были распределены ожидаемые результаты и показания к операции. При устранении фиксации в первой категории больных ожидался полный регресс симптоматики, а больные из третьей категории практически не имеют шансов на восстановление утраченных функций (Liptak G.S., 1995).
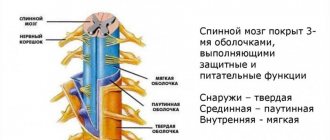
Оболочки мозга
- Твердая оболочка. Находится сразу за надкостницей позвоночника, однако вплотную к ней не прилегает. Между надкостницей и твердой оболочкой расположено эпидуральное пространство. Ткань твердой оболочки — соединительная, в ней расположены сосуды, лимфатические и кровеносные. Эпидуральное пространство заполнено жировой клетчаткой. Здесь же расположены венозные сплетения.
- Паутинная оболочка — сеть тонких пластинок из соединительной ткани, по строению напоминающих паутину. Пластинки составлены коллагеновыми и эластическими волокнами. Между паутинной и мягкой оболочкой есть субарохноидальное пространство с ликвором, обеспечивающим обмен и питание нейронов.
- Мягкая оболочка. Это сосудистое окружение, имеющее зубчатые связки для фиксации и обеспечивающее связь и питание между ликвором и мозгом.
Эпидемиология
Несмотря на то, что истинная частота встречаемости СФСМ неизвестна, а количество больных с классическим СФСМ, обусловленным аномалиями конечной нити, по некоторым данным, не превышает 0,1% в детской популяции (Bademci G., 2006), только в США в период с 1993 по 2002 год было проведено более 9000 операций, направленных на устранение фиксации спинного мозга (Lad S.P., 2007).
СФСМ проявляется в периоды ускоренного роста детей
По мнению большинства авторов, для СФСМ характерно прогредиентное течение, при этом возраст, в котором может наступить ухудшение состояния, варьирует от 8 месяцев до 16 лет и не всегда соответствует периодам ускоренного роста. Отмечается, что в старшем возрасте манифестация СФСМ может быть связана с физической нагрузкой или травмой (Pang D., 1982)
В течение первого года жизни ребенок вырастает в среднем на 20см за счет удлинения туловища
Экспериментальные данные позволяют утверждать, что своевременное устранение фиксации может приводить к восстановлению функции спинного мозга (Yamada S., 1981; Schneider S.J., 1993). Вместе с тем было показано, что внезапное чрезмерное растяжение спинного мозга может приводить к возникновению необратимых структурных изменений (Kocak A., 1997). В этом случае, в отличии от постепенного длительного растяжения (Pfister B.J., 2004), наиболее вероятно формирование стойкого неврологического дефицита вследствие разрыва проводящих путей спинного мозга (Yamada S., 2003).
В этой связи обеспокоенность вызывает тот факт, что дети, страдающие СФСМ, зачастую, длительное время находятся под наблюдением ортопедов и урологов, не получая соответствующего нейрохирургического лечения. Это может привести к формированию необратимого неврологического и ортопедического дефицита, а также к стойким тазовым расстройствам
Главные функции костного мозга
Первая и главная задача костного мозга – производство элементов крови, или гемопоэз. Поэтому нарушения в процессе кроветворения напрямую связаны с проблемами функционирования костного мозга. Если он не работает должным образом, возможно ухудшение самочувствия человека без, казалось бы, видимых на то причин.
Недостаточная активность костного мозга может вызывать такие состояния как:
- слабость и быстрая утомляемость (из-за нехватки гемоглобина, который отвечает за транспортировку кислорода);
- лихорадка (из-за недостаточного количества лейкоцитов);
- склонность к инфекционным заболеваниям (из-за снижения лейкоцитов, которые необходимы для борьбы с инфекциями);
- неровное дыхание (из-за нехватки эритроцитов и вызванным этим кислородным голоданием);
- кровоподтеки или кровотечения (из-за дефицита тромбоцитарной массы).
Кроме того, если вспомнить, что именно благодаря кровотоку все ткани и органы получают кислород и питательные вещества, то становится ясно: от костного мозга зависит абсолютно каждая клетка человеческого тела.
Также костный мозг – это стержневой элемент лимфатической системы. Все лимфоциты зарождаются именно в этой ткани. И если учесть, что иммунная система напрямую зависит от работоспособности лимфатической, то окажется, что без костного мозга не существовало бы и иммунитета. Большинство антител крови, которые защищают организм от патогенов, синтезируются именно в костном мозге.
Клиническая диагностика
Своевременному выявлению СФСМ на той стадии заболевания, когда патологический процесс еще имеет обратимый характер, способствует настороженность относительно наличия кожных стигм дизэмбриогенеза и скелетно-мышечных деформаций у новорожденных (Aldana P.R., 2009).
Кожные проявления выявляются у 40% детей с СФСМ. К ним относят локальный гипертрихоз («хвост фавна»), подкожную липому, кожную ангиому, пигментные пятна, рудиментарные кожные выросты в пояснично-крестцовой области.
Кожные «стигмы» дизэмбриогенеза: гипертрихоз, подкожная липома, кожная ангиома.
Могут обращать на себя внимание врожденные скелетно-мышечные деформации в виде укорочения, гипотрофии нижних конечностей, деформации стоп (Bui C.J., 2007). Характерными для СФСМ считаются асимметричные деформации — «полая», эквиноварусная стопа, «куркообразные» пальцы и др. Хотя асимметрия нижних конечностей часто выявляется при СФСМ, выраженная гипотрофия одной из нижних конечностей («нога аиста») встречается редко (Lagae L., 1990)
«Внешние» проявления СФСМ у детей
СФСМ проявляется прогрессирующими тазовыми нарушениями (недержание или задержка мочи и кала). Родители могут о у ребенка или постоянное ее подтекание, а также частые запоры или эпизоды каломазания.
В старшем возрасте можно выяснить, изменилась ли походка, не появилась ли неловкость при ходьбе, беге, не менялась ли со временем подошва у обуви, в какую сторону она истончалась (кнаружи или кнутри) (Еликбаев Г.М., 2008). Могут отмечаться болезненные ощущения при поворотах туловища, сгибаниях или разгибаниях. В предподростковом возрасте основными клиническими проявлениями СФСМ являются слабость в ногах, нарушения походки, недержание мочи, вновь развившаяся деформация стоп (Yamada S., 2004).
Клиническая симптоматика СФСМ
Для подростков с СФСМ характерна прогрессирующая сколиотическая деформация позвоночника, а также недержание мочи, преимущественно в виде эпизодов геластического недержания, зачастую трактуемых как проявление инфекции мочевыводящих путей.
В периоды ускоренного роста деформация позвоночника может быть основной жалобой (Trivedi J., 2002). Развитие при этом деформации одной из стоп (полая стопа, косолапость) с противоположной дуге сколиоза стороны, с большой степенью вероятности, следует трактовать как проявление СФСМ (Yamada S., 2001).
При оценке данных неврологического обследования отмечается, что СФСМ чаще всего протекает в виде асимметричных неравномерных чувствительных и двигательных нарушений, сопровождаемых снижением сухожильных рефлексов, а также тазовыми расстройствами по смешанному типу (Yamada S., 2004). Однако, в ряде случаев могут выявляться грубые трофические нарушения, сопровождаемые нарушением целостности кожного покрова — трофическими язвами (Николаев С.Н., 1996; Brand N., 1996).
Расстройства функции тазовых органов выявляются у 40% больных с СФСМ, являясь в 4% случаев единственным его клиническим проявлением (Притыко А.Г., 1997; Metcalfe P.D., 2006). У большинства больных с СФСМ выявляются признаки гипотонии детрузора мочевого пузыря на фоне поражения парасимпатического центра мочеиспускания. В зависимости от степени сохранности уретрального сопротивления тазовые расстройства у них протекают в виде постоянного или периодического недержания мочи с накоплением различного объема остаточной мочи, требующего в ряде случаев катетеризации мочевого пузыря (Хачатрян В.А., 2009). Чаще всего подобные нарушения уродинамики сопровождаются хроническими запорами и каломазанием вследствие снижения тонуса сфинктеров прямой кишки (Kayaba H., 2003).
Уменьшение объема наполнения мочевого пузыря на фоне повышения тонуса его мускулатуры наблюдается реже и может быть следствием поражения спинного мозга выше уровня конуса. При этом происходит разобщение структур сегментарного аппарата и супраспинальных центров. Гипервозбудимость детрузора, проявляющаяся клинически в виде императивных, ложных позывов, вызвана ирритацией стенки мочевого пузыря при сохранности достаточного количества функционирующих нейронов парасимпатического сакрального центра. Зачастую у детей с СФСМ на фоне нарушений уродинамики выявляются признаки хронической инфекции мочевыводящих путей, пузырно-мочеточникового рефлюкса и уретерогидронефроз (Еликбаев Г.М., 2008).
Таким образом, клиническая диагностика СФСМ основывается на выявлении кожных стигм дизэмбриогенеза, костно-мышечных деформаций, слабости, нарушений чувствительности в нижних конечностях, а также тазовых расстройств.
За что отвечает красный костный мозг
Основной функцией, которую выполняет красный костный мозг, является функция кроветворения или гемопоэза. Она осуществляется постоянно и исключительно интенсивно – в кроветворных органах образуется более 300 млн. клеток крови в минуту. Функция кроветворения уникальна тем, что в нужное время и в нужном месте продуцируется огромное, но в то же время оптимальное количество клеток крови необходимого вида. Костный мозг может ускорить производство любой разновидности клеток крови в 5-6 раз, если организму требуется их больше. Все клетки крови развиваются из единой родоначальной клетки. Она имеет морфологию малого лимфоцита и называется мультипотентной гемопоэтической стволовой клеткой (ГСК). Ее потомками являются все клетки периферической крови. В процессе делений и дифференцировки мультипотентной ГСК образуется вся кроветворная ткань. Она объединяет как клетки-предшественники, так и созревающие и зрелые клетки крови: эритроциты, тромбоциты и лейкоциты, из которых состоит периферическая кровь человека.
Гемопоэз объединяет два больших отдела кроветворения: лимфопоэз и миелопоэз.
- Миелопоэз (или миелоидное кроветворение). В норме, единственным местом, где после рождения протекает данный процесс, является красный костный мозг. Там образуются все форменные элементы крови, кроме лимфоцитов (тромбоциты, эритроциты, моноциты и гранулоциты), чтобы затем поступить в периферическую кровь.
- Лимфопоэз (образование Т-лимфоцитов и В-лимфоцитов). После рождения реализуется в центральных и периферических лимфоидных органах. К первым относится красный костный мозг, а также тимус (который сохраняет функции лимфоидного органа лишь до половой зрелости организма); ко вторым – лимфатические узлы, селезенка и пейеровы бляшки ЖКТ.
Эритроциты, которые также называют «красные кровяные тельца» – клетки, не имеющие ядра, которым присуща форма двояковогнутого диска. Она поддерживается в эритроцитах благодаря спектрину (стабилизирующему белку мембраны). Размер эритроцита в норме колеблется между 7,5 мкм и 8,3 мкм, а продолжительность жизни составляет 90-120 дней. Всем известные основные группы крови (I, II, III, IV) выделяют на основании антигенных свойств эритроцитов. Функцию эритроциты выполняют чрезвычайно важную – они транспортируют дыхательные газы. Цитоплазма эритроцита заполнена гемоглобином на 96%. Это хромопротеид, состоящий из двух частей: глобина и гема. Первая является белковой, а вторая – небелковой и представляет собой комплекс протопорфирина IX и железа. Кислород из альвеол легких транспортируется к клеткам всего организма именно благодаря гемоглобину, и наоборот, от клеток к альвеолам – с помощью углекислого газа. В норме каждая молекула гемоглобина содержит две пары идентичных белковых цепей. Их обозначают буквами α и β из греческого алфавита. В зависимости от состава этих цепей различают три вида гемоглобина: эмбриональный, фетальный и гемоглобин взрослых.
В периферической крови помимо зрелых эритроцитов можно обнаружить молодые эритроциты – ретикулоциты. Это клетки без ядра, но содержат в себе большое количество РНК и рибосом, которые имеют мембранные рецепторы к трансферрину. РНК ретикулоцитов продолжает производить гемоглобин. На этой стадии возможна выработка гемоглобина до 30% от общего количества в эритроците. Большая же часть синтезируются на преретикулоцитных стадиях дифференцировки клетки – 70-80% гемоглобина. Когда ретикулоцит превращается в зрелый эритроцит, он больше не может производить гемоглобин, так как теряет РНК. В костном мозге эритроцит на стадии ретикулоцита находится в течение одного дня, а затем еще один день – в периферической крови.
Лейкоциты, названные, в свою очередь, белыми кровяными тельцами – это неоднородная (гетерогенная) группа клеток периферической крови, которые содержат ядро. Они выполняют функцию иммунитета и различаются по нескольким признакам. По форме ядра – сегментированное или округлое, по цвету и характеру цитоплазмы, а также по зернистости – ее наличию или отсутствию.
Если специфическая зернистость отсутствует, лейкоциты называются агранулоцитами, а если присутствует – гранулоцитами. К первым относятся лимфоциты и моноциты.
Гранулоциты же отличаются между собой характером специфической зернистости и бывают трех видов:
- Нейтрофилы (содержат обильную мелкую бледно-фиолетовую («нейтрофильную») зернистость).
- Базофилы (с крупной и необильной темно-фиолетовой («базофильной») зернистостью).
- Эозинофилы (отличаются зернистостью, занимающей всю цитоплазму клетки).
Благодаря лейкоцитам в организме реализуется защитная функция – иммунитет, который бывает специфический и неспецифический.
В одном из проявлений неспецифического иммунитета участвуют нейтрофилы, моноциты и тканевые макрофаги (в них превращаются моноциты после того, как выходят за пределы кровеносного русла). Они фагоцитируют (захватывают) с последующим лизисом (растворением) микробы, токсины и клеточный детрит (проще говоря, мусор). Эозинофилы обеспечивают защиту от паразитов и участвуют в аллергических реакциях (как и базофилы).
Лимфоциты осуществляют реакции специфического иммунитета, будь то врожденного или приобретенного. Специфический иммунитет, в свою очередь, бывает гуморальный и клеточный. Гуморальный иммунитет реализуется благодаря синтезу В-лимфоцитами иммуноглобулинов классов A, M, G, E, D; а клеточный – с помощью многообразных функций Т-лимфоцитов. Приобретенный иммунитет может формироваться естественным путем, вследствие различных инфекционных заболеваний, или в результате иммунизации организма.
Размеры лейкоцитов составляют от 6 мкм (малые лимфоциты) до 14 мкм (моноциты).
Лейкоциты отличаются между собой не только внешним видом и функцией, но и продолжительностью жизни. Так, например, длительность жизни лимфоцитов колеблется между несколькими часами и десятками лет. Моноциты циркулируют в крови на протяжении 72 часов, а потом выходят в ткани, где превращаются в фиксированные или мигрирующие макрофаги. Нейтрофилы находятся в крови 4-10 ч, с последующим выходом в ткани.
Тромбоциты – третий форменный элемент крови. Их приравнивают к истинным клеткам, хотя они и не являются таковыми. На самом деле, это частицы отшнуровавшейся цитоплазмы мегакариоцитов костного мозга, так называемые кровяные пластинки. Тромбоциты характеризуются свойствами агрегации (склеивания) и адгезии (прилипания). Их участие в механизмах свертывания крови и фибринолиза определяется наличием особых биологически активных веществ. Также они помогают поддерживать нормальную резистентность и функционирование микрососудов (ангиотрофическая функция). Размер тромбоцитов составляет 1-2 мкм, а продолжительность жизни – 8 суток.
Инструментальная диагностика
В настоящее время МРТ практически полностью вытеснила СКТ-миелографию из диагностики СФСМ, оставив УЗИ полезным диагностическим методом у новорожденных. Наряду с этим, считается, что подбор кандидатов даже для этого неинвазивного исследования должен основываться на тщательном клиническом обследовании.
Ранее полагали, что все дети с СФСМ имеют незаращение дуг позвонков (Boone D., 1985), однако современные исследования показывают, что СФСМ встречается и при отсутствии spina bifida (Ackerman L.L., 2003). Таким образом, несмотря на то, что встречаемость spina bifida occulta в популяции составляет порядка 22%, лишь небольшая часть из них имеет СФСМ (Nejat F., 2008).
Известно, что в период внутриутробного развития рост позвоночного столба опережает увеличение длины спинного мозга, формируя разницу в длине и более высокое окончание спинного мозга. Наиболее активно разница в их длине увеличивается с 12-й по 20-ю неделю гестации, замедляясь в последующем (Zalel Y., 2006).
Ранее считалось, что у новорожденных спинной мозг заканчивается на уровне диска L2-L3 позвонков, а затем мигрирует краниально и к двум месяцам достигает уровня L1-L2 позвонков (Barson A.J., 1970). Последующие исследования показали, что в большинстве случаев он оканчивается на уровне L2-позвонков уже при рождении (Wolf S., 1992; Robbin M.L., 1994; Hill C.A., 1995).
Уровень окончания спинного мозга в норме может варьироваться от середины Th12 до середины L3-позвонка, однако в 94-98% случаев он находится выше уровня диска L2-L3 позвонков (Reimann A.F., 1944). Учитывая эти данные, сформировалось представление о том, что при расположении конуса спинного мозга ниже уровня L2-позвонка можно говорить о рентгенологических признаках СФСМ. Тем не менее низкое расположение конуса спинного мозга может наблюдаться у части здоровых новорожденных (Hughes J.A., 2003; Thakur N.H., 2011), а СФСМ может развиваться и при нормальном расположении конуса спинного мозга (Warder D.E., 1993).
Низкое расположение конуса спинного мозга при различных формах спинальных дизрафий
Конечная нить
В норме спинной мозга оканчивается конечной нитью, представляющей из себя фиброваскулярный тяж из параллельно расположенных пучков коллагена, соединенных поперечной сетью коллагена и расположенными между ними эластиновыми волокнами и капиллярами (Fontes et al 2006). Диаметр конечной нити в норме составляет от 1,1 до 1,2 мм (Yundt K.D., 1997). При ее толщине более 2 мм было предложено считать диагноз СФСМ обоснованным.
Конечная нить спинного мозга в норме (слева) и при патологии (справа)
Однако, утолщение конечной нити, как выяснилось в дальнейшем, не является обязательным условием развития СФСМ (Pinto F.C., 2002), а его клинические проявления могут развиваться и при меньшем диаметре конечной нити (Nхazar G.B., 1995; Selden N.R., 2006). Также не является обязательным признаком наличия СФСМ жировая инфильтрация конечной нити, выявляемая в норме у 5,8% обследуемых (McLendon R.E., 1988).
При фиксации спинного мозга конечная нить чаще всего располагается позади корешков конского хвоста, а спинной мозг отклонен кзади и прилежит к паутинной оболочке (Fitz C.R., 1975).
Натянутая конечная нить (указана стрелкой) плотно прилегает изнутри к истонченной твердой мозговой оболочке
В качестве методов дополнительной дифференциальной диагностики, было предложено проведение МРТ в положении лежа на животе, а также стоя при сгибании и разгибании туловища (функциональная МРТ), однако до сих пор они не получили широкого распространения (Levy L.M., 1988; Zamani A.A., 1998; Witkamp T.D., 2001; Niggemann P., 2011; Singh S., 2012).
В положении на животе (снимок справа) сохраняется отклонение конуса и конечной нити спинного мозга дорсально.
Опыт проведения ДВИ-трактографии больным с СФСМ позволил предположить ее роль в плане дифференциальной диагностики структур спинного мозга и рубцовых тканей, а также позволил выдвинуть предположение о том, что по показателям фракционной анизотропии можно судить о степени сохранности проводников спинного мозга и оценивать прогноз хирургического лечения СФСМ (Filippi C.G., 2010).
ДВИ-трактография спинного мозга и корешков конского хвоста (справа)
Таким образом, не один из ранее предложенных нейровизуализационных критериев диагностики СФСМ в настоящее время не является абсолютным.
Данные электрофизиологических методов обследования, как полагают, также не имеют решающего значения в диагностике СФСМ (Yamada S., 2007). В частности, исследование вызванных соматосенсорных (ССВП) и двигательных (МВП) потенциалов у детей зачатую неинформативно, а традиционно рассматриваемые паттерны электронейромиограммы (ЭНМГ), несмотря на выявляемую клиническую картину СФСМ, могут находиться в пределах нормы (Гусев А.Р., 1990). Сообщается, что регистрация ССВП с большеберцовых нервов может быть использовано в качестве скринингового метода обследования, а также для оценки отдаленных результатов хирургического лечения СФСМ у взрослых (Li V., 1996; Kale S.S., 1998).
Необходимо отметить, что многие авторы указывают на значение данных уродинамического обследования при диагностике СФСМ, в том числе и при рецидиве фиксации спинного мозга (Meyrat B.J., 2003; Metcalfe P.D., 2006; Rendeli C., 2007; Maher C.O., 2009).
Анатомические особенности
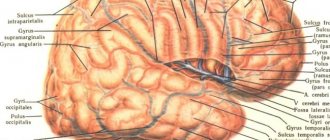
Спинной мозг располагается в полости позвоночного канала, которая образована при помощи отростков позвонков и их тел. Началом строения спинного мозга является затылочное отверстие головного мозга. Далее спинной мозг располагается в канале, представляя собой 40 — сантиметровый «шнур», окруженный тремя оболочками.
Заканчивается внутренний орган скоплением нервных волокон на уровне первых позвонков в поясничном отделе, получивших название конского хвоста. Здесь же начинается сужение, и далее внутренний орган «вытягивается» в терминальную (концевую, конечную) нить, диаметр которой равен 1 мм. Терминальная нить тянется до копчикового отдела, где срастается с надкостницей.
Нижняя часть коцевой нити плотно обвита волокнами «конского хвоста». При возникновении болей в области копчика медики говорят о синдроме с аналогичным названием. Строение спинного мозга человека таково, что собственно мозговое вещество находится под постоянной защитой — это обеспечивают оболочки и сам позвоночный столб.
Внешнее строение — это оболочки и пространство между ними.
Хирургическое лечение
Полиэтиологичность СФСМ, по мнению ряда специалистов, зачастую приводит к необоснованному расширению показаний к его хирургическому лечению (Kulkarni A.V., 2004). В связи с этим показания к операции было предложено считать обоснованными при сочетании характерных рентгенологических, клинических проявлений СФСМ и прогредиентном течении заболевания (Drake J.M., 2007; Wykes V., 2012). Наряду с этим, большинство исследователей отмечают преимущественно обратимый характер изменений при ранней коррекции СФСМ (Yamada S., 2007) и редкое улучшение состояния после операции у больных с длительно существующей симптоматикой (McLone D., 1997; Iskandar B.J., 1998; Haro H., 2004; Hajnovic L., 2007). Следует также отметить, что у считающихся «бессимптомными» больных признаками развития СФСМ могут быть недиагносцированные изменения походки, сколиоз, а также нарушения уродинамики, протекающие под маской хронической инфекции мочевыводящих путей (Sanchez T., 2014).
Ранее считавшаяся целесообразной выжидательная тактика была обусловлена, по всей видимости, риском общей анестезии, а также условиями манипулирования на относительно малых по размеру и кажущихся более уязвимыми структурах спинного мозга у детей. Развитие анестезиологического обеспечения, микрохирургической техники и интраоперационного нейрофизиологического мониторинга, безусловно, позволило успешно проводить хирургические вмешательства в любом возрасте сразу после интроскопической верификации патологии, даже при бессимптомном течении заболевания (Hoffman H.J., 1985; Tamaki N., 1988; Kanev P.N., 1990; Koyanagi I., 1997; Schoenmakers M.A., 2003; George T.M., 2005; Rinaldi F., 2005). Таким образом, в настоящее время сформировалось представление о целесообразности раннего профилактического хирургического лечения СФСМ, направленного на предотвращение возможного необратимого повреждения спинного мозга. Особенно актуальным представляется устранение фиксации у подростков до наступления периода ускоренного роста.
Хирургическое лечение СФСМ заключается в устранении каудально расположенных факторов фиксации, в частности: патологически измененной конечной нити (жировое перерождение, утолщение, укорочение, снижение эластичности), патологических образований позвоночного канала (липома, дермоид, дермальный синус, костные, фиброзные, перегородки), а также рубцовых и арахноидальных сращений (Caldarelli M., 2013):
Пересение патологически изменнной конечной нити
Удаление липомы конуса спинного мозга
Удаление дермоидной кисты
Устранение диастематомиелии
Предпочтение отдается «органосберегающим» методикам — ляминотомии, микрохирургической технике. В качестве дополнительных опций ряд авторов сообщают об эффективности использования СО2–лазера и УЗИ-аспиратора при диссекции тканей, указывая на минимальную дисперсию энергии и незначительное травматическое воздействие лазера и ультразвука по сравнению с традиционными методами (McLone D.G., 1986; Browd S.R., 2009), а также на целесообразность проведения интраоперационного нейрофизиологического мониторинга (Sala F., 2002).
Вид операционной Операционный микроскоп
Первый этап — выделение PRP и BMAC
Для получения PRP у пациентов отбирают по 60 мл периферической крови, добавляют 10 мл антикоагулянта цитратдекстрозы и центрифугируют полученную смесь с последующим концентрированием. В результате этого в среднем получается 7–8 мл плазмы, обогащенной тромбоцитами.
Получения BMAC проводят с помощью иглы для биопсии, которая через кожу и подкожные ткани вводится в правый гребень подвздошной кости. При помощи медленной аспирации отбирается 2 шприца по 25 мл, в которые добавляется по 1000 ед\мл гепарина. Полученную смесь фильтруют и центрифугируют в течение 10 минут, получая в итоге 17 мл BMAC.
После отбора PRP и BMAC смешивают в соотношении 1:2. Последним этапом данного метода является введение полученного препарата пациенту.
В эксперименте принимали участие семь человек с различными повреждениями спинного мозга, средний возраст пациентов составил 43,7 ± 2,33 года. После получения травмы пациенты перенесли минимум два вмешательства (физиотерапию и хирургическое вмешательство), а в период от 2,4 месяцев до 6,2 лет после травмы получили лечение смесью PRP и BMAC.
Показатели ODI отслеживали с помощью опроса по категориям: интенсивность боли, уход за собой, подъем, ходьба, положения сидя и стоя, сон, сексуальная жизнь, социальная жизнь и путешествия. Пациенты должны были оценить свое состояние от 0 (нет дискомфорта из-за травмы) до 5 (максимальный дискомфорт) в каждой категории. Все оценки складывались и делились на 50, чтобы получить процент функциональной инвалидности.
У 6 из 7 пациентов на момент начала эксперимента имелась значительная функциональная инвалидность. Один пациент после процедуры прекратил свои наблюдения, а динамика остальных пяти была отображена в исследовании. У двух пациентов наблюдались изменения от «тяжелой инвалидности» до «минимальной инвалидности», они вернули способность выполнять все бытовые дела самостоятельно. Показатели третьего пациента улучшились на 40% за год, а у четвертого улучшилось состояние на 28% за два месяца наблюдения.
Побочные эффекты наблюдались у одного из семи подопечных. Он не мог получать внутривенное введение препарата. Пациент сообщил о головной боли и трудностях, связанных с памятью.
Данный метод лечения помогает избежать дополнительного травмирования, которое возникает при введении инъекций в пораженный участок спинного мозга. Он безопасен и эффективен для восстановления после травм. У пациентов наблюдается положительная динамика и минимальное количество побочных эффектов. Потенциал такого лечения велик, и оно претендует занять передовое место при борьбе с повреждениями спинного мозга.
Интраоперационный нейрофизиологический мониторинг
В связи с тем, что частота развития неврологических выпадений при хирургическом лечении СФСМ в среднем составляет 10,9% (Choux M., 1994), для профилактики осложнений были предложены различные методы интраоперационного нейрофизиологического мониторинга, направленного на идентификацию и оценку функции возбудимых проводящих структур (корешков) спинного мозга. Для этого сочетали регистрацию соматосенсорных, двигательных вызванных потенциалов, бульбокавернозного рефлекса, а также электромиографию (free-run EMG) и стимуляционную электронейромиографию (DNS) с мышц нижних конечностей и наружного сфинктера прямой кишки. По данным литературы наибольшую информативность продемонстрировал мониторинг вызванных двигательных потенциалов в сочетании со стимуляционной электро-нейромиографией (Paradiso G., 2006).
Мультимодальный интраоперационный нейрофизиологический мониторинг
Особенности проведения нейрофизиологического мониторинга у детей с СФСМ обусловлены нарушением формирования и незрелостью спинного мозга, а также его растяжением, деформацией и ишемией. На этом фоне регистрация вызванных потенциалов и бульбокаверного рефлекса крайне затруднительна (Rodi Z., 2001), и основным методом нейромониторинга остается стимуляционная электронейромиография, преследующая цель электростимуляционного картирования корешков спинного мозга (ЭСК) (Deletis V., 1992).
Электростимуляционное картирование корешков спинного мозга
Несмотря на известные пороговые значения силы тока для передних и задних корешков спинного мозга, их величины для функционально значимых структур в условиях пороках развития спинного мозга до сих пор не установлены. Аналогии с результатами исследований, в ходе которых при стимуляции конечной нити вольтаж, необходимый для мышечного ответа, превышал таковой при стимуляции двигательного корешка в 100 раз (von Koch C.S., 2002), провести не удалось, поскольку при вовлечении корешка в массу жировой ткани или рубец величина порогового раздражения может значительно увеличиваться. Это, как полагают, может быть связано с рассеиванием возбуждения или частичной потерей корешком проводящих свойств.
Литература
- Mescher A.L. Junqueira’s Basic Histology text and atlas. McGraw-Hill Education / Medical, 2021. — 576 p.;
- Sean J. Morrison, David T. Scadden. (2014). The bone marrow niche for haematopoietic stem cells. Nature
.
505, 327-334; - Быков В.Л. Цитология и общая гистология. Функциональная морфология клеток и тканей человека. СПб.: «Сотис», 2002;
- Шумаков В.И., Казаков Э.Н., Онищенко Н.А., Гуреев С.В., Остроумов Е.Н., Честухин В.В. и др. (2003). Первый опыт клинического применения аутологичныхмезенхимальных стволовых клеток костного мозга для восстановления сократительной функции миокарда. «Российский кардиологический журнал». 5, 42–50;
- What does my bone marrow do? (2016). Myelodysplastic Syndromes Foundation;
- Гедро Н.Н. (2013). Современное отделение трансплантации костного мозга. «Медицинская сестра». 2, 7–9;
- Субботина Н.Н., Долгополов И.С., Попа А.В., Бояршинов В.К., Пименов Р.И., Менткевич Г.Л. (2014). Гаплоидентичная трансплантация гемопоэтических стволовых клеток у детей с острыми миелоидными лейкозами: эволюция метода и собственные данные. «Клиническая онкогематология». 2, 131–136;
- O. V. Paina, N. V. Stancheva, Ye. V. Semenova, S. N. Bondarenko, O. A. Slesarchuk, et. al.. (2015). Haploidentical hematopoietic stem cell transplantation in the treatment of children and adolescents with resistant forms of acute leukemia. Ross. ž. det. gematol. onkol.
.
2, 39-45; - E. G. Khamaganova, L. A. Kuzmina. (2019). ASSESSMENT OF HLA-COMPATIBILITY AND REQUIREMENTS FOR HLA-TYPING OF PATIENT AND DONOR IN ALLOGENEIC HEMATOPOIETIC STEM CELL TRANSPLANTATION. Gematologiâ i transfuziologiâ
.
64, 175-187.
Скрытый синдром фиксированного спинного мозга
Одной из актуальных проблем детской нейрохирургии является выбор оптимальной тактики лечения скрытого синдрома фиксированного спинного мозга, при котором, несмотря на выявляемую характерную клиническую картину СФСМ отсутствуют такие его критерии, как низкое расположение конуса спинного мозга (ниже уровня тела L2 позвонка), а также утолщение (более 2мм в диаметре) и/или укорочение конечной нити
Пациент со скрытым СФСМ, конус спинного мозга на уровне L1 позвонка
Учитывая, что описанные в литературе группы наблюдений скрытого СФСМ сравнительно невелики, к настоящему времени не сложилось единого мнения относительно оптимальной тактики лечения этой патологии. Большинство специалистов указывают на целесообразность иссечения конечной нити и приводят данные о высокой эффективности этой манипуляции, тогда как ряд авторов, напротив, выражают сомнения относительно наличия достаточных показаний к хирургическому вмешательству. Их скептицизм основан, в том числе, на том, что расстройства мочеиспускания у детей, считающееся наиболее характерным признаком скрытого СФСМ, связаны с растяжением конуса спинного мозга не более чем в 1,5% случаев, а истинными его причинами являются другие патологии.
При сгибании туловища высота позвоночного канала увеличивается более чем на 7%. При этом амортизация продольного натяжения, передаваемого на спинной мозг, обеспечивается за счет эластических свойств конечной нити, обусловленных сбалансированным сочетанием эластиновых, коллагеновых и ретикулярных волокон. Одной из возможных причин развития скрытого СФСМ считают инвазию жировой ткани, склерозирование и дистрофические изменения, в результате которых снижается эластичность конечной нити. При недостаточной компенсации растяжения оно передается каудальным отделам спинного мозга, а при дальнейшем нарастании вертебро-медуллярной диспропорции распространяется на выше расположенные сегменты спинного мозга. Формирование развернутой клинической картины СФСМ может занимать длительный период времени и иметь ремиттирующий характер на фоне периодов замедления роста и рефлекторного ограничения двигательной активности, при этом часть из сформировавшегося двигательного, чувствительного или ортопедического дефицита может оказаться необратимой . Очевидно, что ранняя диагностика и своевременная коррекция скрытого СФСМ оказывает существенное влияние на прогноз заболевания. При сочетании стойких к медикаментозной терапии тазовых расстройств и/или болевого синдрома, а также при наличии характерных неврологических и ортопедических нарушений у детей со spina bifida occulta, на наш взгляд, существуют показания к иссечению конечной нити, даже при нормальном расположении каудальных отделов спинного мозга.
Электростимуляционная идентификация и пересечение натянутой конечной нити при скрытом СФСМ
За что отвечает желтый костный мозг
Желтый костный мозг обычно находится в диафизах трубчатых костей. Состоит из ретикулярной ткани и клеток адипоцитов, которые содержат специальный пигмент-липохром в центре полости длинных костей, а снаружи ее окружает слой красного костного мозга. Жир из адипоцитов, в случае крайней необходимости, например, после длительного голодания, организм может использовать в качестве источника энергии. В обычных условиях желтый костный мозг не участвует в гемопоэзе, но в исключительных случаях, например, после сильной кровопотери или при острой анемии, часть желтого костного мозга может превратиться в красный, чтобы ускорить восстановление крови.
Результаты и прогноз
Считается, что хирургическое лечение СФСМ позволяет достигнуть улучшения или стабилизации состояния 70-80% больных (Herman J.M., 1993; Sarwark J.F., 1996; Koyanagi I., 1997; Sharif S., 1997; Lee G.Y., 2006; Lad S.P., 2007; Bowman R.M., 2009; Ostling L.R., 2012). По разным данным, болевой синдром регрессирует в большинстве случаев (Maher C.O., 2007; Bowman R.M., 2009; Romagna A., 2013), в то время как улучшение двигательной функции наблюдается не более чем у 80% больных. По данным J.M. Herman c соавторами, в период до 4 лет после операции улучшилось или стабилизировалось состояние 93% детей, оперированных по поводу ММЦ, и 100% детей, оперированных по поводу спинальных липом (Herman J.M., 1993).
Ближайшие и отдаленные результаты хирургического лечения детей с СФСМ в клинике нейрохирургии детского возраста РНХИ им. проф. А.Л. Поленова
Уменьшение деформации позвоночника в результате коррекции СФСМ отмечается в 20-50% случаев, а ее стабилизация в 10-20% (Herman J.M., 1993; Bowman R.M., 2001). Вместе с тем отмечено, что при величине угла деформации по Кобб более 40° устранение фиксации, как правило, не приводит к улучшению (Pierz K., 2000; McGirt M.J., 2009). Встречаются также описания наблюдений, при которых у больных с ММЦ на уровне грудного отдела позвоночника сколиоз прогрессирует, несмотря на устранение фиксации (Reigel D.H., 1994).
Относительно функции тазовых органов данные авторов существенно отличаются. Сообщается как об их улучшении (в 30-60% случаев), в том числе и после повторных вмешательств (Herman J.M., 1993; Bowman R.M., 2001; Metcalfe P.D., 2006; Tarcan T., 2006; Abrahamsson, K., 2007; Maher C.O., 2009), так и об отсутствии изменений по сравнению с дооперационным уровнем (Fone P.D., 1997). Улучшение емкостных характеристик наиболее ожидаемы у больных с нарушениями уродинамики по типу «гиперактивного» мочевого пузыря (Khoury A.E., 1990; Nogueira M., 2004; Guerra L.A., 2006).
Развитие или нарастание неврологического дефицита после операции установлено, по разным данным, в 9,5-35% наблюдений, чаще при повторных вмешательствах (Herman J.M., 1993; Albright A.L., 1999; Wang B., 2002). В основном речь идет об урологических осложнениях (2,2%) (Lad S.P., 2007). О встречаются реже других нежелательных последствий операции (ликворея, менингит и др.) (Cochrane D.D., 1998; Al-Holou W.N., 2009; Bowman R.M., 2009;) и наиболее ожидаемы при повторных вмешательствах (Maher C.O., 2007). Развитие послеоперационных раневых осложнений наиболее ожидаемо у больных, оперированных по поводу миеломенингоцеле, что обусловлено, по всей видимости, нарушением трофики мягких тканей и неудовлетворительной консолидацией раны. Вероятность возникновения менингита значительно увеличивается при формировании ликворного свища. При выявлении ликвореи у этих больных в первую очередь должна быть исключена гидроцефалия или дисфункция шунта (Ростоцкая В.И., 1962; Орлов Ю.А., 1993; Хачатрян В.А., 1995; Hudgins R.J., 2004). К другим осложнениям относят несостоятельность швов и расхождение операционной раны, встречающиеся в 7-10% наблюдений (Bowman R.M., 2009).
Лечение корешкового синдрома
В случаях, когда корешковый синдром обусловлен дегенеративно-дистрофическими заболеваниями позвоночника, используют преимущественно консервативную терапию. При интенсивном болевом синдроме показан покой, обезболивающая терапия (диклофенак, мелоксикам, ибупрофен, кеторолак, лидокаино-гидрокортизоновые паравертебральные блокады), купирование мышечно-тонического синдрома (метилликаконитин, толперизон, баклофен, диазепам), противоотечное лечение (фуросемид, этакриновая кислота), нейрометаболические средства (витамины гр. В). С целью улучшения кровообращения и венозного оттока назначают эуфиллин, ксантинола никотинат, пентоксифиллин, троксерутин, экстракт каштана конского. По показаниям дополнительно используют хондропротекторы (экстракт хряшей и мозга телят с витамином С, хондроитинсульфат), рассасывающее лечение (гиалуронидазу), препараты для облегчения нейрональной передачи (неостигмин).
Длительно протекающий корешковый синдром с хронической болью является показанием к назначению антидепрессантов (дулоксетина, амитриптилина, дезипрамина), а при сочетании боли с нейротрофическими расстройствами — к применению ганглиоблокаторов (бензогексония, ганглефена). При мышечных атрофиях применяют нандролона деканоат с витамином Е. Хороший эффект (при отсутствии противопоказаний) оказывает тракционная терапия , увеличивающая межпозвонковые расстояния и тем самым уменьшающая негативное воздействие на спинальный корешок. В остром периоде дополнительным средством купирования боли может выступать рефлексотерапия , УВЧ , ультрафонофорез гидрокортизона. В ранние сроки начинают применять ЛФК , в период реабилитации — массаж , парафинотерапию , озокеритолечение , лечебные сульфидные и радоновые ванны , грязелечение .
Вопрос о хирургическом лечении возникает при неэффективности консервативной терапии, прогрессировании симптомов выпадения, наличии спинальной опухоли. Операция проводится нейрохирургом и имеет целью устранение компрессии корешка, а также удаление ее причины. При грыжах межпозвонковых дисков возможна дискэктомия , микродискэктомия , при опухолях — их удаление. Если причиной корешкового синдрома является нестабильность, то производится фиксация позвоночника .
Повторная (рецидивная, рубцовая) фиксация спинного мозга
Клинические проявления СФСМ, выявляемые после операции, направленной на устранение фиксации спинного мозга, связывают с его повторной фиксацией ( Inoue H.K., 1994; Colak A., 1998; Ohe N., 2000; Blount J.P., 2007; Al-Holou W.N., 2009; Yong R.L., 2011; Caldarelli M., 2013). По данным литературы, клиническая и нейровизуализационная (МРТ) картина рецидива фиксации спинного мозга может развиваться у 5-50% оперированных больных, при этом повторная операция может потребоваться 30% из них (Herman J.M., 1993; Filler A.G., 1995; Archibeck M.J., 1997; Kang J.K., 2003; Morimoto K., 2005; Ogiwara H., 2011).
Основной причиной развития повторной фиксации считается локальное нарушение циркуляции спинномозговой жидкости (Kang J.K., 2003). Это косвенно подтверждается высокой частотой рецидива фиксации после устранения спинномозговой грыжи и липомиелоцеле и относительной низкой при других аномалиях (Caldarelli M., 2013). По всей видимости, размеры и форма спинного мозга (невральной плакоды), остаточным объемом опухолевой (жировой) ткани, а также сужение позвоночного канала в передне-заднем направлении не всегда позволяют произвести восстановление оболочек спинного мозга с формированием достаточного объема субарахноидальных пространств для адекватной циркуляции ликвора в терминальной цистерне (Hudgins R.J., 2004), в результате чего спинной мозг срастается с оболочками, а иногда и с рубцово измененными мягкими тканями, распространяясь за пределы дурального мешка и даже позвоночного канала (Caldarelli M., 1995).
Рецидив фиксации спинного мозга является второй по частоте встречаемости причиной ухудшения состояния больных с миеломенингоцеле, при этом в период наблюдения до 5 лет наблюдается прогрессирующее ухудшение состояния 60% из них (Phuong L.K., 2002; Talamonti G., 2007). Отмечено, что при неполном устранении фиксации частота рецидивов может достигать 80% (Huttmann S., 2001), при этом в 10% случаев может потребоваться три и более операции для стабилизации состояния больных (Al-Holou W.N., 2009; Maher C.O., 2007, 2009). Согласно результатам исследований, увеличение выявляемости рецидива СФСМ приходится на возраст от 2 до 4 и от 8 до 11 лет вне зависимости от первичной патологии (Herman J.M., 1993; Caldarelli M., 1995).
Учитывая, что хирургическое вмешательство на начальных этапах патологического процесса, по данным различных авторов, приводит к улучшению результатов лечения, в качестве показаний к операции было предложено рассматривать прогрессирующее ухудшение состояния ребенка или появление новых симптомов. (Bowman R.M., 2001; George T.M., 2005). Наряду с этим, принятие решения о хирургическом лечении крайне затруднительно у хронически «симптоматических» больных со стойким неврологическим дефицитом. При этом делается акцент на необходимость исключения других причин ухудшения состояния больного, таких как дисфункция шунта, мальформация Киари, сирингомиелия и др. (Bowman R.M., 2001; Talamonti G., 2007). Подчеркивается, что рецидив СФСМ может протекать со стертой, медленно прогрессирующей симптоматикой, что также осложняет распознание патологического процесса и является причиной его поздней диагностики. Сообщается, что наиболее частым клиническим проявлением в старшем возрасте является прогрессирующая деформация позвоночника (Carstens C., 1996). Однако, другими признаками справедливо считать контрактуры нижних конечностей, ухудшение походки, боли в спине (Herman J.M., 1993; Bowman R.M., 2009). Таким образом, клиническая картина рецидива СФСМ во многом сходна с таковой при первичном СФСМ. При этом дебют заболевания чаще связан с болевым синдромом, а ухудшение состояния с прогрессирующей деформацией позвоночника (Caldarelli M., 1995).
Хирургическое лечение повторной фиксации спинного мозга направлено на устранение натяжения и деформации спинного мозга и корешков, а также на восстановление ликворообращения в зоне фиксации.
Устранение рубцовой фиксации спинного мозга
Площадь рубцовых сращений при повторной фиксации может зависеть от способа закрытия раны при первичном вмешательстве (Caldarelli M., 2013). В случае, когда при первичной операции проводилась реконструкция нервной трубки, рубец, как правило, расположен в срединной плоскости на ограниченной площади (Caldarelli M., 2013).
Таким образом, основной мерой профилактики повторной фиксации спинного мозга при хирургической коррекции ММЦ и спинальных липом считается реконструкция нервной плакоды (Pang D., 2010; Talamonti G., 2007). Применяется также расширяющая пластика твердой мозговой оболочки различными искусственными заменителями (Inoue H.K., 1994; Ohe N., 2000). Кроме этого, после операции рекомендуют постельный режим в положении лежа на животе с целью избежать гравитационного контакта спинного мозга с твердой мозговой оболочкой.
Травма позвоночника и спинного мозга
Хотя способы диагностики и оказания помощи при повреждениях позвоночника и спинного мозга приводились еще в египетских папирусах и трудах Гиппократа, в течение длительного времени травма позвоночника с неврологическими нарушениями считалась практически смертным приговором. Еще в Первую мировую войну 80% раненных в позвоночник умирали в течение первых 2 нед. Прогресс в лечении спинно-мозговой травмы (СМТ), основанный на улучшении понимания ее патогенеза и разработке кардинально новых способов лечения, наметился лишь в ходе Второй мировой войны и в послевоенные годы. Сегодня СМТ остается тяжелым, но обычно не фатальным видом травмы, причем существенный вклад в минимизацию ее последствий вносит своевременное и адекватное оказание первой, квалифицированной и специализированной медицинской помощи пострадавшим.
Травматические повреждения позвоночника и спинного мозга встречаются существенно реже, чем ЧМТ. У взрослых частота СМТ составляет 5 на 100 тыс. населения в год, у детей она еще ниже (менее 1 на 100 тыс. населения в год), но у детей СМТ чаще ассоциирована с политравмой и протекает тяжелее, с худшим прогнозом. В России примерно 80% пострадавших составляют мужчины в возрасте до 30 лет. Поскольку сегодня большинство пострадавших даже с тяжелой СМТ выживают, число лиц с последствиями СМТ в популяции развитых стран составляет примерно 90 на 100 тыс. населения (для России сегодня — это примерно 130 тыс. человек, из них 13 тыс. — с параплегией или тетраплегией). Социальную значимость проблемы трудно переоценить.
Основная причина СМТ — дорожно-транспортные происшествия (50% случаев). Далее следуют травмы спортивные и связанные с активным отдыхом (25%, из них 2/3 — это повреждения шейного отдела позвоночника и спинного мозга, полученные при нырянии в мелком месте). Примерно по 10% составляют травмы производственные и полученные в результате противоправных действий, и 5% — полученные при падении с высоты, в природных катаклизмах и т. д.
Чаще всего повреждается шейный отдел позвоночника (55%), реже — грудной (30%), еще реже — пояснично-крестцовый (15%).
Повреждение спинного мозга и его корешков встречается примерно в 20% случаев СМТ. Такие травмы называют осложненными.
Уровень повреждения (поражения) спинного мозга оценивают по нижнему сегменту, в дерматоме которого сохранилась чувствительность и хотя бы минимальные произвольные движения. Часто, но не всегда, этот уровень соответствует установленному уровню повреждения позвоночника. Не следует в оценке уровня повреждения спинного мозга ориентироваться на патологические рефлексы (Бабинского, Россолимо, Оппенгейма, защитные и синкинезии), их рефлекторная дуга может проходить ниже уровня полного повреждения спинного мозга.
Выделяют полное и неполное повреждение спинного мозга. При полном повреждении (группа А по шкале Frankel) отсутствуют чувствительность и произвольные движения ниже уровня поражения. Обычно в такой ситуации спинной мозг бывает анатомически разрушен. При неполном повреждении (группы B, C, D по шкале Frankel) нарушения чувствительности и движений выражены в большей или меньшей степени; группа E соответствует норме.
Повреждения позвоночника и спинного мозга подразделяются на открытые, при которых нарушается целостность кожного покрова и подлежащих мягких тканей, и закрытые, при которых эти повреждения отсутствуют. В мирное время преобладает закрытая СМТ.
Таблица Шкала оценки нарушения функций спинного мозга (Frankel)
Закрытые повреждения позвоночника и спинного мозга
| Полное поражение | А | Нет произвольных движений и чувствительности ниже уровня поражения |
| Сохранна только чувствительность | B | Ниже уровня поражения нет произвольных движений, сохранна чувствительность |
| Движения сохранны, но нефункциональны | C | Ниже уровня поражения есть произвольные движения, но без полезной функции. Чувствительность может быть как сохранна, так и нет |
| Движения сохранны, функциональны | D | Функциональны полезные произвольные движения ниже уровня поражения. Различные расстройства чувствительности |
| Нормальная двигательная функция | E | Движения и чувствительность ниже уровня поражения сохранны, возможны патологические рефлексы |
Повреждения позвоночника. Закрытые повреждения позвоночника возникают под влиянием чрезмерного сгибания, разгибания, вращения и сдавления по оси. Во многих случаях наблюдается сочетание этих механизмов (например, при так называемой хлыстовой травме шейного отдела позвоночника, когда вслед за сгибанием позвоночника возникает его разгибание).
В результате воздействия этих механических сил возможны разнообразные изменения в позвоночнике:
• растяжение и разрыв связок;
• повреждение межпозвонковых дисков;
• подвывихи и вывихи позвонков;
• переломы позвонков;
• переломовывихи.
Различают следующие виды переломов позвонков:
• переломы тел позвонков (компрессионные, оскольчатые, взрывные) ;
• переломы заднего полукольца;
• комбинированные с одновременным переломом тел, дужек, суставных и поперечных отростков;
• изолированные переломы поперечных и остистых отростков.
Принципиальное значение имеет отнесение повреждения позвоночника к стабильному или нестабильному. Под стабильностью позвоночника понимают способность его структур ограничивать их взаимное смещение, чтобы оно при физиологических нагрузках не приводило к повреждению или раздражению спинного мозга и его корешков. Нестабильные повреждения позвоночника обычно связаны с разрывом связок, фиброзного кольца, множественным разрушением костных структур и чреваты дополнительной травматизацией спинного мозга даже при незначительных движениях в пораженном сегменте.
Проще понять причины возникновения нестабильности позвоночника, если обратиться к концепции Дениса, выделяющего 3 опорные системы (столба) позвоночника: передний опорный комплекс (столб) включает в себя переднюю продольную связку и передний сегмент тела позвонка; средний столб объединяет заднюю продольную связку и задний сегмент тела позвонка; задний столб — суставные отростки, дужки с желтыми связками и остистые отростки с их связочным аппаратом. Нарушение целостности двух из упомянутых опорных комплексов (столбов), как правило, приводит к нестабильности позвоночника.
Повреждения спинного мозга.Схема Дениса: выделены передний, средний и задний опорные комплексы (столбы) позвоночника; нестабильность позвоночного сегмента развивается при поражении двух из них в любом сочетании
По виду травмы спинного мозга выделяют его сотрясение, ушиб, сдавление и нарушение анатомической целостности (частичный или полный разрыв спинного мозга) ; часто эти механизмы сочетаются (например, ушиб с разрывом сосудов и кровоизлиянием — гематомиелией, вызывающей непосредственное повреждение аксонов и клеток спинного мозга). Наиболее тяжелой формой локального поражения спинного мозга является его полный анатомический перерыв с диастазом концов в месте повреждения.
Основное значение для судьбы больного имеет степень повреждения спинного мозга и его корешков. Это повреждение может происходить как в момент травмы (что неизлечимо), так и в последующем периоде, когда профилактика вторичных повреждений спинного мозга потенциально возможна.
На сегодня не существует способов восстановления функции анатомически поврежденных нейронов и клеток спинного мозга. Задача лечения СМТ — минимизация вторичных повреждений спинного мозга и обеспечение оптимальных условий для восстановления нейронов и аксонов, оказавшихся в зоне нарушения кровоснабжения — «ишемической полутени».
Частым и опасным следствием травмы спинного мозга является отек, обусловленный как повышением тканевого осмотического давления при разрушении клеточных мембран, так и нарушениями венозного оттока из-за сдавления спинно-мозговых вен (гематомами, костными отломками и т. д. ) и их тромбоза. Увеличение объема спинного мозга в результате отека приводит к нарастанию локальной гипертензии и снижению перфузионного давления, что по принципу порочного круга ведет к дальнейшему нарастанию отека, ишемии и может привести к необратимому поражению всего поперечника спинного мозга.
Клиническая картина повреждения позвоночника.Помимо перечисленных морфологических изменений возможны и функциональные нарушения, обусловленные нарушениями на клеточном уровне. Такие нарушения функции спинного мозга регрессируют, как правило, в течение первых 24 ч после травмы.
Основное проявление перелома позвоночника — локальная болезненность, значительно усиливающаяся при нагрузке (вставании, наклонах и даже поворотах в постели). На повреждение позвоночника могут также указывать:
• ссадины и гематомы;
• отек и локальная болезненность мягких тканей в паравертебральной области;
• болезненность при пальпации остистых отростков;
• разное расстояние между вершинами остистых отростков, смещение одного или нескольких из них кпереди, кзади или в сторону от средней линии;
• угловое изменение оси позвоночника (травматический сколиоз, кифоз или лордоз).
При переломе нижнегрудного и поясничного отделов позвоночника даже без повреждения спинного мозга может развиваться парез кишечника, обусловленный забрюшинной гематомой (сдавливающей сосуды и нервы брыжейки).
Клиническая картина поражения спинного мозга при травме позвоночника
Клиническая симптоматика осложненного перелома позвоночника определяется рядом причин, в первую очередь — уровнем и степенью поражения спинного мозга.
Различают синдромы полного и частичного поперечного поражения спинного мозга.
При синдроме полного поперечного поражения спинного мозга книзу от уровня поражения отсутствуют все произвольные движения, наблюдается вялый паралич, глубокие и кожные рефлексы не вызываются, отсутствуют все виды чувствительности, утрачивается контроль над функциями тазовых органов (непроизвольное мочеиспускание, нарушение дефекации, приапизм) ; страдает вегетативная иннервация (нарушаются потоотделение, температурная регуляция). Со временем вялый паралич мышц может смениться их спастичностью, гиперрефлексией, часто формируются автоматизмы функций тазовых органов.
Повреждение шейного утолщения спинного мозга (CV-ThI на уровне V-VII шейных позвонков) приводит к периферическому парапарезу верхних конечностей и спастической параплегии нижних. Возникают проводниковые расстройства всех видов чувствительности ниже уровня поражения. Возможны боли корешкового характера в руках. Поражение цилиоспинального центра вызывает появление симптома Горнера, снижение артериального давления, замедление пульса.Особенности клинических проявлений травмы спинного мозга зависят от уровня поражения. При повреждении верхнешейной части спинного мозга (CI-IV на уровне I-IV шейных позвонков) развивается тетрапарез или тетраплегия спастического характера с утратой всех видов чувствительности с соответствующего уровня. Если имеется сопутствующее повреждение ствола мозга, появляются бульбарные расстройства (дисфагия, афония, дыхательные и сердечно-сосудистые нарушения).
Травма грудной части спинного мозга (ThII-XII на уровне I-IX грудных позвонков) приводит к нижней спастической параплегии с отсутствием всех видов чувствительности, выпадению брюшных рефлексов: верхнего (ThVII-VIII), среднего (ThIX-X) и нижнего (ThXI-XII).
При повреждении поясничного утолщения (LI SII на уровне Х-XII грудных и I поясничного позвонков) возникают периферический паралич нижних конечностей, анестезия промежности и ног книзу от паховой (пупартовой) связки, выпадает кремастерный рефлекс.
При травме конуса спинного мозга (SIII-V на уровне I-II поясничных позвонков) имеется «седловидная» анестезия в области промежности.
Повреждение конского хвоста характеризуется периферическим параличом нижних конечностей, анестезией всех видов в области промежности и ног, резкими корешковыми болями в них.
При поражении конуса спинного мозга и корешков конского хвоста страдает сегментарный аппарат спинного мозга и развивается синдром «гипорефлекторного нейрогенного мочевого пузыря»: характерна задержка мочеиспускания с явлениями парадоксаль-Повреждения спинного мозга на всех уровнях сопровождаются расстройством мочеиспускания, дефекации и половой функции. При поперечном поражении спинного мозга в шейной и грудной частях появляются нарушения функции тазовых органов по типу синдрома «гиперрефлекторного нейрогенного мочевого пузыря». В первое время после травмы возникает задержка мочеиспускания, которая может наблюдаться очень долго (месяцы). Чувствительность мочевого пузыря утрачивается. Затем по мере растормаживания сегментарного аппарата спинного мозга задержка мочи сменяется спинальным автоматизмом мочеиспускания. При этом непроизвольное мочеиспускание наступает при незначительном накоплении мочи в мочевом пузыре.
ной ишурии — мочевой пузырь переполнен, но когда давление в нем начинает превышать сопротивление сфинктеров, часть мочи пассивно вытекает, что создает иллюзию сохранности функции мочеиспускания.
Расстройства дефекации в виде задержки стула или недержания кала развиваются обычно параллельно с нарушением мочеиспускания.
Поражению спинного мозга в любых частях сопутствуют пролежни, возникающие в областях с нарушенной иннервацией, где под мягкими тканями находятся костные выступы (крестец, гребни подвздошных костей, пятки). Особенно рано и быстро развиваются пролежни при грубом (поперечном) повреждении спинного мозга на уровне шейного и грудного отделов. Пролежни быстро инфицируются и становятся причиной развития сепсиса.
При определении уровня поражения спинного мозга надо учитывать взаиморасположение позвонков и спинно-мозговых сегментов. Проще сопоставлять расположение сегментов спинного мозга с остистыми отростками позвонков (за исключением нижнего грудного отдела). Для определения сегмента к номеру позвонка надо прибавить 2 (так, на уровне остистого отростка III грудного позвонка будет располагаться V грудной сегмент).
Выделяют несколько синдромов частичного поражения спинного мозга.Эта закономерность исчезает в нижнегрудном и верхнепоясничном отделах, где на уровне ThXI-XII и LI располагаются 11 сегментов спинного мозга (5 поясничных, 5 крестцовых и 1 копчиковый).
Синдром половинного поражения спинного мозга (синдром БроунСекара) — паралич конечностей и нарушение глубоких видов чувствительности на стороне поражения с выпадением болевой и температурной чувствительности на противоположной стороне. Следует подчеркнуть, что этот синдром в «чистом» виде встречается редко, обычно выявляются его отдельные элементы.
Передний спинно-мозговой синдром — двусторонняя параплегия (или парапарез) в сочетании со снижением болевой и температурной чувствительности. Причина развития этого синдрома — нарушение кровотока в передней спинальной артерии, которая травмируется костным осколком или выпавшим диском.
Центральный синдром спинного мозга (чаще возникает при резком переразгибании позвоночника) характеризуется преимущественно парезом рук, в ногах слабость менее выражена; отмечаются разной степени выраженности нарушения чувствительности ниже уровня поражения, задержка мочеиспускания.
В отдельных случаях, преимущественно при травме, сопровождающейся резким сгибанием позвоночника, может развиться синдром поражения задних канатиков спинного мозга — выпадение глубоких видов чувствительности.
Для повреждения спинного мозга (особенно при полном поражении его поперечника) характерны нарушения регуляции функций различных внутренних органов: расстройства дыхания при шейном поражении, парез кишечника, нарушение функции тазовых органов, трофические расстройства с быстрым развитием пролежней.
В острой стадии травмы возможно развитие «спинального шока» — снижение артериального давления (обычно — не ниже 80 мм рт. ст. ) при отсутствии признаков политравмы и внутреннего или наружного кровотечения. Патогенез спинального шока объясняется потерей симпатической иннервации ниже места повреждения при сохранении парасимпатической (вызывает брадикардию) и атонией скелетных мышц ниже уровня повреждения (вызывает депонирование крови в венозном русле со снижением объема циркулирующей крови).
Сотрясение спинного мозга встречается очень редко. Характеризуется поражением спинного мозга функционального типа при отсутствии явных структурных повреждений. Чаще наблюдаются парестезии, нарушения чувствительности ниже зоны травмы, реже — парезы и параличи, расстройства функции тазовых органов. Изредка клинические проявления бывают грубо выраженными, вплоть до картины полного повреждения спинного мозга; дифференциально-диагностическим критерием является полный регресс симптоматики в течение суток.Клинические формы повреждения спинного мозга
Цереброспинальная жидкость при сотрясении спинного мозга не изменена, проходимость субарахноидального пространства не нарушена. Изменения в спинном мозгу при МРТ не выявляются.
Ушиб спинного мозга — наиболее частый вид поражения при закрытых и непроникающих травмах спинного мозга. Ушиб возникает при переломе позвонка с его смещением, пролапсе межпозвонкового диска, подвывихе позвонка. При ушибе спинного мозга всегда происходят структурные изменения в веществе мозга, корешках, оболочках, сосудах (очаговый некроз, размягчение, кровоизлияния).
Характер двигательных и чувствительных расстройств определяется локализацией и обширностью травмы. Вследствие ушиба спинного мозга развиваются параличи, изменения чувствительности, нарушения функции тазовых органов, вегетативные расстройства. Травма нередко приводит к возникновению не одного, а нескольких очагов ушиба. Вторичные нарушения спинального кровообращения могут обусловить развитие очагов размягчения спинного мозга через несколько часов или даже дней после травмы.
Ушибы спинного мозга часто сопровождаются субарахноидальным кровоизлиянием. В цереброспинальной жидкости при этом обнаруживается примесь крови. Проходимость субарахноидального пространства обычно не нарушается.
Сдавление спинного мозга возникает при переломе позвонков со смещением осколков или при вывихе, грыже межпозвонкового диска. Клиническая картина компрессии спинного мозга может сложиться сразу после травмы либо быть динамической (нарастающей при движениях позвоночника) при его нестабильности. Как и в остальных случаях СМТ, симптоматика определяется уровнем поражения, а также выраженностью компрессии.В зависимости от тяжести ушиба восстановление нарушенных функций происходит в течение 3-8 нед. Однако при тяжелых ушибах, захватывающих весь поперечник спинного мозга, утраченные функции могут не восстанавливаться.
Выделяют острое и хроническое сдавление спинного мозга. Последний механизм имеет место при сохранении в посттравматическом периоде компримирующего агента (костный фрагмент, выпавший диск, обызвествленная эпидуральная гематома и т. д. ). В ряде случаев при умеренной компрессии по миновании острого периода СМТ возможен значительный или полный регресс симптомов, но появление их вновь в отдаленном периоде вследствие хронической травматизации спинного мозга и развития очага миелопатии.
Выделяют так называемую гиперэкстензионную травму шейного отдела позвоночника (хлыстовая травма), возникающую при автомобильных катастрофах (удар сзади при неправильно установленных подголовниках или их отсутствии), нырянии, падении с высоты. Механизм этой травмы спинного мозга заключается в резком переразгибании шеи, превышающей анатомо-функциональные возможности этого отдела и приводящей к резкому сужению позвоночного канала с развитием кратковременного сдавления спинного мозга. Формирующийся при этом морфологический очаг сходен с таковым при ушибе. Клинически гиперэкстензионная травма проявляется различными по тяжести синдромами поражения спинного мозга — корешковым, частичным нарушением функции спинного мозга, полным поперечным его поражением, синдромом передней спинальной артерии.
Гематомиелия, если не сочетается с другими формами структурного повреждения спинного мозга, характеризуется благоприятным прогнозом. Неврологическая симптоматика начинает регрессировать через 7-10 дней. Восстановление нарушенных функций может быть полным, однако чаще остаются те или иные неврологические расстройства.Кровоизлияние в спинной мозг. Наиболее часто кровоизлияние происходит при разрыве сосудов в области центрального канала и задних рогов на уровне поясничного и шейного утолщений. Клинические проявления гематомиелии обусловлены сдавлением задних рогов спинного мозга излившейся кровью, распространяющейся на 3-4 сегмента. В соответствии с этим остро возникают сегментарные диссоциированные нарушения чувствительности (температурной и болевой), располагающиеся на теле в виде куртки или полукуртки. При распространении крови на область передних рогов выявляются периферические вялые парезы с атрофиями, при поражении боковых рогов — вегетативно-трофические расстройства. Очень часто в остром периоде наблюдаются не только сегментарные нарушения, но и проводниковые расстройства чувствительности, пирамидные симптомы вследствие давления на боковые канатики спинного мозга. При обширных кровоизлияниях развивается картина полного поперечного поражения спинного мозга. Цереброспинальная жидкость может содержать примесь крови.
Кровоизлияние в пространства, окружающие спинной мозг, может быть как эпидуральным, так и субарахноидальным.
Эпидуральная спинальная гематома в отличие от внутричерепной возникает обычно в результате венозного кровотечения (из окружающих ТМО венозных сплетений). Даже если источником кровотечения является артерия, проходящая в надкостнице или кости, диаметр ее невелик и кровотечение быстро останавливается. Соответственно спинальные эпидуральные гематомы редко достигают больших размеров и не вызывают грубой компрессии спинного мозга. Исключением являются гематомы, обусловленные повреждением позвоночной артерии при переломе шейного отдела позвоночника; такие пострадавшие обычно погибают от нарушений кровообращения в стволе мозга. В целом эпидуральные спинальные гематомы встречаются редко.
Клинические проявления. Для эпидуральных гематом характерен бессимптомный промежуток. Затем, через несколько часов после травмы, появляются корешковые боли с различной иррадиацией в зависимости от локализации гематомы. Позже развиваются и начинают нарастать симптомы поперечного сдавления спинного мозга.Источником субдуральной спинальной гематомы могут быть как сосуды ТМО и спинного мозга, так и эпидуральные сосуды, расположенные в месте травматического повреждения ТМО. Субдуральные спинальные гематомы встречаются также редко, обычно кровотечения внутри дурального мешка не отграничиваются и называются спинальными субарахноидальными кровоизлияниями.
Для клинической картины подоболочечного (субарахноидального) кровоизлияния при травме спинного мозга характерно острое или постепенное развитие симптомов раздражения оболочек и спинно-мозговых корешков, в том числе расположенных выше места травмы. Появляются интенсивные боли в спине, конечностях, ригидность шейных мышц, симптомы Кернига и Брудзинского. Очень часто к ним присоединяются парезы конечностей, проводниковые нарушения чувствительности и тазовые расстройства вследствие поражения или сдавления спинного мозга излившейся кровью. Диагноз гематоррахиса верифицируется при люмбальной пункции: цереброспинальная жидкость интенсивно окрашена кровью или ксантохромна. Течение гематоррахиса — регрессирующее, часто наступает полное выздоровление. Однако кровоизлияние в область конского хвоста может осложниться развитием спаечного процесса с тяжелыми неврологическими нарушениями.
Анатомическое повреждение спинного мозга происходит в момент травмы или при вторичной травматизации спинного мозга ранящим предметом, костными отломками, или при его перерастяжении и разрыве. Это самый тяжелый вид СМТ, поскольку восстановления анатомически поврежденных структур спинного мозга никогда не происходит. Изредка анатомическое повреждение бывает частичным, при этом развивается синдром Броун-Секара или другой из описанных выше, но чаще такое повреждение бывает полным. Симптоматика определяется характером и уровнем поражения.
Консультация врача-нейрохирурга
врач-нейрохирург, ведущий научный сотрудник отделения нейрохирургии детского возраста, к.м.н. Сысоев Кирилл Владимирович
автор ФЕДЕРАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ПО ЛЕЧЕНИЮ СПИНА БИФИДА И СФСМ У ДЕТЕЙ, утвержденных решением XXXX пленума Правления Ассоциации нейрохирургов России, г. Санкт- Петербург, 16.04.2015 г.
КОНТАКТЫ: e-mail
ОТЗЫВЫ НА САЙТАХ:https://prodoctorov.ru/spb/vrach/144441-sysoev/ https://spb.napopravku.ru/doctor-profile/sysoev-kirill-vladimirovich/
Сайт носит информационный характер, не является сайтом медицинской организации, не является публичной офертой, определяемой положениями статьи 437 (п.2) ГК РФ. Взаимодействие с врачом-специалистом регламентируется правилами клиники, в которой он работает.
Подъязычный нерв (XII) — Передняя ветвь
1.
ПОДЪЯЗЫЧНЫЙ НЕРВ (XII)
, n. hypoglossus . Двенадцатый черепной нерв. Выходит из мозга многочисленными корешками между пирамидой и оливой, проходит через одноименный канал и спускается между внутренней яремной веной и внутренней сонной артерией. Над задним краем m.mylohyoideus вступает в мышцы языка. Рис. Б.
2.
Язычные ветви
, rami linguales. Отходят от ствола подъязычного нерва и иннервируют шилоподъязычную, подъязычно-язычную и подбородочно-язычную мышцы, а также мышцы, лежащие внутри языка. Рис. Б.
3.
Корешковые нити
, fila radicularia. Выходят из спинного мозга и соединяются в пучки, которые формируют передний и задний корешки cпинномозгового нерва. Рис. А.
5.
Передний корешок (двигательный)
, radix аntеriоr (motoria). Содержит аксоны нейронов переднего и латерального столбов серого вещества спинного мозга. Рис. А.
6.
Спинномозговой (чувствительный) узел
, ganglion spinale (sensorium) . Расположен в межпозвоночном отверстии в составе заднего корешка вблизи места соединения с radix аntеriоr. Состоит из псевдоуниполярных нейронов. Рис. А.
8.
Ствол спинномозгового нерва
, truncus nervi spinalis. Начинается от места соединения переднего и заднего корешков и продолжается до уровня отхождения первой ветви. Рис. А, Рис. В.
9.
Передняя ветвь
, ramus anterior. Самая крупная ветвь спинномозгового нерва. Соединяясь с передними ветвями соседних спинномозговых нервов формирует сплетения. Передние ветви грудных нервов носят название межреберных нервов. Рис. А.
От редакции : Причины и диагностика свиста в ушах
10.
, ramus posterior. Меньшая, по сравнению с передней, ветвь спинномозгового нерва, которая иннервирует кожу и аутохтонные мышцы спины. Рис. А.
11.
Менингеальная ветвь
, ramus meningeus. Содержит чувствительные и симпатические волокна. Проходит спереди спинномозгового нерва, через межпозвоночное отверстие вступает в позвоночный канал и вместе с другими менингеальными ветвями образует сплетение, которое иннервирует оболочки спинного мозга. Рис. А.
13.
Конский хвост
, cauda equina. Формируется корешками каудальных спинномозговых нервов, (начиная с 1-, 2-го поясничных) и терминальной нитью. Рис. В.
14.
Медиальная ветвь
, ramus medialis. Каждая из них начинается от задней ветви соответствующего спинномозгового нерва. Содержит двигательные и чувствительные волокна. Рис. А.
17.
Подзатылочный нерв
, n. suboccipitalis. Задняя ветвь 1- го шейного спинномозгового нерва. Проходит между позвоночной атерией и задней дугой атланта, иннервирует короткие подзатылочные мышцы. Рис. Г.
19.
Большой затылочный нерв
, n. occipitalis major. Задняя ветвь 2- го шейного спинномозгового нерва. Сначала проходит между осевым позвонком и нижней косой мышцей головы, затем прободает трапециевидную мышцу и направляется к полуостистой мышце головы и коже затылка. Рис. Г.
20.
Третий затылочный нерв
, n. occipitalis tertius. Задняя ветвь 3- го шейного спинномозгового нерва. Иннервирует кожу задней области шеи вблизи средней линии. Рис. Г.
21.
ШЕЙНОЕ СПЛЕТЕНИЕ
, plexus cervicalis. Формируется передними ветвями первых четырех шейных спинномозговых нервов (С 1 — 4).Иннервирует кожу и мышцы шеи.
23.
Шейная (подъязычная) петля
, ansa cervicalis (hypoglossi). В ее состав входят волокна из подъязычного нерва и первых трех шейных спинномозговых нервов. Иннервирует поподъязычные мышцы. Рис. Б.
24.
Передний корешок
, radix аnterior. Отходит от подъязычного нерва и содержит эфферентные волокна первого — третьего сегментов спинного мозга. Рис. Б.
25.
Малый затылочный нерв
, n. occipitalis minor. Самая верхняя кожная ветвь. Поднимается вдоль заднего края грудино-ключично-сосцевидной мышцы к коже затылка, латеральнее n.occipitalis mayor. Рис. Г.
28.
Большой ушной нерв
, n. auricularis magnus. Пересекает вертикально середину грудино-ключично-сосцевидной мышцы и направляется к ушной раковине. Рис. Г.
29.
Передняя ветвь
, ramus anterior. Иннервирует кожу над околоушной железой между передней поверхностью ушной раковины и углом нижней челюсти. Рис. Г.