Миртазапин
Миртазапин – тетрациклический антидепрессант, который применяется при депрессии, тревожности, бессоннице, снижении аппетита, болевых синдромах.
Для чего используется этот анализ?
- Для мониторинга концентрации препарата в крови.
Когда назначается анализ?
- При терапии миртазапином (особенно если нарушена функция печени и почек).
Синонимы русские
«Ремерон», «Миртазонал», «Мирзатен», «Аванза», «Зиспин».
Синонимы английские
Mirtazapine («Remeron», «Mirtazonal», «Mirzaten», «Avanza», «Zispin»).
Метод исследования
Поляризационный флуороиммуноанализ (ПФИА).
Единицы измерения
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до анализа, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до анализа.
Общая информация об исследовании
Согласно научным гипотезам, депрессивные расстройства наступают при дефиците норадреналина и/или серотонина в некоторых структурах головного мозга. В целях лечения данных патологий применяются препараты, стабилизирующие настроение, – тимолептики.
Миртазапин – это антидепрессант, который может применяться в качестве успокоительного, снотворного, стимулирующего аппетит, противорвотного и антигистаминного средства. Препарат классифицируется как центральный агонист альфа-2-адренорецепторов, однако известно его влияние и на серотониновые, дофаминовые, гистаминовые и некоторые другие рецепторы. В основном он применяется в лечении депрессий, но он также эффективен и при тревожных расстройствах, обсессивно-компульсивных нарушениях, панических атаках, посттравматических стрессовых расстройствах, анорексии, бессоннице, головной боли и мигрени.
Миртазапин быстро всасывается (биодоступность составляет около 50 %), достигая максимальной концентрации в плазме крови примерно через 2 часа. До 85 % препарата связывается с белками плазмы. При использовании 15-45 мг миртазапина в день стабильная концентрация вещества в плазме достигается к пятому дню регулярного приема. В терапевтических дозах показатели метаболизма миртазапина имеют линейную зависимость от введенного количества препарата. Средний период его полувыведения составляет 20-40 часов. Иногда, особенно у лиц пожилого возраста, отмечается и более длительный период полувыведения (до 65 ч.), а у молодых – более короткий. Длительный период полувыведения миртазапина позволяет принимать препарат 1 раз в сутки (на ночь). Основными путями его метаболизма являются деметилирование и окисление с последующей конъюгацией. Некоторые метаболиты миртазапина фармакологически активны и оказывает такое же фармакологическое действие, как и исходное вещество. Полностью препарат выводится примерно через 4 дня после прекращения приема, причем 85 % экскретируется с мочой, а 15 % – через желудочно-кишечный тракт. Около 4 % препарата может выделяться с мочой в неизмененном виде.
Миртазапин оказывает сравнительное быстрое наступление антидепрессивного эффекта, незначительное седативное действие, уменьшает тревожность, улучшает память и показатели внимания, имеет снотворный эффект, стимулирует аппетит. Он может применяться не только при депрессиях, но и при абстинентных синдромах в наркологии, для уменьшения болевого синдрома в онкологии, для коррекции нарушений настроения при психосоматических расстройствах. Препарат хорошо переносится у пациентов с соматическими (сердечно-сосудистыми, онкологическими, иммунодефицитными) и неврологическими (эпилепсия, болезнь Альцгеймера) заболеваниями. Миртазапин обладает выраженным противоболевым действием при лечении депрессии с алгическим компонентом, мигрени и хронической головной боли напряжения и может быть использован в комплексной терапии у пациентов с хронической скелетно-мышечной болью.
Побочными эффектами от приема миртазапина могут быть сонливость, сухость во рту, увеличение массы тела, повышение аппетита, запоры, головокружение и повышенная утомляемость. В очень редких случаях возможны аллергические реакции, обмороки, миелодисплазия и агранулоцитоз. Не исключено возникновение суицидальных мыслей. Зарегистрированы единичные случаи передозировки препарата в сочетании с другими лекарствами, которые закончились летальным исходом. Лечение миртазапином, как и другими антидепрессантами, должно осуществляться под строгим наблюдением врача.
Определение концентрации миртазапина в крови не является обязательным при использовании препарата, однако позволяет контролировать терапевтически эффективную в каждом конкретном случае дозу лекарства, степень его взаимодействия с другими одновременно принимаемыми препаратами.
Для чего используется исследование?
- Мониторинг концентрации препарата в крови;
- оптимизация контроля за лечением с помощью коррекции дозы;
- оценка лекарственного взаимодействия нескольких перпаратов;
- диагностика передозировки;
- выявление нарушений режима приема препарата.
Когда назначается исследование?
- При монотерапии миртазапином или в комбинации с другими препаратами (в том числе связанными с сопутствующими заболеваниями и состояниями);
- при наблюдении за пациентами с нарушением функции печени и почек, принимающими миртазапин;
- при недостаточной эффективности применяемого препарата и решении вопроса о коррекции дозы;
- при подозрении на несоблюдение пациентом режима приема препарата;
- при подозрении на передозировку миртазапина (заторможенность, дезориентация, сонливость, галлюцинации, тахикардия, гипо- или гипертензия).
Что означают результаты?
Референсные значения: 5 — 100 нг/мл.
Результаты исследования анализируются лечащим врачом с учетом дозы миртазапина, режима его приема, возраста и пола пациента, клиники заболевания, сопутствующей патологии и наличия или отсутствия нежелательных явлений.
Что может влиять на результат?
- Уровень миртазапина в крови снижают карбамазепин, фенитоин, рифампицин.
- Повышают уровень миртазапина ингибиторы ВИЧ-протеазы, азольные противогрибковые средства, эритромицин, циметидин и нефазодон.
- При печеночной и/или почечной недостаточности концентрация препарата в крови увеличивается в связи с нарушением его метаболизма и выведения.
Важные замечания
- Миртазапин в дозе 30 мг 1 раз в сутки вызывает небольшое увеличение международного нормализованного отношения (МНО) у пациентов, которых лечили варфарином. В связи с этим желательно контролировать его в случае сопутствующего применения варфарина с миртазапином.
- Пациентам, принимающим миртазапин, рекомендовано регулярно проверять уровень натрия в крови и показатели функции печени и почек.
- Недопустимо корректировать дозу и режим приема препарата самостоятельно, без участия врача.
Также рекомендуется
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Лейкоцитарная формула
- Коагулограмма № 1 (протромбин (по Квику), МНО)
- Аланинаминотрансфераза (АЛТ)
- Аспартатаминотрансфераза (АСТ)
- Билирубин общий
- Натрий в сыворотке
- Креатинин в сыворотке
- Дулоксетин
- Флуоксетин
Кто назначает исследование?
Психиатр, клинический фармаколог.
Литература
- Anttila SA, Leinonen EV (2001). «A review of the pharmacological and clinical profile of mirtazapine». CNS Drug Reviews — 7 (3): 249–64.
- Shams M, Hiemke C, Härtter S. Therapeutic drug monitoring of the antidepressant mirtazapine and its N-demethylated metabolite in human serum. Ther Drug Monit. 2004 Feb;26(1):78-84.
- Timmer CJ, Sitsen JM, Delbressine LP. Clinical pharmacokinetics of mirtazapine. ClinPharmacokinet 2000 Jun; 38(6):461-74.
- Медведев В. Э. Миртазонал (миртазапин) в психиатрической практике: забытые и новые возможности. Обозрение психиатрии и медицинской психологии им. Бехтерева № 4. – 2011.
Эффективность терапии миртазапином у больных с депрессией и аффективными расстройствами
Переход новых препаратов из лаборатории в повседневную врачебную практику — всегда непростой и отчасти противоречивый процесс. Взвешенное отношение к лекарству приходит лишь на этапе, когда врач хорошо представляет себе границы возможностей средства, основываясь на понимании его достоинств и недостатков, и отводит ему устойчивое место в своем арсенале. Сроки адаптации врача к новому препарату сокращаются, если врач имеет возможность более детально изучить особенности его действия, используя отдельные приемы собственно научных исследований. Это позволяет врачу более точно обобщить свой опыт и сравнить его с опытом коллег, критически оценить литературные данные. Результатам одного из таких проектов посвящена настоящая статья. В качестве нового препарата выбран миртазапин антидепрессант, активный как в отношении серотонинергической, так и норадренергической системы и избирательно блокирующий a2 норадренергические и 5-НТ2 и 5НТ3 серотонинергические рецепторы. Этот нейрохимический профиль отличает миртазапин от всех известных на сегодняшний день препаратов этой группы. По литературным данным, миртазапин обладает мощным антидепрессивным действием при низкой выраженности побочный эффектов, свойственных как трициклическим, так и серотонинергическим антидепрессантам [1,2].
Материалы и методы
В исследование были включены 63 больных, страдающих различными вариантами аффективного расстройства и переживающих депрессию средней и тяжелой степени тяжести.
Критерием тяжести состояния был выбран общий балл по шкале Гамильтона для депрессии (17 пунктов). Тяжелой депрессия считалась в том случае, если этот показатель был больше 25, средней тяжести больше 18, но меньше 25. По этому признаку больные разделились почти поровну: с тяжелой депрессией – 34 больных (средний показатель по шкале Гамильтона 31,6±0,8, депрессией средней тяжести — 29 больных (средний показатель по шкале Гамильтона 19,8±0,7).
Распределение больных по диагностическим группам, а также средний показатель выраженности депрессии по объективной и субъективной шкале по группам показано в таблице 1.
Как видно из таблицы, наибольшая тяжесть депрессии наблюдалась у больных с биполярным расстройством, а наименьшая — с хроническим депрессивным расстройством, то есть дистимией и циклотимией.
В проект исследования были включены 12 психиатрических больниц Москвы, Санкт-Петербурга и других городов России. Строгих критериев включения и исключения не предполагалось: врачам предлагали назначать миртазапин всем больным, госпитализированным по поводу депрессии, которым безусловно была показана антидепрессивная терапия. Из антидепрессантов использовался только миртазапин. В дозировании препарата также предоставлялась свобода в рамках инструкции, где терапевтическая доза варьировала от 15 до 45 мг. Длительность проведения проекта для каждого пациента составляла 42 дня.
Для того, чтобы формализовать полученные данные было предложено использовать следующие шкалы:
• шкала Гамильтона для депрессии (17 пунктов) [3];
• шкала глобального клинического впечатления;
• самооценочная шкала Бека для депрессии (21 пункт) [4].
Результаты и обсуждение
Анализ результатов проводился по двум направлениям: динамика состояния у больных различных нозологических групп и динамика состояния у больных с тяжелой и средней тяжести депрессией вне зависимости от их нозологической принадлежности.
Все пациенты, кроме 1 больного из группы больных с хроническим аффективным расстройством (дистимией), который прервал исследование в связи с неэффективностью терапии, закончили исследование. Процент респондеров (50% снижение по шкале Гамильтона) на конец исследования в зависимости от течения аффективного психоза представлен в таблице 2.
Биполярное аффективное расстройство
Статистически значимые изменения по шкале Гамильтона наблюдались уже к концу первой недели (р< 0,001). К моменту окончания исследования средний общий показатель по шкале показывал отсутствие депрессии (7,4±1,9) (рис. 1). Наиболее значительным изменениям к концу первой недели терапии подверглись такие признаки, как депрессивное настроение, расстройство сна и психическая тревога, в то время как изменения в выраженности таких симптомов депрессии, как чувство вины, суицидальные мысли, заторможенность претерпевали незначительную динамику. К концу исследования практически все симптомы, которые оценивались шкалой Гамильтона практически исчезали. Лишь средние показатели работоспособности и гастроинтестинальных нарушений равнялись 1 (наиболее легкая степень расстройства). По шкале глобального клинического впечатления эта группа больных проделывала динамику от «умеренная тяжесть заболевания» (средний показатель 4,0±0,1) через «легкая тяжесть заболевания» (средний показатель 3,4±0,1) до «состояние граничит с нормой» (средний показатель 2,1±0,2) (р<0,001). По самооценочной шкале статистически значимые изменения обнаруживались также к концу первой недели, но были менее выраженными, чем по шкале Гамильтона (рис. 1). К концу исследования шкала Бека показала еще более значительное улучшение (р<0,001), но все же здесь выраженность его оставалась существенно меньше, чем по шкале Гамильтона.
Реккурентная депрессия
Аналогичная картина наблюдалась и в группе больных с реккурентной депрессией (рис. 2). Отличие касалось ряда симптомов, уменьшивших свою выраженность в первую неделю терапии. Наиболее быстро, к концу первой недели, на лечение отреагировали следующие симптомы: депрессивное настроение (p<0,05), суицидальные мысли (p<0,05), расстройство сна (p<0,05), нарушения функции желудочно-кишечного тракта (p<0,05) и изменение веса (p<0,01). К концу исследования почти все симптомы полностью исчезли. Исключение составили показатели работоспособности и депрессивного настроения, средние значения которых были все же несколько больше единицы, что соответствовует легкой степени тяжести нарушения.
Депрессивный эпизод
Диагноз «депрессивный эпизод» выставлялся больным в том случае, если тип течения на текущем этапе заболевания определить было невозможно. В подавляющем большинстве случаев это были больные с очень коротким катамнезом. Общий характер динамики показателей шкал Гамильтона, Бека и глобального клинического впечатления был такой же, как в двух предыдущих группах больных: статистически значимые изменения по всем шкалам обнаруживались к концу первой недели терапии. Улучшение состояния продолжало нарастать в ходе лечения. Однако выявлялась и некоторая разница: наряду с симптомом «депрессивное настроение» (p<0,01) на терапию наиболее выражено (к концу первой недели) реагировал симптом «снижение работоспособности» (p<0,05). За этот же период статистически значимо менялся вес больных (p<0,05). То есть первичная реакция на терапию объединяла в себе как признаки биполярного, так и монополярного течения. Изменения других признаков шкалы Гамильтона были статистически недостоверны в первый период терапии, но подвергались практически полной редукции к концу исследования (p<0,001).
Улучшение по показателям шкалы, заполняемой врачом, опережало улучшение по показателям шкалы, заполняемой пациентом.
Хроническое расстройство настроения
Из всего разнообразия хронических расстройств настроения здесь были представлены только больные с дистимией. В отличие от других групп больных у этих пациентов выраженное улучшение состояния выявлялось позже, только к концу исследования, как по объективной, так и по субъективной шкале (первая неделя терапии — изменения показателей по шкале Гамильтона и Бека статистически недостоверны, окончание исследования – p<0,001). Несмотря на это, характер изменений по шкалам Гамильтона и Бека практически повторял динамику показателей шкал в других группах (рис. 3). По шкале Гамильтона на первой неделе терапии статистически значимое изменение наблюдалось только в отношении симптома «снижение работоспособности» (р<0,05). Интересно отметить, что симптом «депрессивное настроение» был выражен здесь не меньше, чем в других группах (F34 — 3,1±0,2, F33 – 3,0±0,1, F32 – 3,0±0,1, F31 – 3,3±0,2) и реагировал на терапию медленнее. К концу исследования в этой группе не было ни одного среднего показателя шкалы Гамильтона, который бы превышал 1, то есть обратному развитию подверглись все без исключения симптомы.
Обобщая сказанное, можно заметить, что независимо от формы течения аффективного расстройства характер изменений по показателям Гамильтона и Бека на фоне терапии миртазапином был одинаков. Во всех группах динамика показателей улучшения по шкале Гамильтона была более быстрой и выраженной, чем по шкале Бека. Иными словами, шкала Гамильтона оказалась более чувствительной к изменению в состоянии больных, чем шкала Бека, что полностью соответствует литературным данным [6]. Однако и шкала Бека хорошо отражала улучшение состояния больных, что дополняло клиническое впечатление. На момент окончания исследования не было различий и по отдельным симптомам, которые регистрировала шкала Гамильтона. Однако существенная разница обнаруживалась в наборе наиболее быстро реагирующих симптомов в группах с различными типами течения заболевания. Интересно, что в трех из четырех группах симптом «депрессивное настроение» статистически значимо редуцировался уже на первой неделе терапии, в то время как ни в одной из групп не обнаруживалось к этому времени редукции чувства вины -признака, который вместе с депрессивным настроением составляет ядро депрессии. В двух из четырех группах отмечалось быстрое повышение работоспособности больных, причем в группе больных с дистимией этот симптом был единственным, отреагировавшим на лечение в первую неделю, у больных с биполярным и монополярным течением этот признак, напротив, реагировал позже и сохранялся к моменту окончания исследования.
Динамика состояния больных с депрессией средней тяжести и тяжелой
Среди практических врачей на основании повседневного клинического опыта сформировалось мнение, что существует разница в характере реакции на терапию больных с тяжелыми и более легкими депрессиями. В некоторых случаях тяжелая депрессия ассоциируется с резистентной. Предполагается, что для лечения больных с такой тяжестью заболевания необходимо использовать препараты с менее избирательным нейрохимическим действием (преимущественно трициклические антидепрессанты), дозы антидепрессантов должны быть более высокими, следует отдавать предпочтение интрамускулярным и внутривенным формам. В связи с этим особенно интересно было сравнить динамику показателей терапевтического ответа у больных с тяжелой депрессией и депрессией средней тяжести. Обнаружилось, что по шкалам Гамильтона и Бека как в той, так и в другой группе больных статистически достоверные изменения наступали уже на первой неделе лечения и продолжали нарастать в дальнейшем (рис.4). В первую неделю терапии изменения по шкале Гамильтона в группе больных с тяжелыми депрессиями были даже несколько больше, чем в группе с депрессиями средней степени тяжести (процент изменений составил 39,9% против 37,3%, разница не достигала уровня статистической достоверности). В следующий терапевтический период динамика была обратной: к концу исследования процент изменений в первой группе составил 27,5%, а во второй — 35,9% (p<0,05). Иными словами, больные с тяжелой депрессией быстрее реагировали на терапию, но в дальнейшем этот темп снижался, в то время как улучшение больных с депрессией средней тяжести было более равномерным. По шкале Бека ситуация выглядела по-другому: процент улучшения больных с тяжелой депрессией был несколько большим на всем протяжении исследования, чем у больных с депрессией более легкой (у больных первой группы процент улучшения составил 17,8% в первую неделю и 28,9% во вторую неделю, у больных второй группы- 14,3% и 25,3% соответственно, но разница не достигала уровня статистической достоверности). То есть отмечалась тенденция к тому, что больные с тяжелой депрессией воспринимали улучшение своего состояния более ярко, чем больные с депрессией средней тяжести. Необходимо отметить, что, несмотря на отсутствие ограничений по дозированию препарата, как в первой, так и в другой группе больных дозы были одинаковые и составили 30 мг. Таким образом, в некотором отношении реакция на терапию больных с тяжелой депрессией была даже более яркой, пероральная форма препарата не была препятствием к получению высокого терапевтического эффекта у больных с тяжелой депрессией, доза препарата не менялась в зависимости от тяжести состояния.
Побочные эффекты
Побочные эффекты наблюдались у небольшого числа больных и были выражены незначительно. Из наиболее частых побочных эффектов отмечались сухость во рту (6 случаев), сонливость (2 случая), гипотензия (2 случая). В единичных случаях наблюдались: чувство слабости, бессонница, тревога и инверсия аффекта. Повышение аппетита и прибавка в весе, симптом, известный как наиболее частый побочный эффект на фоне терапии миртазапином (7), в этом исследовании в списке побочных эффектов не фигурировали, в то время как в пунктах шкалы Гамильтона динамика этих симптомов была показана.
Заключение
Анализ результатов проведенного исследования позволяет сделать два блока выводов. Первый касается техники проведения этого необычного исследования, второй — его результатов.
1. Результаты, основанные на данных, полученных практикующими врачами, а не исследователями, в основном не отличаются от результатов, основанных на данных, полученных в особых условиях контролируемых исследований:
• Не только объективная шкала Гамильтона, но и самооценочная шкала Бека оказались чувствительны к изменениям, происходившим на фоне терапии миртазапином.
• Шкала Бека с успехом была использована у больных с тяжелой депрессией, хотя по данным некоторых авторов тяжесть депрессии лимитирует применение этого инструмента [4].
2. Исследование показало, что миртазапин оказался эффективным антидепрессантом при различных формах аффективного расстройства:
• общий характер динамики терапевтического ответа был похож у больных с разным типом течения, но немедленный ответ (первая неделя терапии) существенно отличался, выявляя наиболее «чувствительные» к миртазапину признаки у больных с разным типом течения аффективного расстройства.
• миртазапин оказался одинаково эффективным антидепрессантом при депрессиях тяжелых и средней степени тяжести (5).
• большая тяжесть депрессивных нарушений не требовала увеличения дозы.
Список литературы Вы можете найти на сайте https://www.rmj.ru
Миртазапин –
Ремерон (торговое название)
(Organon)
Литература
1. Мосолов С.Н., Костюкова Е.Г., Сердитов О.В. и др. Клиническая эффективность и переносимость нового антидепрессанта миртазапин (Ремерон) при тяжелой депрессии. Социальная и клиническая психиатрия, 1,2000,стр.55-60.
2. Колюцкая Е.В., Ястребов Д.В. Использование миртазапина при лечении депрессий. Русский медицинский журнал N19,т.2,N2-3, 1999,стр.50-52
3. Hamilton M. Development of a rating scale for primary depressive illness. Brit.J, of Soc.Clin.Psychol., 1967; 6: 278-296.
4. Beck AT, Ward CH, Mendelson M, Mock J, Erbaugh J. An inventory for measuring depression. Arch Gen Psychiatry 1961; 4: 561-571
5. Gorman JM. Mirtazapine: clinical overview Journ Clin Psychiatry 1999;60 (suppl 17),pp9-13
6. Moller H-J, von Zerssen D. Self-ration procedures in the evaluation of antidepressants. Psychopathology 1995; 28: 291-306
7. Guelfi JD, Ansseau M, Timmerman L et al. Efficacy and tollerability of mirtazapine vs venlafaxine in hospitalized, severely depressed patients with melancholia. Abstracts ECNP, Brussels, 2000.
| Приложения к статье |
| Рис. 1. Динамика общего показателя по шкалам Гамильтона и Бека (биполярное течение) |
| Рис. 2. Динамика общего показателя по шкалам Гамильтона и Бека (монополярное депрессивное течение) |
| Рис. 3. Динамика общего показателя по шкалам Гамильтона и Бека (дистимия) |
| Рис. 4. Динамика общего показателя по шкалам Гамильтона и Бека (средней тяжести и тяжелая депрессия) |
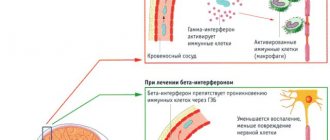
Употребление алкоголя во время лечения антидепрессантами — есть ли повод для беспокойства?
Перевод врача-невролога Яблонского М.А.
Drinking alcohol during antidepressant treatment — a cause for concern?
| News | Pharmaceutical Journal
. (n.d.).
Retrieved February 1, 2021,
Новые данные указывают на риск патологической интоксикации, когда пациенты, получающие лечение СИОЗС, принимают алкоголь. Andrew Herxheimer and David B. Menkes investigate
В доклинических исследованиях взаимодействия между селективными ингибиторами обратного захвата серотонина (СИОЗС) и алкоголем, проводились преимущественно острые эксперименты на здоровых добровольцах с использованием различных оценок психофизиологических функций.
Чаще всего, одновременный приём не приводит к функциональным нарушениям и не вызывает действия отличного от действия алкоголя.1,2
Приём алкоголя распространён при депрессии,3 но его взаимодействие с антидепрессантами у пациентов (исключая, злоупотребляющих алкоголем) изучено недостаточно. Подгруппа лиц, употребляющих алкоголь, вероятно, испытывает более выраженные затруднения.4,5
В нашей практике мы неоднократно отмечали, что некоторые люди испытывают выраженные изменения в толерантности к алкоголю во время лечения СИОЗС и сходными препаратами. Последствия включают сексуальную расторможенность и учащение эпизодов насилия.6,7 Этот характер изменений встречается при приёме СИОЗС и венлафаксина,8 но клиницисты часто не уделяют этому достаточного внимания. Механизм этого феномена недостаточно изучен. Предполагается, что растормаживающее действие алкоголя вместе со стимулирующим эффектом большинства СИОЗС и сходных антидепрессантов может вызывать эффекты, которые не отмечаются под действием этих веществ по отдельности. Принимая во внимание наличие этой проблемы, мы изучаем предостережения для пациентов и врачей, назначающих лечение, в информации о назначаемых СИОЗС и сходных препарата, предоставляемой производителем.
Патологическая интоксикация
Патологическая интоксикация по данным отдельных сообщений об использовании обычных количеств алкоголя, что приводило либо к выраженной интенсивной интоксикации или качественно иной интоксикации, например, с крайне необычными расторможенностью или агрессией
Поиск в литературе
Мы изучили типовые клинико-фармакологические статьи (ТКФС) лекарственного средства и информационные листки пациента (ИЛП) и выделили все упоминания о взаимодействиях с алкоголем, включая предостережения в отношении венлафаксина, миртазапина, бупропиона, дулоксетина и каждого из СИОЗС, доступных на рынке Великобритании.
В 2006–07 мы провели опрос директоров по медицинским вопросам основных фармацевтических компаний, получающих любую информацию о возможных взаимодействиях их препаратов с алкоголем, включая экспериментальные исследования с участием волонтёров, клинические исследования и описания случаев с возможными взаимодействиями.
В таблице 1 представлена информация ТКФС и ИЛП. Почти все информационные листки для клиницистов и пациентов указывали в той или иной форме на необходимость воздерживаться от приёма алкоголя одновременно с приёмом препаратов (СИОЗС или венлафаксина) или делать это с осторожностью (дулоксетин). В большинстве из них эта рекомендация никак не обоснована. В некоторых — эта точка зрения является общепризнанной. Например, ТКФС флувоксамина указывает: “Как и в случае приёма других психотропных препаратов, пациентам не следует употреблять алкоголь.”
Таблица 1 Предостережения в краткой характеристике лекарственного средства (SPC) или информационном листке пациента (ИЛП) (ноябрь 2011, www.medicines.org/emc)
| Циталопрам Ципрамил Lundbeck | Не было выявлено ни фармакокинетического, ни фармакодинамического взаимодействия между циталопрамом и алкоголем. Однако, одновременный приём циталопрама и алкоголя не рекомендуется. | Как и в отношении других антидепрессантов, целесообразно избегать употребления алкоголя во время лечения, несмотря на то, что в отношении Ципрамила не было показано повышения выраженности эффектов алкоголя. |
| Эсциталопрам Ципралекс Lundbeck | Не предполагается ни фармакокинетического, ни фармакодинамического взаимодействия между эсциталопрамом и алкоголем. Однако, что касается других психотропных препаратов, их комбинация с алкоголем не рекомендуется. | Как и в отношении многих лекарств, комбинация Ципралекса с алкоголем не рекомендуется, при этом взаимодействия Ципралекса с алкоголем не предполагается. |
| Дулоксетин Симбалта Lilly | Лекарственные препараты, действующие на ЦНС Риск назначения дулоксетина в комбинации с другими препаратами, действующими на ЦНС не изучался в ходе систематической оценки, за исключением случаев, описанных в этом разделе. Следовательно, рекомендуется особое внимание при назначении Симбалты в комбинации с другими лекарственными препаратами или веществами, действующими на центральную нервную систему, включая алкоголь и седативные средства (например, бензодиазепины, морфиномиметики, антипсихотики, фенобарбитал, седативные антигистаминные средства). | Приём симбалты возможен как одновременно с пищей, так и натощак. Необходима осторожность при приёме алкоголя во время курса лечения Симбалтой. |
| Флуоксетин Прозак Lilly | Алкоголь При стандартной оценке, флуоксетин не повышал уровня алкоголя в крови или не усиливал эффекта алкоголя. Однако, одновременный приём СИОЗС и алкоголя не рекомендуется. | Вы можете принимать Прозак, как одновременно с приёмом пищи, так и натощак. Вам необходимо избегать приёма алкоголя, когда вы проходите курс лечения этим препаратом. |
| Флувоксамин. Феварин Abbott | Как в отношении других психотропных препаратов, пациентам рекомендуется не принимать алкоголь одновременно с приёмом флувоксамина. | Приём Феварина с пищей или напитками Не принимайте алкоголь если вы принимаете этот препарат. Это связано с тем, что действие алкоголя при приёме Феварина вызывает сонливость и неустойчивость. |
| Миртазапин Zispin MSD | Миртазапин может усиливать угнетающее действие алкоголя на ЦНС. Пациентам необходимо рекомендовать избегать приёма алкогольных напитков во время лечения митразапином. | Приём Миртазапина с пищей и алкогольными напитками. Вы можете ощущать сонливость если употребляете алкоголь одновременно с приёмом Миртазапин. Рекомендуется не употреблять какие-либо алкогольные напитки. |
| Пароксетин Seroxat GSK | Алкоголь Как и в случае с другими психотропными препаратами, необходимо рекомендовать воздерживаться от приёма алкоголя одновременно с приёмом пароксетина. Клинический опыт показывает, что лечение пароксетином не сопровождается нарушениями когнитивных или психомоторных функций. При этом, как и в отношении всех психоактивных препаратов, пациентам требуется соблюдать осторожность при управлении автомобилем и механизмами. Несмотря на то, что пароксетин не усиливает нарушений когнитивных и двигательных навыков, вызванных алкоголем, одновременный приём пароксетина и алкоголя не рекомендуется. | Не принимайте алкоголь одновременно с приёмом Пароксетина. Алкоголь может ухудшить ваши симптомы или побочные эффекты. |
| Сертралин Lustral Abbott [ранее — Pfizer] | Препараты, угнетающие ЦНС и алкоголь Одновременное назначение сертралина 200 мг ежедневно не усиливает действия алкоголя, карбамазепина, галоперидола или фенитоина на когнитивные или психомоторные функции у здоровых лиц. Однако, одновременный приём алкоголя и сертралина не рекомендуется. | Во время приёма Сертралина, необходимо избегать приёма алкоголя. |
| Венлафаксин Эфексор XL Wyeth | При приёме венлафаксина было показано отсутствие усиления двигательных и когнитивных нарушений, вызванных этанолом. Однако, как и в отношении других препаратов, действующих на ЦНС, пациентам рекомендуется избегать приёма алкоголя. | Рекомендуется воздерживаться от приёма алкоголя, одновременно с приёмом препарата Венлафаксин. |
Но в соответствующем ИЛП даётся более ясное утверждение: “алкоголь может влиять на действие препарата, вызывая сонливость и неустойчивость.” Сходным образом, в ИЛП GSK указывается, что приём алкоголя одновременно с пароксетином может усилить симптомы или выраженность нежелательных явлений. Пять из шести британских компаний, выпускающих на рынок свои товары (GSK, Lilly, Lundbeck, Pfizer и Wyeth) цитируют экспериментальные данные, указывающие, что их препарат (препараты) не усиливают нежелательных явлений, связанных с приёмом алкоголя, но по прежнему не рекомендуют приём алкоголя без убедительных объяснений.
Ответы компаний на наши последующие запросы в отношении данных о взаимодействии с алкоголем сильно отличаются (Таблица 2). Некоторые поступили от директоров по медицинским вопросам и медицинских советников, другие — от сотрудников фармаконадзора. Все были вежливы, но ни в одном из них не было выражено интереса. В большинстве случаев были высланы резюме одного или нескольких экспериментальных исследований с участием здоровых добровольцев, указывающих, что одновременный разовый приём лекарственных препаратов с алкоголем не вызывал более выраженных психических или двигательных нарушений, чем алкоголь отдельно. Несколько — отправили сообщения или резюме опубликованных или неопубликованных клинических исследований с участием алкоголиков, оценивающих способность препарата уменьшать употребление алкоголя или предотвращать рецидивы алкоголизма. Ни в одном из них не было выявлено положительного влияния.
Одна компания (GSK) направила внушительный объём литературных данных, однако, подборка включала большое количество результатов исследований на животных с сомнительной значимостью. Не одна из компаний не отправила сообщений о клинических случаях; большинство сослались только на количество случаев в Регистре жёлтых карт Управления по контролю лекарственных средств и изделий медицинского назначения Великобритании. Одна компания заявила, что текст этих сообщений был конфиденциальным. Ни одна из международных компаний не ссылалась на описания клинических случаев, поступившие из-за пределов США.
Пить или не пить?
Мы выявили общую тенденцию в ТКФС и ИЛП, подготовленных производителями СИОЗС и других антидепрессантов. Несмотря на все проблемы с использованием алкоголя, в отдельных смешанных сообщениях, цитировались данные исследований с участием здоровых добровольцев и приводились указания на отсутствие взаимодействия препарата с алкоголем.
Таблица 2 Сообщения компаний за 2006-07 годы
| Компания | Препарат | Кто сообщил | Содержание сообщения | Направленные документы | Сообщения о нежелательных реакциях на препарат |
| Lundbeck | Циталопрам, Эсциталопрам | Старший специалист по фармаконадзору | Четырёхстраничное письмо, обзор, восемь ссылок на опубликованные исследования | Включено восемь статей и абстрактов, некоторые из них, о лицах, злоупотребляющих алкоголем | Приводится анализ 13 случаев |
| Lilly | Флуоксетин | Главный исследователь информации о состоянии здоровья | Краткая характеристика лекарственного препарата | Приём Прозака одновременно с алкоголем: четырёстраничный обзор, 18 ссылок | Количество запросов об описании наших случаев |
| Дулоксетин | Главный исследователь информации о состоянии здоровья | Краткая характеристика лекарственного препарата | Использование у пациентов, злоупотребляющих алкоголем | ||
| GSK | Пароксетин | Руководитель медицинского отдела | Обзор трёх опубликованных и трёх неопубликованных результатов исследований | Также 47 ссылок на исследования взаимодействия алкоголя с другими СИОЗС. В дальнейшем, по запросу были направлены неопубликованные результаты исследования пароксетина для профилактики рецидивов алкоголизма | Количество запросов об описании наших случаев |
| Wyeth | Венлафаксин | Научный консультант, специализирующийся на патологии ЦНС | Описательный обзор, две страницы, 4 ссылки | В Великобритании было подано менее 10 сообщений о взаимодействиях | |
| Pfizer | Сертралин | Пресс-секретарь по медицинским вопросам | 11 здоровых участников получали по 200 мг в течение девяти дней, затем — одну дозу алкоголя из расчёта 0,5 г/кг. Влияния на когнитивные или психомоторные функции не отмечено | Неопубликованный эксперимент | Четыре отчёта в Агентство по контролю за лекарственными средствами и изделиями медицинского назначения — жёлтые карты |
Предостережения в отношении приёма алкоголя, таким образом, не подкрепляются соответствующими доказательными данными. Они выглядят неубедительными как для пациентов, так и для специалистов, назначающих лечение. Это может объяснять, почему многие пациенты не принимают всерьёз такие предостережения.
Мы описали синдром патологической интоксикации, часто с серьёзными последствиями, у пациентов которым были назначены СИОЗС или сходные препараты.6–8
Примечательно, что часто фигурируют только незначительные или обычные количества алкоголя, и что более чем в половине случаев отмечаются нарушения памяти. Эта проблема не редка, но часто, она не получает достаточного внимания. Это может быть связано с известным фактом о недооценке количества нежелательных явлений и возможности того, что регуляторы не проводят систематической оценки таких эффектов по классам лекарственных препаратов. Например, онлайн база данных MHRA содержит 129 сообщений, помеченных «взаимодействие с алкоголем» с СИОЗС или сходными препаратами, но они не были объединены в специальную группу. Сообщения которые были объединены по названию препарата и связи с лекарствами, не выявлены.9
Требуется дополнить ТКФС и ИЛП однозначным предостережением врачей и пациентов о возможности развития патологической алкогольной интоксикации во время лечения СИОЗС и сходными лекарствами. Это должно помочь в выборе лекарств, выявлении и изучении этой проблемы.
Список использованной литературы
- Allen D, Lader M. Interactions of alcohol with amitriptyline, fluoxetine and placebo in normal subjects. International Clinical Psychopharmacology 1989;4(Suppl 1):7–14.
- Schaffler K. Study on performance and alcohol interaction with the antidepressant fluoxetine. International Clinical Psychopharmacology 1989;4(Suppl 1):15–20.
- Davis LL, Rush JA, Wisniewski SR, Rice K, Cassano P, Jewell ME et al. Substance use disorder comorbidity in major depressive disorder: an exploratory analysis of the Sequenced Treatment Alternatives to Relieve Depression cohort. Comprehensive Psychiatry 2005;46:81–9.
- Chick J, Aschauer H, Hornik K. Efficacy of fluvoxamine in preventing relapse in alcohol dependence: a one-year, double-blind, placebo-controlled multicentre study with analysis by typology. Drug and alcohol Dependence 2004;74:61–70.
- Lingford-Hughes AR, Welch S, Nutt DJ. Evidence-based guidelines for the pharmacological management of substance misuse, addiction and comorbidity: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology 2004;18:293–335.
- Chandler P, Herxheimer A. Unexpected aggressive behaviour: interaction of bupropion and alcohol. International Journal of Risk and Safety in Medicine 2011;23:133–7.
- Herxheimer A. British diplomat cleared of drunk flying charges: paroxetine was involved. International Journal of Risk and Safety in Medicine 2007;19:35–40.
- Menkes DB, Herxheimer A. Provocation by alcohol of violence as a side-effect of antidepressants. Drug Safety 2009;32:948–9.
- Download Drug Analysis Prints (DAPs). London: Medicines and Healthcare products Regulatory Agency (MHRA); 2011. Available at: www.mhra.gov.uk (accessed 30 November 2011).
Применение препарата Миртазапин
Начальная доза для взрослых составляет 15 мг/сут. Средняя эффективная терапевтическая доза — 15–45 мг. При достижении максимальной суточной дозы и отсутствии клинического эффекта в течение следующих 2–4 нед лечение необходимо прекратить. Терапию продолжают до полного исчезновения клинических симптомов депрессии в течение 4–6 мес. Отменяют постепенно. У пациентов пожилого возраста дозы миртазапина повышают постепенно и при строгом наблюдении врача. Данных о безвредности и эффективности миртазапина у детей нет.
Фармакологические свойства препарата Миртазапин
Антидепрессант. Блокирует центральные пресинаптические α2-рецепторы, а также усиливает нервную передачу в серотонинергических синапсах только через 5-НТ1-рецепторы, так как 5-НТ2- и 5-НТ3-рецепторы блокируются. Уменьшает выраженность таких симптомов, как ангедония, психомоторная заторможенность, нарушения сна, уменьшение массы тела, суицидальные мысли, колебания настроения, потеря интереса к жизни. Антидепрессивное действие развивается через 1–2 нед лечения. Миртазапин после приема внутрь быстро абсорбируется из пищеварительного тракта. Биодоступность — 50%. Максимальная концентрация в плазме крови достигается через 2 ч. Равновесная концентрация миртазапина в плазме крови устанавливается через 3–4 дня постоянного приема. Связывание с белками плазмы крови составляет 85%. Миртазапин активно метаболизируется в печени путем деметилирования и окисления с последующей конъюгацией. Диметил-миртазапин так же фармакологически активен, как и исходное вещество. Миртазапин выводится с мочой и калом. Период полувыведения — 20–40 ч.
Среди антидепрессантов, применяющихся в настоящее время как за рубежом, так и в нашей стране, милнаципран остается наименее изученным. Так, на интернет-портале Национальной библиотеки медицины Национального института здоровья США на момент написания обзора содержится 579 ссылок на публикации, в которых упоминается этот препарат (табл. 1). Если учесть, что первая публикация появилась в 1985 г. [1], то в среднем за прошедшее 30 лет ежегодно выходило всего около 19 печатных работ, так или иначе связанных с милнаципраном. Это самый низкий показатель среди всех антидепрессантов, использующихся в настоящее время как за рубежом, так и в нашей стране. Вот почему назрела необходимость посвятить специальный обзор литературы милнаципрану и его роли в терапии различных расстройств.
Таблица 1. Данные о ссылках на публикации с упоминанием об антидепрессантах на интернет-портале Национальной библиотеки медицины Национального института здоровья США Примечание. НАССА — норадренергические и специфические серотониновые антидепрессанты; ЧЦА — четырехциклические антидепрессанты; АСИОЗ — антагонисты серотонина и ингибиторы его обратного захвата.
Известно, что этот препарат первоначально назывался мидалципран [1]. После переименования он был зарегистрирован в европейских странах в 1997 г. для лечения депрессивных состояний различной тяжести [2]. Их критерии приведены в табл. 2 с учетом основных и дополнительных симптомов [3]. Основные представлены ухудшением настроения, утратой интересов и удовольствия и снижением энергичности, которые могут привести к повышенной утомляемости и нарушению активности. Дополнительные характеризуются сниженной способностью к сосредоточению и вниманию, низкой самооценкой и чувством неуверенности в себе, идеями виновности и уничижения, мрачным и пессимистическим взглядом на будущее, мыслями или действиями, направленными на самоповреждение или суицид, а также нарушением сна и сниженным аппетитом. Кроме того, в особую категорию выделяют соматические симптомы. К ним относятся: утрата интересов и удовольствия от деятельности, которая нравилась раньше, потеря эмоциональной реакции на окружение и события, которые обычно приятны. Характерны также пробуждение по утрам на 2 ч (и более) раньше обычного, объективные (отмеченные посторонним человеком) признаки психомоторной заторможенности или ажитации; выраженное снижение аппетита или либидо; потеря в весе на 5% (и более) в течение последнего месяца, а также большая тяжесть депрессии в утренние часы. Четыре и более таких симптомов формируют соматический синдром. Последний, наряду с психотическими симптомами (бред и галлюцинации), предпочтителен для тяжелого депрессивного эпизода.
Таблица 2. Критерии тяжести депрессивного эпизода по МКБ-10 Примечание. * — при острых и выраженных симптомах.
Считается, что депрессивный эпизод может быть единственным проявлением психического расстройства (рекуррентное депрессивное, дистимия) или перемежаться с другими синдромами (например, маниакальное, как при биполярном аффективном расстройстве, или циклотимия). Но кроме этого, депрессивные эпизоды (как правило, легкой и средней тяжести) могут наблюдаться на фоне неврологических и соматических заболеваний.
Появление милнаципрана на фармацевтическом рынке было встречено с энтузиазмом [4]. Дело в том, что к тому времени в европейской психиатрии стали все чаще использовать селективные ингибиторы обратного захвата серотонина (СИОЗС), которые в отличие от трициклических антидепрессантов (ТЦА) «утратили не только прямое влияние на рецепторы, ответственные за неблагоприятные побочные явления, но и способность ингибировать обратный захват норадреналина» [4], необходимую для терапевтического эффекта. В результате новые антидепрессанты стали гораздо лучше переноситься больными. Но СИОЗС «обнаруживали тенденцию быть менее эффективными, чем ТЦА, особенно при более серьезных формах депрессий» [4].
Предполагалось, что «сверхновые» селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) будут обладать более сильным антидепрессивным действием СИОЗС, а по переносимости сопоставимы с ними [5]. Соответственно, СИОЗСН, и особенно один из представителей этой группы — милнаципран, смогут заменить ТЦА даже при лечении тяжелой депрессии. Такие надежды основывались на том, что этот антидепрессант практически в равной мере ингибирует обратный захват и серотонина, и норадреналина. в то время как другие СИОЗСН (венлафаксин и дулоксетин) в большей степени влияют на обмен первого из двух указанных нейромедиаторов. Экспериментальное подтверждение этой гипотезе искали многие авторы [6, 7]. К сожалению, результаты исследований не совпали с ожиданиями. В частности, сообщалось [8], что по результатам клинических исследований не установлено различий в эффективности СИОЗС и милнаципрана, а его переносимость аналогична флуоксетину и флувоксамину. Таким образом ТЦА оставались препаратами первой линии, по крайней мере, при тяжелых депрессиях. И наконец, было отмечено [8], что рассматриваемый представитель группы СИОЗСН, хотя и дает меньше холинолитических эффектов (седация и потливость) нежели ТЦА, но, как и они, может вызвать дизурию [8].
Публикации по рассматриваемой теме были обобщены в виде метаанализа Кохрейновской базы данных [9]. Там утверждалось, что не существует достаточных доказательств, чтобы сделать вывод, что милнаципран превосходит, уступает или равен другим антидепрессантам в эффективности и переносимости в острой фазе лечения тяжелой депрессии. Если и есть некоторые свидетельства в пользу преимущества милнаципрана над ТЦА, то они касаются доли больных, выбывших из исследования из-за неблагоприятных явлений и некоторых показателей переносимости. В заключение, через 12 лет после начала клинического применения препарата, авторы метаанализа рекомендовали провести дальнейшие исследования, чтобы ответить на вопрос о том, будет ли милнаципран лучшим антидепрессантом для лечения острой тяжелой депрессии.
Данные рекомендации не были реализованы, отчасти из-за того, что сведения о механизме действия препарата были пересмотрены. Милнаципран оказался «более норадренергическим», нежели «сбалансированным серотониновым и норадреналиновым» препаратом [10]1. К тому же появились новые представления и о патогенезе самой депрессии.
В нейрохимическом аспекте симптомы депрессии можно дифференцировать на два основных кластера: норадреналиновый и серотониново-норадреналиновый [13]. Первый из них связан с дефицитом активности норадреналиновых нейронов и проявляется такими симптомами, как психомоторная заторможенность, утрата концентрации внимания, энергии, утомляемость, усталость. Второй кластер обусловлен снижением активности серотониновых и норадреналиновых нейронов. Для него характерно депрессивное настроение, утрата интересов или возможности ощущать удовольствие, нарушения сна, переживания собственной ненужности, пессимизм и тревога. В свете таких данных можно было объяснить, почему милнаципран не стал лучшим антидепрессантом для лечения острой тяжелой депрессии. Получалось, что его терапевтическая активность адресована не столько ключевому проявлению депрессии — сниженному настроению, сколько менее специфичным для депрессивного состояния симптомам (психомоторная заторможенность, утрата концентрации внимания, отсутствие энергии, утомление, усталость). Зато та же особенность механизма действия милнаципрана позволила рекомендовать его для лечения больных с нарушениями социальной адаптации, которые наблюдаются как в структуре самой депрессии, так и ее резидуальных (остаточные) симптомов. Подобные рекомендации явно не были перспективными для клинического использования милнаципрана при депрессии. Поэтому в дальнейшем большинство публикаций оказались связанными с применением антидепрессанта при фибромиалгии (это показание было закреплено за милнаципраном в США в 2009 г.).
Фибромиалгия представляет собой ревматологическое заболевание, диагностические критерии которого неоднократно менялись на протяжении 110-летней истории [14]. Например, еще 5 лет назад для выявления данной патологии использовали чувствительные — триггерные точки, расположенные на определенных мышцах тела. Однако в 2010 г. от этих точек отказались и распространили возможность установления этого диагноза и на пациентов с менее интенсивными болями. В то же время критерии дополнили за счет различных соматических симптомов и когнитивных нарушений («фибротуман» в голове).
В результате диагностические критерии фибромиалгии приобрели следующий вид [15]. У пациента должны определяться 3 признака: 1) болевой индекс (БИ) >7 и общий счет по шкале тяжести симптомов (ШТС) >5 или БИ 3—6 и ШТС >9; 2) симптомы должны быть представлены на одном уровне, по крайней мере, в течение 3 мес; 3) у пациента не должно быть другого расстройства, способного объяснить боль.
Для расчета БИ определяют, испытывал ли больной за последнюю неделю боли в 14 симметричных (слева и справа: плечевой пояс, верхняя и нижняя части руки, бедро/ягодица и большой вертел, верхняя и нижняя части ноги, челюсти) и 5 асимметричных (грудная клетка, живот, верхняя и нижняя часть спины, шея) участках тела. Боль в каждом из этих участков оценивается в 1 балл. В дальнейшем баллы суммируются. Соответственно общий счет БИ может колебаться от 0 (минимум) до 19 (максимум).
Общий счет по ШТС включает оценку тяжести 3 основных (кроме боли) признаков (утомление, нарушение сна, когнитивные симптомы), а также степень выраженности еще 40 симптомов (миалгия, синдром раздраженной кишки, утомление/усталость, расстройства мышления или памяти, мышечная слабость, головная боль, боль/рези в животе, онемение/покалывание, головокружение, нарушение сна, депрессия, запор, боль внизу живота, тошнота, нервозность, боль в грудной клетке, расплывчатое зрение, лихорадка, сухость во рту, зуд, шумное дыхание, феномен Рейно, крапивница, звон в ушах, рвота, изжога, язвы ротовой полости, утрата/изменение вкуса, приступы, сухость в глазах, одышка, потеря аппетита, сыпь, чувствительность к свету, нарушение слуха, легкость появления синяков, облысение, учащенное мочеиспускание, болезненное мочеиспускание, спастическая кровоточивость). Каждый из 3 основных признаков должен быть оценен пациентом по шкале: 0 баллов (нет нарушений); 1 балл (легкие и незначительные нарушения, обычно малозаметные или преходящие); 2 балла (умеренной выраженности и значительные нарушения, много раз появляющиеся, и/или постоянные умеренной выраженности); 3 балла (тяжелые нарушения, постоянные, длительные, угрожающие жизни). В итоге по этому разделу ШТС больной может набрать от 0 до 9 баллов. Для определения тяжести 40 симптомов предлагается другая шкала: 0 баллов (нет симптомов); 1 балл (мало симптомов — от 1 до 5); 2 балла (умеренное число от 5 до 10 симптомов); 3 балла (большое число — более 10 симптомов). Соответственно по этому разделу ШТС пациент может набрать от 0 до 3 баллов. Таким образом, окончательная оценка по ШТС колеблется от 0 до 12 баллов.
Что касается милнаципрана, то возможность его использования при фибромиалгии обосновывалась с помощью концепции повышения чувствительности ЦНС к боли и нарушения ее модуляции [16]. Известно, что двумя ключевыми нейромедиаторами в путях проведения боли являются серотонин и норадреналин. ТЦА, ингибирующие обратный захват серотонина и норадреналина и увеличивающие их концентрацию в ЦНС, эффективны при лечении фибромиалгии. Однако длительное использование ТЦА ограничено из-за проблем с плохой переносимостью. Вот почему для лечения фибромиалгии были рекомендованы новые СИОЗСН, в частности милнаципран [17]. Общий эффект от применения милнаципрана был оценен как достоверный, но умеренный [18]. В суточной дозе 100 мг или 200 мг он снижал выраженность боли на 30% и более2 у 40% больных фибромиалгией [19]. Были определены случаи, когда лечение фибромиалгии милнаципраном является предпочтительным. В частности, к антидепрессанту следует прибегать, если в клинической картине заболевания отмечаются выраженные симптомы упоминавшегося выше норадреналинового кластера: утрата энергии, утомляемость, усталость, сопровождающиеся ограничением повседневной активности [20, 21].
Было также установлено, что милнаципрам следует назначать при жалобах на интенсивную боль [20]. Причем эффективность милнаципрана в этой ситуации оказалась связана с новыми, неизвестными ранее, аспектами механизма действия препарата. Последний блокирует NMDA-рецепторы, расположенные на глутматных нейронах задних рогов спинного мозга, которые вовлечены в процессы усиления боли [22, 23]. Одним из таких процессов является так называемый феномен взвинчивания — прогрессивное усиление болевых ощущений в ответ на повторные и ритмические стимулы одинаковой интенсивности, достигающие чувствительных глутаматных нейронов. Эти нейроны в свою очередь активируют близлежащие, что проявляется расширением области гипералгезии с распространением ее на участки кожи, иннервируемые соседними нервами (феномен вторичной гипералгезии). Кроме того, повышение возбудимости нейронов задних рогов ведет к снижению болевого порога [24]. При этом болезненные ощущения появляются в ответ даже на тактильное раздражение, которое в норме вообще не сопровождается какими-либо жалобами (феномен аллодинии).
Приведенные данные о механизме действия милнаципрана при фибромиалгии обусловили оживление интереса к проблеме использования этого антидепрессанта у больных депрессией. Дело в том, что глутаматные нейроны принимают участие не только в регуляции процессов, связанных с восприятием боли. Еще одной функцией этих нейронов, расположенных уже не в спинном, а в головном мозге, является торможение дофаминовых нервных клеток [25]. Соответственно блокада NMDA-рецепторов милнаципраном будет сопровождаться двойным эффектом. С одной стороны, снижением активности глутаматных нейронов, а с другой, растормаживанием — дофаминовых. В результате милнаципран, не являясь ингибитором обратного захвата дофамина [26], оказывается способным (хотя и косвенным образом) активизировать дофминовую систему, что неоднократно отмечалось в соответствующих экспериментальных исследованиях [27, 28].
Сочетание у милнаципрана способности действовать на норадреналиновые и дофаминовые нейрохимические системы обусловливает его эффективность при одном из трех основных вариантов сниженного настроения, которые наблюдаются при депрессиях (табл. 3) — при падении активности дофаминовых и норадреналиновых нейронов. Для этого варианта характерно ослабление положительных эмоций: подавленность, безрадостность, утрата интересов и желаний, безнадежность, неуверенность. Кроме того, милнаципран, как о том уже упоминалось ранее, может использоваться и при наличии симптомов депрессии, указывающих на падение активности норадреналиновых нейронов (психомоторная заторможенность, утрата концентрации внимания, энергии, утомление, усталость).
Таблица 3. Основные варианты сниженного настроения при депрессиях [29] Примечание. ДА — дофаминовые, НА — норадреналиновые, СЕ — серотониновые.
Таким образом, милнаципран показан для фармакотерапии депрессий, в патогенез которых вовлечены дофаминовые и норадреналиновые нейрохимические системы. Клинически речь идет об апатических, ангедонических, адинамических и астенических депрессиях. С учетом того, что все они являются потенциальной мишенью для милнаципрана, их адекватно объединить в один тип депрессий, опираясь на наличие буквы «а» в названии: соответственно, апатические, ангедонические, адинамические и астенические депрессивные состояния могут быть обозначены как «депрессии А-типа».
Из табл. 4 видно, что далеко не все антидепрессанты способны активизировать дофаминовые и норадреналиновые нейроны. В частности, такого эффекта нет у большинства препаратов — кломипрамина, венлафаксина (в средних и низких суточных дозах), дулоксетина, миртазапина, мапротилина, миансерина, сертралина, циталопрама, эсциталопрама, пароксетина, флуоксетина, флувоксамина. Соответственно механизм действия перечисленных антидепрессантов неадекватен особенностям патогенеза депрессий А-типа.
Таблица 4. Основные эффекты и механизмы действия антидепрессантов [29] Примечание. * — венлафаксин в высоких дозах (>225 мг/сут), ** — венлафаксин в средних дозах (150—225 мг/сут), *** — венлафаксин в низких дозах (<150 мг/сут), **** — нейроны: ДА — дофаминовые, НА — норадреналиновые, С — серотониновые, ГИ — гистаминовые, АЦ — ацетилхолиновые.
Но и при способности к активизации дофаминовых и норадреналиновых нейронов фармакологические свойства антидепрессанта могут включать ряд «неудобных» моментов (см. табл. 4). Так, амитриптилин, имипрамин и венлафаксин способствуют усилению активности серотониновых нейронов. Между тем они способны тормозить (хотя и умеренным образом) функцию норадреналиновых и дофаминовых нейронов [25]. Но чем эффективнее перечисленные антидепрессанты действует на обмен серотонина, тем они слабее действуют в отношении норадреналина и дофамина в ЦНС. Соответственно данный механизм действия также не совсем подходит для уже упоминавшихся особенностей патогенеза депрессий А-типа. Кроме того, амитриптилин, имипрамин и тразодон тормозят норадреналиновые, гистаминовые и ацетилхолиновые нейроны (см. табл. 4), обладая седативными свойствами. Между тем при депрессиях А-типа часто наблюдается двигательная и идеаторная заторможенность, утомляемость, слабость и др. Легко представить себе, как в этой ситуации седативный эффект препарата будет способствовать усугублению указанных жалоб, а следовательно, затруднит осуществление фармакотерапии.
Наконец, при подборе антидепрессанта на основании его механизма действия следует учесть, как именно он активизирует норадреналиновые и дофаминовые нейроны. Например, агомелатин и тразодон делают это за счет влияния на рецепторы. Между тем такой механизм действия не самый эффективный. Считается, что непосредственное влияние на обмен моноаминов способствует большей фармакологической активности антидепрессанта [29].
Из изложенного выше вытекает, что механизм действия милнаципрана лучше всего подходит к особенностям патогенеза депрессий А-типа. Так этот препарат (в отличие от кломипрамина, венлафаксина в средних и низких суточных дозах, дулоксетина, миртазапина, мапротилина, миансерина, сертралина, циталопрама, эсциталопрама, пароксетина, флуоксетина, флувоксамина) повышает активность дофаминовых и норадерналиновых нейронов. Милнаципран (в отличие от амитриптилина, имипармина и венлафаксина) не способен на выраженную активизацию серотониновых нейронов, но его воздействие на дофаминовые и норадреналиновые нервные клетки в этом случае может быть полнее. Милнаципран (в отличие от амитриптилина, имипрамина и тразодона) не тормозит норадреналиновые, гистаминовые и ацетилхолиновые нейроны и не обладает седативными свойствами. В связи с этим он должен лучше переноситься больными. И наконец, милнаципран (в отличие от агомелатина и тразодона) влияет на норадреналиновые нейроны посредством влияния на их обмен, а не через рецепторы. Иными словами, используется более эффективный механизм действия.
Представленные данные о фармакологических свойствах милнаципрана позволяют рассматривать его в качестве препарата первого выбора при лечении депрессий А-типа. Но это должно быть подтверждено в специальных исследованиях, выполненных по единому протоколу, в нескольких сертифицированных центрах с использованием методов рандомизации наблюдений и двойного слепого контроля результатов.
Завершая настоящий обзор литературы, следует остановиться на перспективах использования милнаципрана в нашей стране. Единственным зарегистрированным в России показанием для этого антидепрессанта являются депрессивные расстройства различной степени тяжести3. Очевидно, что такая формулировка позволяет широко использовать милнаципран при лечении депрессий А-типа, распространенность которых, к сожалению, еще не изучена. Однако, по некоторым данным, они часто встречаются как при аффективных расстройствах (включая биполярное), так и при шизофрении [29]. Кроме того, депрессии А-типа часто встречаются в неврологической практике у пациентов с хронической ишемией мозга [30] и болезнью Альцгеймера [31]. В то же время в нашей стране отсутствует второе показание для назначения милнаципрана при фибромиалгии. Как уже говорилось выше, это обусловлено не столько сомнениями в эффективности антидепрессанта, сколько отношением к самому диагнозу, который в клинической практике фактически не используется. Некоторые авторы [32] предполагают, что это происходит из-за необычности проявлений болезни и отсутствия четких диагностических критериев. Но возможны и другие объяснения сложившейся ситуации.
Считается, что фибромиалгия клинически неотличима от неврастении [14]. Во всяком случае диагностические критерии этих расстройств сходны. Чтобы убедиться в этом, достаточно посмотреть на основные признаки неврастении в МКБ-10. Так, для этого расстройства характерны постоянные жалобы на повышенную утомляемость после умственной работы или слабость в теле и истощение после минимальных усилий, а также по крайней мере два симптома из списка (ощущение мышечных болей, головокружение, головная боль напряжения, нарушение сна, неспособность расслабиться, раздражительность, диспепсия). По этим признакам фибромиалгия в России вполне может диагностироваться как неврастения. Этот диагноз в нашей стране, по данным Е.В. Калининой [33] устанавливается у 9% пациентов из числа тех, кто впервые обратился за психиатрической помощью. Причем подчеркивается, что между началом заболевания и первой консультацией психиатра обычно проходит более 5—6 лет, когда больные наблюдаются терапевтами, неврологами и другими специалистами.
В представленной ситуации не стоит рассчитывать на быструю разработку новых показаний для применения милнаципрана с учетом возможности его использования при фибромиалгии. В связи с этим достаточно большое число пациентов не смогут получить эффективную терапию милнаципраном. Единственным исключением могут быть лишь те больные, у которых клиническая картина фибромиалгии сопровождается депрессией.
Причины различий в сведениях о механизме действия милнаципрана представляют собой самостоятельную проблему и не анализируются в настоящем обзоре. Укажем лишь, что они связаны с многообразием экспериментальных методик и возможностей отбора материалов нервной ткани [11, 12].
Этот уровень эффекта считается клинически значимым.
Инструкция по медицинскому применению препарата иксел https://grls.rosminzdrav.ru/InstrImg.aspx?idReg=21215&t=&isOld=1
Особые указания по применению препарата Миртазапин
Результаты экспериментальных исследований свидетельствуют об отсутствии тератогенного эффекта, однако клинические данные об эффективности и безопасности применения миртазапина в период беременности и кормления грудью отсутствуют. С осторожностью назначают препарат больным с эпилепсией и органическими поражениями мозга, с нарушениями функции печени и/или почек, пациентам со стенокардией и/или недавно перенесенным инфарктом миокарда, с нарушениями сердечной проводимости, с артериальной гипотензией, с нарушениями мочеиспускания при гипертрофии предстательной железы, больным с острой закрытоугольной глаукомой и повышенным внутриглазным давлением, с сахарным диабетом. При применении миртазапина у больных с шизофренией или другими психотическими расстройствами могут усилиться психотические симптомы, бредовые переживания. При лечении депрессивной фазы биополярных аффективных расстройств это состояние может перейти в фазу мании. Следует иметь в виду, что при развитии в период приема миртазапина таких симптомов, как лихорадка, боль в горле, стоматит, лечение следует немедленно прекратить. Резкая отмена миртазапина после длительного применения может привести к появлению тошноты, головной боли и к общему ухудшению самочувствия. В период лечения миртазапином следует воздерживаться от употребления алкоголя. С осторожностью назначают миртазапин пациентам, занимающимся потенциально опасными видами деятельности, требующими повышенного внимания и быстроты психомоторных реакций (в том числе управление транспортными средствами).