При различных проблемах с мозговым кровообращением, патологий со стороны сердечно-сосудистой системы и ЦНС возникает необходимость в использовании ноотропов.
Одним из популярных средств является Глиатилин.
Состав
Основу состава представляет химическое соединение холина альфосцерат.
Область действия компонента распространяется на холиновые рецепторы в ЦНС.
Чтобы средство лучше усваивалось организмом, действующее вещество дополнено:
- эзитолом;
- этилпарагидроксибензоат натрием;
- желатином;
- пропилпарагидроксибензоат натрием;
- сорбитансом;
- метагидроксидом;
- диоксидом титана, железа.
Для изготовления жидкой формы действующий компонент дополняется глицерином и жидкостью в виде очищенной воды.
Цена на препарат Глиатилин
В отсутствии в аптеке Глиатилина препарат можно заменить не менее действенными аналогами с тем же действующим веществом:
- Холина альфосцерат. Продается в форме раствора для внутримышечного или капельного введения. Каждая ампула содержит 250 мг/мл активного вещества, ампулы по 4 мл каждая. В упаковке 10 штук. Стоимость этого аналога немного превышает 550 рублей за упаковку.
- Ноохолин Римфарм. Ампулы не отличаются по объему и содержанию действующего вещества. В упаковке, как правило, 3 ампулы, стоимость препарата в описанной дозировке от 350 рублей за упаковку.
- Церетон. Выпускается в капсулах, каждая единица дозы содержит 400мг активного компонента. Упаковка из 56 капсул стоит в среднем 1400 рублей. Раствор для внетривенного и внутримышечного введения фасуется по ампулам, объемом 4 мл, каждая из которых содержит 0,25мл вещества. Упаковку из 5 ампул можно купить за 580 рублей.
- Холитилин 400мг. Продается в капсулах, по 28 или 14 штук в упаковке. Дозировка и количество приемов не отличается от прописанной схемы для приема Глиатилина. Стоимость упаковки, содержащей 14 доз, варьируется от 405 рублей.
- Церепро. Его можно встретить как в ампулах, так и в капсулах. Количество действующего вещества в 1 дозе не отличается от того, что содержится в аналогах. Упаковка из 28 капсул продается по цене от 1000 рублей.
Фармакология
Терапевтический эффект с высокой результативностью обеспечивается благодаря физическим и химическим свойствам составляющих химических соединений.
Среди основных:
- влияние на системный кровоток путём ускорения кровообращения;
- активизация обменных функций;
- стимулирование ретикулярной формации;
- восстановление утерянного функционала при разного рода травмах (при повреждении мозговых тканей).
Ноотроп корректирует факторы инволюционного психоорганического синдрома.
Этот процесс основан на подавлении холинергической активности, в результате чего меняется количество фосфолипидов в нейроновых мембранах.
Холина альфосцерат беспрепятственно проходит сквозь морфологические структуры мозга, наращивая концентрацию активного компонента преимущественно в тканях головного мозга, печени и лёгких. Под воздействием обменных процессов вещество преобразуется в диоксид углерода, после чего выводится из организма с помощью кишечника и почек.
Принцип действия Глиатилина
Действие препарата направлено на нейронные связи в мозге человека. Всосавшись в кровь, действующее вещество, альфосцерат холина, достигает головного мозга, где вступает в химические реакции. В результате образования связей происходит высвобождение глицеролфосфата и холина. В процессе биотрансформации происходит синтез фосфатидилхолина и ацетилхолина. Первое вещество повышает эластичность клеточных мембран и их пропускную способность. А второе вещество является одним из самых главных нервных медиаторов.
Прием Глиатилина активирует процессы кровообращения в мозге, что обеспечивает скорое восстановление утраченных функций. Выводится большая часть вещества системой дыхания, вместе с углекислым газом. Остатки – с продуктами жизнедеятельности.
Цена и формы выпуска
Стоимость лекарства зависит от формы выпуска и дозировки:
- Капсулы (400 мг, 14 шт.) – цена в диапазоне 720-780 руб.
- Раствор для приёма внутрь (600 мг/7 мл, 10 ед.) – цена 520 руб.
- Инъекционная жидкость (1000 мг, ампулы 4 мл, 3 ед.) – цена в диапазоне 565-630 руб.
Купить ноотропное средство доступно как в сети аптек, так и интернет-магазине.
Одним из главных условий отпуска фармакологического продукта является наличие рецепта.
При оформлении заказа через интернет-аптеку возможен вариант приобретения лекарства без рецептурного листа.
Способ применения и дозы
Инъекции: в/м или в/в (капельно).
Капсулы: внутрь, до еды.
Взрослым, при острых состояниях: в/м — в дозе 1000 мг/сут (1 амп.) или в/в — 1000–3000 мг/сут. При в/в введении содержимое 1 амп. (4 мл) разводят в 50 мл физиологического раствора, скорость инфузии — 60–80 капель в минуту. Продолжительность лечения — обычно 10 дней, но при необходимости лечение можно продолжать до появления положительной динамики и возможности перейти на прием внутрь капсул.
При хронической цереброваскулярной недостаточности, изменениях в эмоциональной и поведенческой сфере и мультиинфарктной деменции: внутрь — по 400 мг (1 капс.) 3 раза в сутки.
Продолжительность терапии — 3–6 мес.
Показания к применению
В медицине ноотропное лекарство используется при следующих патологиях:
- нарушения зрительной памяти, речевых функций;
- синдромы, характеризующиеся снижением интеллекта, памяти и других дегенеративных разрушений (когда причиной их развития является цереброваскулярная недостаточность);
- снижение познавательной деятельности, слабоумие.
Препарат проявляет высокую эффективность при коррекции психоэмоционального состояния, нарушениях в поведении, других патологий ЦНС.
Глиатилин включается в комплексную терапию для устранения последствий, возникающих при черепно-мозговых травмах (в острой фазе), когда у пациента отмечается потеря сознания, состояние комы, выражена очаговая полушарная симптоматика.
Другое применение лекарства:
- при инсультах для снятия острых симптомов;
- для реабилитации после приступа инсульта (способствует восстановлению физических навыков и сознания).
Нейропротектор используется также в терапии для детей.
Считается обоснованным применение лекарства при следующих проблемах:
- неврозах, нервном тике;
- аутизме;
- СДВГ;
- гидроцефальном синдроме;
- ДЦП;
- при задержке психического развития, ЗРР;
- при родовых травмах мозга;
- при родовой гипоксии.
Инструкция по применению
Инъекционная жидкость разработана для ввода лекарства с помощью иглы в/в или в/м способом.
Внутривенные уколы (капельницы) выполняются с предварительным растворением 1 ампулы лекарства с 50 мл физраствора.
Скорость движения жидкости по системе – 80 капель/мин.
- Лечение острых форм заболеваний начинается с внутримышечных инъекций. Суточная норма средства составляет 600-1000 мг. Иногда рационально применять внутривенное введение лекарства (до 3000 мг).
- Как только отмечается положительная динамика в состоянии пациента, осуществляется переход на таблетки. На это требуется в среднем 5-10 дней.
Разработкой схемы терапии, определением дозировки занимается исключительно медперсонал. Также врач имеет право вносить при необходимости корректировки в лечебный процесс.
Нейропротектор в капсулах принимается перорально. Время приёма – за 40-60 минут перед едой.
Схема терапии предусматривает 2-3 кратное употребление лекарства по 1 таблетке на протяжении 3-6 месяцев (продолжительность курса зависит от этиологии заболевания, интенсивности его развития, состояния пациента).
Инструкция по применению для детей:
- приём средства лучше перенести на утро перед завтраком;
- запивать целую таблетку нужно только очищенной водой (100-150 мл);
- при назначении капельных в/в инфузий препарат предварительно разбавляется физиологическим раствором;
- в/м уколы делают в мышечную ткань (чаще задействуется плечевая или бедренная часть);
- время проведения инъекций – до 12-14 часов.
При ЧМТ рекомендовано использовать по 1 ампуле в день на протяжении 1 недели. После этого осуществляется переход на капсулы (по 1 ед. дважды в сутки на протяжении 2-х месяцев).
Продолжительность терапии родовой травмы/гипоксической энцефалопатии проводится около полугода. На протяжении 10-12 дней инъекции ставятся раз в день (1-2 мл). Суточная норма для детей 1-3 лет может увеличиваться до 2-3 мл, для возрастной группы более 3-х лет – 4 мл. Следующий этап терапии – применение таблетированного средства. Капсулы употребляют по схеме: по 1 шт. 2 раза в день. Через 2-3 месяца лечение может корректироваться специалистом, под наблюдением которого находится пациент.
Пациенты и методы
В соответствии с целью наблюдательной программы нами за период с февраля по август 2021 г. на базе сурдологического отделения ГБУЗ «Научно-исследовательский клинический институт оториноларингологии им. Л.И. Свержевского» ДЗМ проведено обследование и лечение 40 больных с двусторонней хронической НСТ, возникшей на фоне цереброваскулярной патологии.
Длительность заболевания составила от 4 до 15 лет (в среднем 6,7±2,42 года); возраст больных — от 49 лет до 72 лет (в среднем 63,4±2,53 года), женщин было 28, мужчин — 12.
Основными критериями включения
больных в исследование были: 1) возраст больных 40 лет и старше; 2) наличие у пациента двусторонней НСТ (симметричное или асимметричное повышение порогов слуха на оба уха по костному и воздушному звукопроведению) сосудистой этиологии, субъективного непульсирующего шума в ушах; 3) информированное согласие пациента на участие в клинической наблюдательной программе; 4) способность пациента к адекватному сотрудничеству.
Критериями исключения
пациентов до начала терапии были: 1) признаки дисфункции слуховых труб; 2) смешанная форма тугоухости; 3) беременность и лактация; 4) индивидуальная непереносимость активного вещества и вспомогательных компонентов препарата Глиатилин; 5) острые и хронические заболевания в стадии обострения со стороны других органов и систем. Индивидуальная непереносимость, а также все виды аллергических реакций в связи с приемом препарата Глиатилин, усиление тиннитуса и ухудшение слуха вне зависимости от причинно-следственной связи с приемом Глиатилина, некомплаентность пациента являлись критериями исключения пациентов из наблюдательной программы в период лечения.
Всем больным мы провели комплексное обследование, включающее оториноларингологическое, аудиологическое, отоневрологическое, неврологическое, а также магнитно-резонансную томографию головного мозга и компьютерную томографию височных костей.
Оториноларингологическое обследование включало сбор жалоб, анализ анамнеза заболевания и жизни, а также осмотр ЛОР-органов (передняя и задняя риноскопия, ороскопия, мезо- и гипофарингоскопия, непрямая ларингоскопия, отоскопия (диагностический и терапевтический ЛОР-комбайн BASIC PLUS, , Germany). Всем больным проводили отомикроскопию при помощи операционного микроскопа (исследовательский и операционный микроскоп Spectra 500, , Germany) с 8- и 16-кратным увеличением (0, 10, 40, 70, 100-й дни исследования).
При исследовании в динамике изучали следующие показатели:
1. Субъективную оценку ушного шума в баллах по шкалам Tinnitus Handicap Inventory (THI) и визуальной аналоговой шкале (ВАШ) от 0 до 10 баллов (0, 10, 40, 70, 100-й дни исследования).
2. Результаты субъективных и объективных методов исследования состояния слухового анализатора: речевое (шепотная и разговорная речь) и камертональное (камертоны С128, С512; пробы Вебера, Ринне, Федеричи, Бинга) исследования; тональную пороговую и речевую аудиометрию, шумометрию («метод сравнения и перекрытия») (аудиометр GSI-61, Grason-Stadler, Inc., США), акустическую импедансометрию (аудиометр импедансный Titan, Interacoustics, Дания) (0, 10, 40, 70, 100-й дни исследования).
3. Оценку неврологического статуса пациентов: интенсивность головных болей, патологию черепной иннервации, пирамидные знаки, мозжечковые знаки, эмоциональные расстройства, нарушение памяти, нарушение сна (0, 10, 40, 70, 100-й дни исследования).
4. Оценку тревожности и депрессивности по шкалам Гамильтона и симптоматическому опроснику SCL-90 (0, 10, 40, 70, 100-й дни исследования).
5. Оценку когнитивных функций согласно Монреальской шкале (Мока-тест) (0, 10, 40, 70, 100-й дни исследования).
6. Выявление и регистрацию побочных эффектов препарата (0, 10, 40, 70, 100-й дни исследования).
Всем пациентам проводили комплексную терапию с включением препарата Глиатилин. Все пациенты были разделены на две группы в зависимости от способа применения препарата Глиатилин:
1-я группа (20 человек) получали раствор Глиатилин 3 мл внутривенно капельно в течение 10 дней, далее капсулы глиатилин 400 мг 3 раза; 2-я группа (20 человек) получали раствор Глиатилин 3 мл внутривенно капельно в течение 10 дней, далее раствор для приема внутрь 600 мг 2 раза в день в течение 3 мес.
Побочные проявления
В процессе проведённого исследования по изучению действия холина альфосцерата на организм человека были выявлены редкие случаи побочных проявлений.
На начальном этапе терапии могут появиться тошнота, лёгкая спутанность сознания, боль в эпигастрии.
О неприятных симптомах информируется врач, у которого пациент наблюдается. Специалист скорректирует дозу, подберёт аналог, внесёт другие изменения в лечебный курс.
Инсульт является одной из ведущих причин смертности и инвалидизации населения [1, 2]. Рост заболеваемости инсультом связан с ведущими факторами риска — сердечно-сосудистой патологией, хроническим стрессом, нарушением питания, вредными привычками, старением населения и др. [1].
Наиболее эффективным методом лечения ишемического инсульта в первые часы заболевания является тромболитическая терапия. Однако частота ее выполнения остается низкой и не превышает 10% (в большинстве стран Европы данный показатель составляет приблизительно 3%), что во многом связано с узкими временны`ми рамками «терапевтического окна» [15]. В связи с этим актуальны исследования, направленные на изучение возможных механизмов продления жизни мозговой ткани в зоне ишемической полутени и, соответственно, увеличение терапевтического окна, а также на определение тактики лечения пациентов, по тем или иным причинам не подлежащих проведению тромболизиса.
Нейропротекторная терапия рассматривается как одно из перспективных направлений комплексного лечения пациентов с острым нарушением мозгового кровообращения (ОНМК) [14]. К настоящему времени проведено большое число исследований, посвященных применению нейропротекторных препаратов у больных с ишемическим инсультом, однако их результаты неоднозначны [5-7, 13, 16]. Можно предположить, что причиной являются недостатки дизайна проведенных клинических исследований: выбор неадекватного терапевтического окна, нецеленаправленный отбор пациентов с учетом патогенетического варианта инсульта и других особенностей заболевания, использование заведомо недостаточных дозировок препаратов и длительности их приема, выбор конечных точек с низкой чувствительностью и переоценка возможного эффекта терапии [8, 10]. В связи с этим в современных клинических рекомендациях по лечению острых неврологических заболеваний нейропротекторная терапия не рекомендуется к использованию. В то же время на основании эмпирического опыта, а также в рамках собственных протоколов, во многих лечебных учреждениях препараты с нейропротекторной активностью находят широкое применение.
Одним из препаратов, обладающих нейропротекторным и нейротрофическим действием, является холина альфосцерат (глиатилин). При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат. Холин участвует в биосинтезе ацетилхолина — одного из основных нейромедиаторов, глицерофосфат является предшественником фосфолипидов (фосфатидилхолина) мембраны нейрона. Таким образом, глиатилин усиливает церебральную холинергическую проводимость и положительно воздействует на пластичность нейрональных мембран [11]. Накоплен определенный опыт применения холина альфосцерата у пациентов, перенесших ОНМК, однако данных о его влиянии на процесс реабилитации пациентов с инсультом пока недостаточно [3, 4, 9, 11, 12, 14].
Цель настоящего исследования — оценка влияния холина альфосцерата на динамику восстановления утраченных функций и конечные результаты нейрореабилитационных мероприятий у пациентов с полушарным ишемическим инсультом.
Материал и методы
Обследованы 60 пациентов, 37 мужчин и 23 женщины (средний возраст — 64,7±15,2 года) в острейшем периоде полушарного ишемического инсульта.
Пациенты были рандомизированы в 2 группы по 30 человек в каждой. Обе группы были сопоставимы по полу, возрасту, тяжести заболевания, сопутствующей патологии. Пациенты 1-й (основной) группы помимо унифицированной терапии инсульта получали внутривенные инъекции глиатилина по 1000 мг в сутки в течение 10 дней с последующим переходом на пероральный прием препарата в виде капсул по 400 мг 3 раза в день в течение 20 дней. Терапия глиатилином была начата не позднее 12 ч с момента развития инсульта. 2-ю группу (сравнения) составили пациенты, не получавшие глиатилин.
Унифицированная терапия инсульта включала: коррекцию респираторных нарушений, артериального давления, уровня глюкозы, водно-электролитного баланса, температуры тела, питания, вторичную профилактику (антитромботическая, гиполипидемическая, антигипертензивная терапия, коррекция других факторов риска) и комплексное восстановительное лечение (лечебная физкультура с максимально ранней вертикализацией, физиотерапия, массаж, роботизированная механотерапия, занятия с логопедом и нейропсихологом).
Все пациенты при поступлении были обследованы по стандартной схеме. Диагноз ишемического инсульта верифицировали данными КТ/МРТ головного мозга. Патогенетический вариант уточняли с помощью лабораторных тестов, дуплексного сканирования брахиоцефальных артерий, транскраниальной допплерографии, билатерального допплеровского мониторинга средней мозговой артерии с эмболодетекцией, ЭКГ, в том числе с холтеровским мониторированием эхокардиографии. Оценку тяжести неврологического дефицита проводили по шкале NIHSS, оценку функционального состояния — по шкале Рэнкина и данным нейрофизиологических методов исследования (ЭЭГ, соматосенсорные вызванные потенциалы — ССВП в 1, 10, 20 и 30-е сутки терапии.
Больных, которым была выполнена тромболитическая терапия, в исследование не включали.
Результаты
После 30-дневного курса терапии было проведено сравнение тяжести состояния и степени функционального восстановления у пациентов двух групп. После 30-дневного курса лечебных мероприятий тяжесть инсульта по шкале NIHSS уменьшилась на 50,8% (с 12,8±4,6 до 6,1±1,2 балла, р
<0,05) у пациентов 1-й группы и на 36,8% (с 12,1±5,8 до 9,1±1,8 балла,
р
>0,05) у пациентов 2-й группы. Разница исходных и конечных показателей была достоверна (
р
<0,05) только в группе пациентов, получавших глиатилин.
При изучении динамики функционального состояния по шкале Рэнкина на 30-е сутки отмечалось улучшение показателей на 45,4% (с 3,9±0,2 до 2,0±0,5 балла, р
>0,05) у пациентов 1-й группы и на 34,5% (с 3,6±0,3 до 2,4±0,5 балла,
р
>0,05) у пациентов 2-й группы.
Пациенты 1-й группы статистически значимо чаще достигали поставленных реабилитационных целей (р
<0,05). Так, реабилитационные задачи были достигнуты после проведенной комплексной терапии у 79% пациентов 1-й группы (33% перемещались самостоятельно, 41% перемещались с посторонней помощью или с использованием ходунков, 14% были адаптированы к инвалидной коляске, 12% оставались прикованными к кровати) и только у 38% пациентов 2-й группы (15% перемещались самостоятельно, 25% перемещались с посторонней помощью или с использованием ходунков, 39% были адаптированы к инвалидной коляске, 21% оставались прикованными к кровати).
Исследование ССВП после проведения терапевтических мероприятий у пациентов двух групп выявило увеличение амплитуды и уменьшение латентности коркового ответа N20. Данные изменения были более выражены в 1-й группе, однако различия не достигли уровня статистической значимости (табл. 1)
.
При проведении транскраниальной магнитной стимуляции до начала терапевтических мероприятий у всех пациентов в зоне пораженного полушария вызывался непостоянный корковый ответ со сниженной амплитудой меньше 1,5 мкВ. На 30-й день терапии у пациентов 1-й группы корковый ответ регистрировался более регулярно и амплитуда его возросла до 2-2,5мкВ. У пациентов 2-й группы амплитуда коркового ответа увеличилась незначительно (до 1,6-1,7 мкВ).
У 27 (90%) пациентов 1-й группы к 10-м суткам заболевания определялась наиболее полная нормализация паттерна ЭЭГ в виде достоверного регресса межполушарной асимметрии в α-диапазоне и минимальной выраженности медленноволновой активности в проекции очага ишемии мозга. У пациентов 2-й группы даже на 20-30-е сутки были выявлены остаточные изменения в виде стойкого очага медленных волн в проекции ишемии, межполушарная асимметрия в α-1-диапазоне с преобладанием мощности в интактном полушарии.
По данным контрольной допплерографии, у пациентов двух групп на 30-е сутки отмечалось повышение линейной скорости кровотока (ЛСК) и снижение индексов периферического сосудистого сопротивления на стороне очага поражения, что свидетельствует об усилении перфузии в аффектированном сосудистом бассейне. Несмотря на то что данные изменения не достигли уровня статистической значимости, подобная тенденция была более выражена у пациентов 1-й группы (табл. 2)
.
Проведенное исследование показало, что применение холина альфосцерата (глиатилин) не позднее 12 ч с момента развития ишемического инсульта приводит к достоверному регрессу тяжести неврологической симптоматики и достижению поставленных реабилитационных целей. Более выраженное повышение церебральной перфузии в пораженном сосудистом бассейне на фоне приема холина альфосцерата может быть следствием нейрометаболической активации и усиления пластических процессов в зоне ишемии. Стабилизация нейрофизиологических показателей на фоне приема глиатилина не достигла достоверных значений, но происходила в более короткие сроки и в большем объеме.
Таким образом, в настоящем исследовании была дана оценка эффективности ранней нейропротекторной терапии препаратом глиатилин у больных с полушарным ишемическим инсультом, а также изучена динамика клинического статуса пациентов, скорость и полнота восстановления утраченных функций, успешность решения реабилитационных задач. Кроме того, была проведена оценка церебральной гемодинамики пораженного полушария, динамика нейрофизиологических показателей (ЭЭГ, ССВП, ТМС).
Отзывы пациентов
Альбина:
На форумах встречала много информации о препарате Глиатилин, но отзывы для детей представлены скудно. Решила поделиться опытом использования ноотропа, которое я давала своему ребёнку при неврозе. Терапия длилась 4 месяца (1 капсула в день). Положительная динамика стала заметна спустя 10 дней.
Через месяц ребёнок выглядел абсолютно уравновешенным, невзирая на не всегда адекватное поведение по отношению к нему сверстников. Побочных проявлений весь лечебный период я не наблюдала.
Виктор, 37 лет:
После ЧМТ на заводе проходил серьёзное лечение с использованием нескольких препаратов. Для восстановления утраченных физических навыков и когнитивных процессов прописали Глиатилин. Через пару недель ощутил первые улучшения: исчезла раздражительность, речь стала чёткой и понятной, усилилась концентрация внимания. Никаких побочек при употреблении капсул замечено не было.
Отзывы врачей-неврологов
А. П. Степанов, стаж работы 22 года:
Глиатилин показывает высокую результативность при терапии после приступов инсульта, ЧМТ, ЦВБ. В комплексе с другими фармакологическим средствами удаётся быстро восстановить утраченный функционал, справиться с нарушениями в кровообращении головного мозга. Длительный приём лекарства снижает когнитивный дефицит.
Особенности использования ноотропа: из-за повышенной возбудимости рекомендовано принимать до обеденного времени, чтоб избежать негативного влияния на здоровый сон. Эффективность повышается при курсовой терапии, предусматривающей использование на начальном этапе инъекций, затем – капсул.
Татьяна Михайловна Кузнецова, практикующий специалист со стажем 12 лет:
Глиатилин является эффективным нейропротектором, что доказывают отзывы взрослых на форумах. Не расходятся с ними мнения врачей, используемых в своей практике психотропное средство. Высокий терапевтический эффект достигается при астении, ВСД, ДЦП и пр.
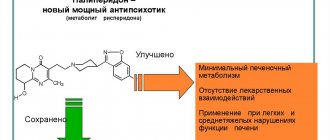
Удобным считается и наличие разных форм выпуска, что позволяет достичь желаемого результата при минимальной нагрузке на печень и почки.
Международный неврологический журнал 5 (43) 2011
В последние годы во всем мире прогрессивно возрастает количество мозговых инсультов (МИ), и в первую очередь за счет ишемических нарушений мозгового кровообращения [1–3]. В ближайшие десятилетия эксперты ВОЗ предполагают дальнейший рост количества мозговых инсультов [4–7]. Это обусловлено возрастанием в популяции населения планеты людей пожилого возраста и значительной распространенностью таких факторов риска МИ, как артериальная гипертензия, болезни сердца, сахарный диабет, ожирение, курение и др. [8–10]. Также актуальна проблема МИ в Украине, где около 110 тыс. населения ежегодно заболевает инсультом, из них 35 % людей трудоспособного возраста [11].
Инсульт является ведущей причиной смертности и инвалидизации в развитых странах мира. Только 10–20 % больных после инсульта возвращается к труду. Около 25 % инвалидизации взрослого населения обусловлено инсультом [1, 6].
Согласно данным регистров инсульта, 20–43 % больных после МИ нуждаются в постороннем уходе, у 33–48 % наблюдаются явления гемипареза, а у 18–27 % имеются афатические нарушения [8–10]. Следствием этого являются огромные экономические потери, которые, по некоторым оценкам, составляют 4 % бюджета здравоохранения развитых стран [5]. Так, например, во Франции стоимость постинсультной помощи в течение 1,5 года на одного больного составляет 19 513 евро [5].
Растет во всем мире и количество случаев хронических нарушений мозгового кровообращения, которые приводят к развитию мозгового инсульта или деменции [8, 9, 11].
Возрастающая заболеваемость мозговым инсультом и связанная с ней высокая инвалидизация определяют актуальность проблемы эффективного лечения больных с сосудистыми заболеваниями головного мозга [12, 13].
Основной целью терапии ишемического инсульта в восстановительном периоде является восстановление функциональной интеграции центральной нервной системы (ЦНС) и устранение неврологического дефицита. В этот период, когда уже сформировались морфологические инфарктные изменения в веществе головного мозга, все большее значение приобретает репаративная терапия с использованием средств, направленных на улучшение пластичности неповрежденной мозговой ткани и межнейронального взаимодействия. К таким препаратам относятся нейропротекторы, обладающие трофическими и модуляторными свойствами, усиливающие регенераторно-репаративные процессы, способствующие восстановлению нарушенных функций. Они оказывают прямое активирующее влияние на структуры головного мозга, улучшают память и когнитивные функции, а также повышают устойчивость ЦНС к повреждающим воздействиям [12, 14–16].
Основные задачи нейрореабилитации больных, которые перенесли инсульт, сводятся к восстановлению нарушенных функций, психической и социальной реадаптации пациентов, профилактике постинсультных осложнений (спастичность, контрактуры и др.). Раннее начало (в острейшем периоде), длительность и систематичность, комплексность, этапность, а также активное участие больного и членов семьи определяют успех реабилитационных мероприятий [17]. На темпы восстановления нарушенных функций влияет много различных факторов: возраст больных, тяжесть инсульта, локализация очага поражения, сопутствующие заболевания, начало реабилитационных мероприятий, время и качество оказания медицинской помощи и другие [18]. В последнее время появилось много данных, свидетельствующих о роли когнитивных и аффективных нарушений, оказывающих негативное влияние на эффективность реабилитации у постинсультных больных. Когнитивные нарушения встречаются, по данным разных авторов, у 22–77% больных в течение года от начала развития инсульта. При этом когнитивные нарушения, достигающие степени деменции, выявляются у 25–34 % больных [19–22].
Таким образом, когнитивные нарушения наряду с другими последствиями инсульта вносят существенный вклад в социальную и бытовую дезадаптацию больных после инсульта. Постинсультными когнитивными расстройствами принято называть нарушения памяти и других высших мозговых функций, которые возникли или достигли клинической значимости в первые месяцы после инсульта. Основными причинами когнитивных нарушений у больных после перенесенного мозгового ишемического инсульта могут быть поражение в результате инсульта стратегических для когнитивной деятельности отделов головного мозга, развитие мультиинфарктного состояния, обширные поражения белого вещества (лейкоареоз), сопутствующие нейродегенеративные заболевания, депрессия [23].
Когнитивные нарушения оказывают отрицательное влияние на реабилитационный процесс, усиливают инвалидизацию и значительно ухудшают качество жизни больных, а также людей, которые ухаживают за ними.
Лечение больных в постинсультном периоде является сложной задачей, обусловленной многообразием патобиохимических и патофизиологических механизмов, лежащих в его основе.
В литературе имеются данные о положительном влиянии нейропротекторов на эффективность восстановления после перенесенного инсульта [15, 16, 24, 25].
Одними из наиболее эффективных препаратов среди нейропротекторов являются производные экзогенного холина: CDP (цитиколин), GPS (холина альфосцерат (Глиатилин)), рекогнан.
Глиатилин (альфа-глицерилфосфорилхолин, аlpha- glycerylphosphorylcholine) — соединение, содержащее 40 % холина и превращающееся в организме в метаболически активную форму — фосфорилхолин, способный проникать через гематоэнцефалический барьер и активировать биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [26].
В экспериментах на животных показано, что Глиатилин предупреждает индуцированный холинергический дефицит, предотвращает развитие деменции, облегчает процессы обучения и запоминания за счет увеличения синтеза и высвобождения ацетилхолина в мозговых структурах [27].
Другим механизмом действия Глиатилина является анаболический эффект, проявляющийся в стимуляции мембранного и глицеролипидного синтеза вследствие образования предшественников фосфолипидов мембран из продуктов его метаболического распада [27, 28].
Таким образом, Глиатилин активирует холинергическую нейротрансмиссию, повышая пластичность ткани мозга, оказывает мембраностабилизирующее и антиоксидантное действие.
Нами был проанализирован ряд клинических исследований по применению холина альфосцерата у пациентов с различными сосудистыми заболеваниями головного мозга.
Пилотные клинические исследования Глиатилина в остром периоде тяжелого ишемического инсульта (внутривенные введения в дозе 1 г 3–4 раза в сутки в течение 5 дней) выявили «пробуждающий» эффект препарата (рис. 1). Отмечались уменьшение выраженности нарушений дыхания и кровообращения, улучшение показателей церебральной оксиметрии, положительная динамика стволовых вызванных потенциалов на акустическую стимуляцию, что свидетельствовало о нормализации функционального состояния ствола мозга. Отмечено также благоприятное влияние Глиатилина на психическую деятельность больных, память, восстановление речевых функций [29–33].
Особого внимания заслуживают результаты обширного мультицентрового 3-летнего исследования возможностей Глиатилина у 800 пациентов с острым ишемическим инсультом в ведущих клиниках Российской Федерации [29]. Согласно полученным результатам при введении препарата начиная с 1-х до 90-х суток (1–15-й дни — 200 мг/сутки, 15–30-й дни — 100 мг/сутки, далее — 800 мг/сутки) было выявлено, что уже к 30-му дню введения у пациентов, получавших Глиатилин, отмечалось значимое повышение способности к самообслуживанию (показатель менее 2 баллов по шкале Рэнкина), к 90-му дню достоверно чаще отмечалось снижение неврологического дефицита (выраженность менее 2 баллов по шкале NIHSS) (рис. 2). Важно подчеркнуть, что отмеченные клинические параметры улучшения коррелировали с данными нейровизуализации объема очага поражени: в группе пациентов, получавших Глиатилин, к 30-му дню отмечалось минимальное увеличение объема инфаркта мозга.
Исследование, проведенное группой итальянских ученых (F. Amenta и соавт., 2010), показало, что применение препарата Глиатилин вызывало значительное улучшение когнитивных функций у пациентов с легкой и среднетяжелой формой болезни Альцгеймера [34].
Итальянскими учеными Lucilla Parnetti, Francesco Amenta, Virgilio Gallai был проведен обзор научных данных, касающихся клинической эффективности холина альфосцерата, предшественника ацетилхолина, который применялся для лечения деменции [35].
Приведенные сведения были получены в результате обобщения данных, полученных в ходе тринадцати клинических испытаний, в которые было включено 4054 пациента с ишемическим инсультом, с различными формами сосудистой деменции, в том числе деменцией альцгеймеровского типа, а также при лечении острых нарушений мозгового кровообращения (рис. 3). Результаты этих исследований показали положительное влияние препарата Глиатилин на когнитивные функции у обследуемых больных.
Были проведены многочисленные исследования, которые продемонстрировали эффективность Глиатилина в отношении двигательных нарушений, уровня сознания, когнитивных расстройств у больных в остром периоде мозгового инсульта (рис. 4). Вместе с тем эффективность и безопасность препарата Глиатилин у больных в восстановительном периоде ишемического инсульта представляет научный интерес.
На базе отдела сосудистой патологии головного мозга ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины» было проведено открытое исследование эффективности и переносимости холина альфосцерата у больных в восстановительном периоде ишемического мозгового инсульта.
Цель исследования — определить влияние препарата Глиатилин на выраженность неврологического дефицита, показатели повседневной жизненной активности и состояние когнитивных функций в восстановительном периоде ишемического инсульта.
Задачи исследования:
1. Оценить влияние препарата Глиатилин на основные субъективные проявления заболевания у больных в постинсультном периоде.
2. Оценить динамику объективных неврологических симптомов заболевания в результате лечения Глиатилином.
3. Изучить влияние препарата Глиатилин на когнитивные функции у обследованных больных.
4. Определить влияние препарата на повседневную жизненную активность и показатели качества жизни.
5. Оценить переносимость препарата Глиатилин, выявить возможные побочные явления, в том числе проанализировать влияние терапии Глиатилином на общее состояние больных, перенесших ишемический инсульт.
В исследование было включено 20 пациентов в восстановительном периоде ишемического мозгового инсульта в возрасте 45–75 лет, которые находились на лечении в отделении сосудистой патологии головного мозга ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины». Все пациенты получали исследуемый препарат Глиатилин в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг (одна капсула) 2 раза в сутки — 2 месяца.
Для решения поставленных задач исследования в работе были применены следующие методы обследования: клинико-неврологический; психодиагностический (шкала MMSE); уровень повседневной жизненной активности, а также степень инвалидизации пациентов определялись при помощи шкалы Рэнкина; функциональное состояние больных и их способность к самообслуживанию оценивались при помощи индекса Бартель; качество жизни больных определяли с помощью опросника SF-36.
Диагноз выставлялся на основании изучения жалоб больных, данных анамнеза жизни и болезни, неврологического и соматического статуса.
Среди обследованных пациентов у 15 (75 %) больных в патологический процесс были вовлечены бассейны средних мозговых артерий, у 5 (25 %) больных — вертебробазилярный бассейн. У 8 больных очаг ишемии локализовался в правом полушарии, у 7 — в левом.
Для верификации диагноза ишемического инсульта и определения его подтипа проводили КТ или МРТ головного мозга, ультразвуковую допплерографию, дуплексное сканирование каротидных артерий и электрокардиографию. По механизму развития атеротромботический инсульт перенесли 12 больных, кардиоэмболический — 6 больных, лакунарный — 2 больных.
У больных, перенесших МИ в системе средних мозговых артерий, превалировали жалобы на слабость в контралатеральных конечностях, онемение и нарушения чувствительности в этих конечностях. У больных с левополушарными каротидными нарушениями отмечались расстройства речи в виде моторной и сенсорной, амнестической афазии. Для больных, перенесших инсульт в вертебробазилярном бассейне, были более характерны жалобы на стойкие головокружения, в основном при смене положения тела, поворотах головы, шум, звон в голове и ушах, тошноту, затруднение при глотании, дизартрию, зрительные нарушения.
При объективном исследовании у всех больных отмечалась диффузная органическая симптоматика в сочетании с очаговыми нарушениями. Превалировали глазодвигательные нарушения: слабость конвергенции, ограничение взора вверх, недостаточность отводящих нервов. У больных выявлялись асимметрия лицевой мускулатуры, нистагм при крайних отведениях, нарушения статики и координации, афатические, двигательные (разной степени выраженности), чувствительные (преимущественно по гемитипу), тонусные нарушения, анизорефлексия, преимущественно по гемитипу, снижение силы в конечностях (контралатеральных очагу поражения). Выявлялась группа симптомов: снижение корнеальных рефлексов, отечность языка с отпечатками зубов, болезненность глазных яблок при надавливании, которые расценивались как косвенные признаки ликворной гипертензии.
Кроме того, у больных обнаруживались рефлексы орального автоматизма, патологические знаки, анизокория.
Очаговая неврологическая симптоматика отвечала пораженному сосудистому бассейну, локализации ишемического очага.
Анализ субъективной и объективной неврологической симптоматики позволил выделить ведущие клинические синдромы.
Очаговые неврологические синдромы отмечались в 75 % случаев. Симптоматика соответствовала локализации ишемического очага, пораженному сосудистому бассейну.
Вестибулоатактический синдром отмечался у 80 % больных, характеризовался головокружениями, шаткостью при ходьбе, усиливающейся при взгляде на движущиеся предметы и изменении положения тела, сопровождался нарушениями статики и координации, атаксией в пробе Ромберга.
Цефалгический синдром встречался в 95 % случаев. Он характеризовался выраженностью, монотонностью и однообразием головной боли.
Ликворно-гипертензионный синдром встречался у половины больных. Он характеризовался упорными головными болями распирающего характера, с чувством давления на глазные яблоки, тошнотой и обусловливал развитие и усугубление неврологической симптоматики вторично-стволового характера (глазодвигательные нарушения, пирамидные знаки, патологические рефлексы, псевдобульбарные нарушения). Наличие гипертензионного синдрома подтверждалось данными обследования глазного дна, КТ-данными, косвенными ЭЭГ-, УЗДГ-признаками.
Астенический синдром отмечался у всех обследованных больных. Он представлен в основном в виде выраженного компонента физической и психической утомляемости и снижения сенсорной толерантности.
Нами была оценена динамика неврологических симптомов и синдромов до и после лечения препаратом Глиатилин. Как видно из данных, представленных в табл. 1, под влиянием лечения препаратом Глиатилин отмечается ослабление выраженности синдромальной неврологической симптоматики.
Как правило, соответствующие позитивные сдвиги у пациентов начинали проявляться через 2 недели лечения исследуемым препаратом, и в дальнейшем редукция неврологической и соматической симптоматики усиливалась.
Как видно из табл. 1, терапия препаратом Глиатилин способствовала существенному уменьшению количественной выраженности и встречаемости практически всего перечня объективной и субъективной симптоматики. У большинства пациентов степень выраженности жалоб снизилась от 4 баллов до 1–2 баллов, а у 2 пациентов отмечалась полная редукция предъявляемых ими жалоб.
В процессе лечения отмечалось уменьшение выраженности астенического синдрома, псевдобульбарных расстройств. У части больных наблюдалась редукция очаговых неврологических синдромов (улучшение двигательных функций, речи, вестибулоатактического синдрома).
Состояние когнитивных функций до и после лечения препаратом Глиатилин было оценено с помощью шкалы MMSE. До лечения общий показатель когнитивной продуктивности по шкале MMSE составлял 24,3 ± 1,8 балла. Имело место выраженное сужение объемов вербальной памяти и счетных операций. У обследованных больных характерными были нарушения в сфере внимания, признаки дисфункции лобных долей (импульсивность, некритичность, персеверации). Нарушения памяти у этих больных сочетались с другими когнитивными расстройствами — дефектами устойчивости и переключения внимания, нарушением критики, поведения и др. В первую очередь страдала кратковременная память, уменьшался ее объем, выявлялось повышение тормозимости следов кратковременной памяти.
Динамика показателей по шкале MMSE до и после лечения представлена в табл. 2.
Анализ динамики когнитивных функций в процессе лечения больных показал статистически значимое улучшение всех показателей когнитивной сферы (памяти, внимания, ориентации, счетных функций). У больных после лечения общий показатель когнитивной продуктивности составил 26,1 ± 1,9 балла.
Анализируя результаты психодиагностического исследования, следует отметить, что у большинства пациентов под влиянием лечения препаратом Глиатилин существенно улучшились когнитивные функции, повысилась умственная работоспособность, улучшились показатели памяти, внимания.
Балльная динамика функционального состояния больных в восстановительном периоде ишемического инсульта и их способности к самообслуживанию, оцененных с помощью индекса Бартель, представлена в табл. 3.
В начале исследования средний балл по индексу Бартель у больных в восстановительном периоде ишемического инсульта составил 55,0 ± 5,0.
На фоне проводимой терапии через 2 недели (14 ± 2 дня), а затем через 1,5 месяца (44 ± 3 дня) у всех больных наблюдалось улучшение их функционального состояния, средний показатель индекса Бартель за этот период повысился на 14,5 балла и составил 69,5 балла.
К концу лечения, через 2,5 месяца (74 ± 3 дня), индекс Бартель у обследуемых больных был в пределах 78,5 ± 2,5, он возрос по сравнению с исходным визитом на 23,5 балла.
Степень инвалидизации по шкале Рэнкина в динамике на фоне лечения препаратом Глиатилин у больных в восстановительном периоде ишемического инсульта представлена в табл. 4.
Как видно из табл. 4, в начале исследования уровень инвалидизации по шкале Рэнкина у больных в восстановительном периоде ишемического инсульта составил 3,4 ± 0,2 балла.
На фоне лечения препаратом Глиатилин отмечалось уменьшение степени инвалидизации больных, которое характеризовалось уменьшением баллов по шкале Рэнкина, что свидетельствовало об улучшении функциональных возможностей пациентов в постинсультном периоде.
Результаты клинического исследования влияния курса Глиатилина на динамику показателей качества жизни представлены в табл. 5.
В результате тестирования по всем показателям опросника качества жизни SF-36 после терапии Глиатилином параметры качества жизни были существенно выше, чем до лечения. Почти по всем базовым значениям субсфер опросника SF-36 был превышен 50-балльный барьер, что свидетельствовало о достижении пациентами лучшего качества жизни.
Так, показатель «физическая активность» (переносимость физических нагрузок) и показатель «роль физических проблем в ограничении жизнедеятельности» достоверно возросли. Пациенты отмечали повышение внутренней энергии и энтузиазма при выполнении своих обычных повседневных обязанностей. На фоне лечения Глиатилином снизилась чувствительность к некоторым проявлениям физической боли, она меньше влияла на поведение, активность и объем выполняемых работ. Пациенты также значительно выше оценивали свое общее восприятие здоровья и жизнеспособность.
Улучшение общего физического состояния оказывало положительный эффект и на осознание своего психического здоровья, так как для большинства пациентов психологический статус тесно связан с физическим и функциональным. Пациенты отмечали повышение своей социальной активности, они получали удовлетворение от возможности поддерживать контакты с окружающими. Можно говорить о снижении степени фиксации на негативных эмоциях, когда пациенты чувствовали себя бесполезными и беспомощными, и повышении возможности расширения социального и психологического мира.
В ходе настоящего клинического исследования больных в восстановительном периоде ишемического инсульта было зарегистрировано 4 случая нежелательных явлений. У одного пациента была острая респираторная вирусная инфекция, данное неблагоприятное явление не связано с приемом исследуемого препарата. У двоих пациентов отмечалась легкая тошнота, которая прошла самостоятельно без коррекции дозы препарата, у одного больного возник металлический привкус во время инфузии. Ни у одного из пациентов проявление побочного эффекта не потребовало прекращения лечения.
Препарат не оказал отрицательного влияния на основные показатели сердечной деятельности и гемодинамики (артериальное давление и частоту сердечных сокращений): по завершении исследования у больных не отмечено достоверных изменений показателей частоты сердечных сокращений и артериального давления.
Назначение исследуемого препарата не оказало также какого-либо отрицательного влияния на показатели морфологического состава периферической крови, на уровни ее основных биохимических констант, характеризующих функциональное состояние печени и почек, а также не отразилось на показателях клинического анализа мочи.
Исследование показало, что применение препарата Глиатилин в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг (одна капсула) 2 раза в сутки в течение 2 месяцев у больных в восстановительном периоде ишемического инсульта позволяет ускорить восстановление неврологических функций, в том числе уменьшить очаговую неврологическую симптоматику.
Следует отметить, что терапевтические эффекты препарата Глиатилин направлены на коррекцию нарушений высших корковых функций. Эти эффекты включают восстановление концентрации внимания и памяти, улучшение умственной и физической работоспособности, эмоционального состояния больных, улучшение когнитивных функций.
Курсовое применение препарата Глиатилин у пациентов в восстановительном периоде ишемического инсульта положительно сказывается на качестве их жизни.
Препарат хорошо переносится пациентами и не вызывает каких-либо клинически значимых побочных эффектов при длительном приеме в течение 2,5 месяца.
Таким образом, препарат Глиатилин при назначении в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, а затем 400 мг (одна капсула) 2 раза в сутки в течение 2 месяцев может быть рекомендован к применению в качестве средства лечения больных в восстановительном периоде ишемического мозгового инсульта.
Аналоги препарата
Для терапии гипотетически подходит любое средство, которое разработано на основе холина альфосцерата.
На деле специалист выбирает аналог с учётом нескольких важных факторов.
Наиболее эффективными считаются лекарства:
- Церепро;
- Ноохолин Ромфарм;
- Делецит;
- Церетон;
- Холитилин;
- Глеацер.
Для детей врач предлагает:
- Анвифен (в капсулах) – рекомендовано с 3-х летнего возраста, активное вещество – аминофенилмасляная кислота;
- Кортексин (в инъекционных ампулах) – допускается включать в терапию для недоношенных детей;
- Аминалон (в таблетках) – состав содержит ГАМК, применяется с 1 года;
- Пантогам (в виде сиропа) – состав разработан на основе гопантеновой кислоты, препарат подходит для любого возраста;
- Ноотропил (разные формы) – состав разработан на основе пирацетама, используется с годовалого возраста.
Подбор аналога осуществляет квалифицированный специалист, который учитывает свойства лекарства и его зону влияния на здоровье определённого пациента.
Восстановление после инсульта
Восстановление мозга после инсульта
В настоящее время, при рассмотрении процессов восстановления мозга после инсульта, особое внимание уделяется способности фосфолипидов (веществ, входящих в состав мембран нейронов) и деацетилированных фосфолипидов поддерживать целостность мембран нервных клеток через восстановление синтеза фосфолипидов и синтеза ацетилхолина в поврежденном мозге. Соединения, обладающие такими свойствами, называют нейропротекторами (защищающие нейроны). Помимо нейропротекторов, пациентам, перенесшим инсульт, назначаются препараты для восстановления церебрального кровотока, а также симптоматическая терапия и другие препараты (в зависимости от периода заболевания, причин инсульта и его клинической картины).
Крайне важно начать лечение инсульта как можно раньше: в первые часы заболевания!
Средства восстановления после инсульта
К нейропротекторам, применяемым в качестве средств для восстановления после инсульта, в полной мере относятся вещества, источники холина и фосфатидилхолина – центральные холиномиметики, такие как холина альфосцерат, или препарат глиатилин. Холина альфосцерат хорошо изучен в многочисленных зарубежных и российских исследованиях, и активно применяются в клинической практике уже более 25 лет. (Одинак М.М. и соавт, 2010)
Центральные холиномиметики – это вещества, поддерживающие физиологический уровень ацетилхолина (нейромедиатора – передатчика возбуждения в центральной нервной системе – головном и спинном мозге). Дополнительные свойства центральных холиномиметиков
- Восстанавливают мембраны нейронов
- Восстанавливают межнейрональную передачу
Возможно ли восстановление после инсульта? – вопрос, который одинаково часто волнует, как самих пациентов, перенесших инсульт, так и их родственников.
В каждом случае ответ на этот вопрос индивидуален. Значение имеют как тяжесть состояния пациента, так и сроки начала реабилитации.
Полное восстановление после инсульта
Безусловно, в большинстве случаев, инсульт происходит у людей пожилого возраста. Однако, инсульт может произойти раньше: от 2 до 3% инсультов поражает людей трудоспособного возраста. В нашей стране к активной трудовой деятельности возвращается около 23% пациентов3.
Основным участником постинсультной реабилитации является пациент и его желание восстановить утраченные функции!