Патологии формирования и развития нервной трубки закладываются на сроке 2-4 недели, когда женщина даже не знает, что беременна. Среди причин, приводящих к нарушению формирования нервной трубки отмечают внешние факторы: алкогольное отравление, курение, болезни матери, приём лекарственных препаратов, неправильное питание.
Пороки этого органа настолько тяжелы, что часто несовместимы с жизнью. И невооружённым глазом определить аномалию невозможно. Выявить патологию формирования нервной трубки можно только на скрининговом УЗИ плода, поэтому это исследование нельзя игнорировать.
| Цена скринингового УЗИ в нашей клинике | |
| Запись исследования на видеоноситель DVD + ФОТО — В ПОДАРОК ! | |
| 1 триместр: УЗИ при беременности с ранней диагностикой ВПР и расчетом риска болезни Дауна (11 недель 6 дней – 13 недель и 6 дней), один плод, c использованием 3D/4D реконструкции | 2000 |
| 1 триместр: комбинированный тест с расчетом риска болезни Дауна + взятие крови на биохимический скрининг (РАРР-А и свободн. бета-ХГ) и УЗИ плода (11 недель 6 дней – 13 недель и 6 дней), один плод c использованием 3D/4D реконструкции | 3300 |
| 2 триместр: УЗИ при беременности (18 недель 0 дней – 21 неделя и 6 дней), один плод, c использованием 3D/4D реконструкции | 3100 |
| 3 триместр: УЗИ при беременности (30 недель 0 дней – 34 неделя и 6 дней), один плод, c использованием 3D/4D реконструкции + доплерометрия | 3600 |
Анэнцефалия
Содержание статьи
Анэнцефалия — это полное или частичное отсутствие больших полушарий головного мозга, а в некоторых случаях костей черепа и мягких тканей. Встречается в 1 случае из 10 000, аномалия сопровождается другими нарушениями — незаращением верхней губы или твёрдого нёба, отсутствием гипофиза, спинномозговой грыжей.
Такое происходит, если по каким-то причинам на 3-4 неделе беременности не закрывается передний нейропор. Из-за этого не развиваются фронтальные расширения нервной трубки, из которых позже начали бы развиваться большие полушария.
Вместо богатого нейронами «серого вещества» формируется фиброзная ткань, в которой присутствуют единичные нервные клетки, кистозные образования и кровеносные сосуды. В 71% случаев у плода отсутствует лобно-затылочная зона и позвоночный столб, в 24% — затылочная доля с позвоночным столбом и в 5% — височно-теменная зона. Тело малыша при этом не имеет никаких отклонений.
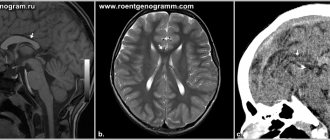
На УЗИ анэнцефалия диагностируется на 11-12 неделях беременности, достоверность составляет 96%.
Для патологии характерны следующие эхопризнаки:
- не визуализируются кости черепа;
- мягкие ткани головного мозга анэхогенные;
- в сосудистой системе головного мозга наблюдается мальформация – неправильное соединение сосудов, вен и артерий;
- многоводие у матери (переизбыток амниотической жидкости).
Одним только ультразвуковым обследованием диагностика анэнцефалии не ограничивается. При дефекте нервной трубки в крови женщины повышается гормон альфа-фетопротеин. При подтверждении диагноза ей рекомендуется остановить беременность, потому что при отсутствии головного мозга у новорождённого через некоторое время откажут лёгкие, сердце, почки.
УЗИ-диагностика является первичным, но не основным методом постановки диагноза. Если патология нервной трубки будет обнаружена на УЗИ-обследовании, женщине назначают амниоцентез — взятие под контролем трансабдоминального датчика амниотической жидкости из околоплодного пузыря с целью лабораторного исследования.
При обнаружении высокой концентрации альфа-фетопротеина и фермента ацетилхолинэстеразы беременную отправляют на МРТ (магнитно-резонансную томографию). В отличие от УЗИ, этот метод позволяет увидеть головной мозг плода в 4D проекции, увеличив изображение в несколько раз.
Чем раньше будет поставлен диагноз, тем быстрее женщина сможет прервать беременность. Сохранять её при таком диагнозе не имеет смысла, потому что малыш проживёт максимум неделю.
Строение и слои
В процессе развития нервной системы в трубке возникает три слоя:
- эпендимный или внутренний;
- мантийный или промежуточный;
- краевая вуаль или наружный слой.
Первый слой служит основой для нейронов и глиоцитов нервной системы. Часть нейронов переходит в периферическую часть органа, образуя мантийный слой, а остальные формируют клетки глии.
Важнейшие из них – эпендимоциты выстилают внутреннюю часть трубки, которая затем разовьется в центральный спинномозговой канал и стенки желудочков головного мозга.
Во внутреннем слое выделяют отдельные функциональные зоны, которые со временем переходят одна в другую. Зона деления содержит клетки, среди которых находящиеся ближе к центру протягивают отростки к наружному краю и перемещают туда тело нейрона, содержащее ядро.
В нем в это время происходит синтез ДНК, после чего частицы возвращаются на свое место. Клетки же, «сидящие» на нижнем краю, делятся на две.
На участке миграции эти половинки взаимодействуют. Одна из них опять начинает делиться, а другая, используя ее, перемещается к промежуточному слою.
Промежуточный слой возникает благодаря нейробластам – клеткам мигрантам, не потерявшим способность к делению и крепящимся к внутренней части слоя.
Нейробласты постепенно образуют аксоны, которые направляют в наружный слой, формируя таким образом дендритное дерево и превращаясь в нейроны. Не закрепленные клетки преобразуются в спонгиобласты. Из промежуточного слоя формируется такая часть спинномозговой ткани, как серое вещество.
Слой снаружи состоит из отростков нейронов, содержащихся в мантийном слое, и кровеносных сосудов. Он выступает основой для развития белого вещества в мозге.
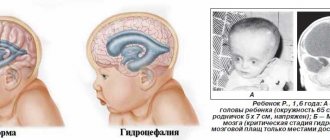
Гидроцефалия
Гидроцефалия — это аномалия развития плода, при которой увеличивается количество желудочков головного мозга. В норме их должно быть четыре, и через них происходит циркуляция ликвора — спинномозговой жидкости. При нарушении выработки или всасывания ликвора в кровеносную систему жидкость скапливается в желудочках, расширяя их.
Причиной патологии служит неправильное развитие нервной трубки эмбриона. Это случается на ранних сроках до 4 недель, и в 20% случаев причиной служат внутриутробные инфекции.
При гидроцефалии, скапливающаяся спинномозговая жидкость растягивает желудочки, они давят на головной мозг. Вследствие этого черепная коробка расширяется, голова обретает неправильную форму.
На ранних сроках порок сложно заметить, он выявляется, начиная с 10 недели беременности. На УЗИ заметно расширение лобных долей, родничок становится более выпуклым, а голова непропорционально большой.
Гинеколог, проводя скрининговое УЗИ, делает замеры между висками по надбровной линии (БПР) и, начиная с 16 недели, измеряет расстояние между лбом и затылком (ЛЗР). Сравнивая результаты с нормальными показателями, характерными для данного срока беременности, врач делает и другие замеры.
Увеличение показателей БПР и ЛЗР не всегда указывает на патологии. Вполне возможно, что малыш сам по себе крупный, если остальные замеры его тела также превышают норму. Только если параметры головы значительно увеличены при нормальных параметрах тела, врач диагностирует «гидроцефалию».
Именно замеры головы позволяют отличать гидроцефалию от врождённого увеличения размеров мозговых желудочков. При этом заболевании внутричерепного давления нет, поэтому размеры черепа соответствуют норме.
Часто гидроцефалия сопровождается другими пороками развития. На УЗИ заметно сглаживание извилин головного мозга, неправильное формирование сосудов, аномалия различных отделов спинного мозга, увеличение полушарной щели.
Ещё один признак гидроцефалии у плода — гипертонус матки на протяжении всей беременности. Если причиной развития патологии является инфекция, то женщину будет беспокоить плохое самочувствие.
Специалист оценивает степень развития гидроцефалии и даёт рекомендации и прогнозы относительно будущего малыша. В некоторых случаях аномалия нервной трубки у плода настолько выражена, что лечение ребёнка окажется малоэффективным. В этом случае женщине предлагается аборт. Однако бывает противоположная ситуация, и после лечения малыш будет вести полноценный образ жизни.
Врожденные заболевания и пороки развития центральной нервной системы (ЦНС) служат одной из главных причин перинатальной и ранней детской смертности, а также психоневрологической инвалидизации с детства [1, 2]. Умственная отсталость в 85% наблюдений является врожденной. Каждый случай рождения ребенка-инвалида представляет собой серьезную медицинскую, социальную и экономическую проблему [3—5]. Ее решение требует максимально полной информации об особенностях и характере поражения ЦНС еще до родов.
В разных странах мира существует свой подход к возможностям регулирования рождаемости детей с пороками развития. В последние десятилетия наблюдается тенденция к отказу от прерывания беременности или досрочного родоразрешения по медицинским показаниям, что связано с этическими, религиозными или другими причинами. Кроме того, успехи современной детской хирургии в отдельных случаях позволяют оптимистически смотреть на прогноз при лечении ряда заболеваний, которые ранее рассматривались как неперспективные. Пороки развития ЦНС традиционно расценивались как тяжелые врожденные заболевания с плохим прогнозом, которые сопровождаются либо гибелью пациента, либо тяжелой инвалидизацией.
Распространенность дефектов нервной трубки (ДНТ) в разных странах колеблется от 1 до 7 на 1000 случаев рождения. По данным французских исследователей, в Восточной Франции spina bifida
встречается в 0,62 случая на 1000, анэнцефалия — в 0,33 на 1000 и энцефалоцеле — в 0,14 случая на 1000. Преимущественно ДНТ являются аномалиями мультифакторной этиологии. Известны случаи сочетания ДНТ с трисомиями и триплоидиями и некоторыми другими вариантами хромосомных заболеваний.
Известны разные тератогенные факторы (лекарственные препараты), заболевания матери (сахарный диабет, гипотиреоз и др.). Отдельные варианты ДНТ, имеющие синдромальный характер, до сих пор не нашли объяснения (экстрафия клоаки в сочетании с миелоцистоцеле, кресцово-копчиковая тератома в сочетании с менингомиелоцеле, а также множественное энцефалоцеле) [6—9]. Одной из наиболее известных причин врожденных пороков является дефицит фолатов.
ДНТ представляют собой общие комплексные многофакторные нарушения нейруляции при закладке головного и спинного мозга у эмбриона человека на 21—28-й день после зачатия [10]. При обнаружении ДНТ у плода в большинстве случаев течение беременности, по данным большого количества источников литературы, сопровождается выраженным многоводием, манифестирующем уже во II триместре беременности. Большинство публикаций указывают на более частое развитие многоводия в случае открытой spina
bifida
и анэнцефалии. Такие формы пороков часто сопровождаются повышением уровня α-фетопротеина (АФП) в амниотической жидкости и сыворотке крови беременной. Закрытые формы
spinabifida
и другие пороки ЦНС, не сопровождающиеся ликвореей, часто не приводят к изменению нормальных уровней АФП [11, 12]. Особый интерес для изучения представляют плоды с наличием
spinabifida
, поскольку данный порок является одним из наиболее часто встречающихся, а в литературе имеются различные сведения об исходах таких беременностей и прогнозе у родившихся детей [13, 14]. Важным различием в прогнозе у плода со
spinabifida
является дифференцировка порока развития на открытую и закрытую формы. При наличии открытой формы
spinabifida
прогноз для плода значительно хуже, чем при закрытой форме. Кроме того, спинномозговые грыжи в 70—95% наблюдений сочетаются с аномалиями головного мозга по типу мальформации Киари II типа [15, 16].
Антенатальная дифференциальная диагностика открытой и закрытой форм spina
bifida
, по данным зарубежных исследователей, сложна. Вместе с тем ребенок, родившийся с открытой формой
spinabifida
, демонстрирует тяжелую неврологическую симптоматику в первые часы после рождения. Возможно апноэ центрального генеза и другие неврологические и дыхательные дисфункции. В большинстве случаев наблюдаются моторные и сенсорные нарушения, зависящие от уровня
spinabifida
(80% — пояснично-кресцовая локализация). При дальнейшем наблюдении за такими детьми, кроме указанных симптомов дизадаптации, наблюдаются спастические явления в мочевыводящих путях и прямой кишке. Часто отмечается присоединение инфекции. Наиболее частое осложнение — внутренняя гидроцефалия (у 70% детей после рождения). По мнению некоторых исследователей, именно гидроцефалия является главной причиной умственной отсталости у детей с открытыми формами
spinabifida
. Следует признать, что ведение беременности и общеклинический прогноз у детей, рожденных со
spinabifida
, менялся на протяжении десятилетий. В 60—70-е гг. прошлого века большинство сообщений свидетельствовало о плохом прогнозе и большом количестве осложнений. В дальнейшем было показано, что раннее оперативное лечение новорожденных позволяет снизить процент таких осложнений, как инфекция, прогрессирующая гидроцефалия, моторные и сенсорные симптомы. Имеются отдельные сообщения об антенатальном хирургическом лечении открытых форм
spinabifida
, которое, по мнению авторов, также может снизить число осложнений и улучшить общее и неврологическое состояние ребенка после рождения. Рекомендуется также родоразрешение путем кесарева сечения для снижения вероятности механического воздействия на область грыжи и профилактики инфекции. Ряд авторов указывают на то, что хирургическое лечение новорожденного с открытой формой
spinabifida
— это только первый шаг. Постоянно возникает необходимость проведения корригирующей и реабилитационной терапии с привлечением детских хирургов, педиатров, урологов, невропатологов, психотерапевтов и психологов.
Несмотря на отдельные успехи в лечении открытых форм spina
bifida
и менингомиелоцеле прогноз во всех этих случаях после рождения остается серьезным. Лишь отдельные наблюдения указывают на благоприятный исход.
Черепно-мозговые грыжи подразделяются на краниальные менингоцеле и энцефалоцеле. По данным педиатрической литературы [3, 17], возможно только хирургическое лечение. Большинство случаев черепно-мозговых грыж имеет крайне плохой прогноз из-за большого количества осложнений и частого сочетания с различными аномалиями и генетическими синдромами (Меккеля—Грубера, трисомия 13, синдром Гольденхара, синдром Робертса и др.). Существуют данные, что передние грыжи (фронтальные и назофронтальные) имеют лучший прогноз по сравнению с затылочными и теменными грыжами. В отдельных сообщениях указывается, что, несмотря на лечение, около 40% детей с наличием грыжи умирают. Во всех случаях имеют место тяжелые моторные расстройства, а у 50% выживших детей может наблюдаться нормальное интеллектуальное развитие [16, 18].
Учитывая многообразие причин, приводящих к порокам развития у плода, необходимо использовать известные в настоящее время мероприятия, снижающие риск развития врожденных пороков. Анализируя различные этиологические факторы пороков развития у плода, можно выделить генетические и негенетические причинные факторы (например, нутритивный статус или ожирение у матери) [19—21].
В литературе встречаются противоречивые данные о роли фолатов в развитии ДНТ. С одной стороны, имеются сообщения о нормальном содержании сывороточного фолата у матерей, дети которых рождались с ДНТ. Исследования [22, 23] на культивируемых эмбрионах крыс или мышей с дефицитом фолиевой кислоты (ФК) показали отсутствие ДНТ при ее дефиците. С другой стороны, по данным проведенных за последние десятилетия исследований [24], отмечено, что развитие ДНТ связано с авитаминозом, а экзогенное или периконцепционное поступление ФК в организм будущей матери способствует снижению риска ДНТ у плода. Необходимо отметить, что не только дефицит фолатов в организме беременной является фактором риска развития ДНТ, но и особенность течения всего процесса метилирования влияет на формирование ДНТ [20, 25]. В ряде исследований [26] сообщается о профилактике ДНТ и коррекции дефектов биосинтеза при поступлении экзогенной ФК и тимидина у гомозиготных эмбрионов мыши splotch (Pax3).
Таким образом, так как дефицит ФК может являться фактором риска ДНТ, необходимы дополнительные исследования для оценки механистической роли метаболизма ФК в развитии ДНТ.
Для подтверждения влияния ФК в генезе развития ДНТ R. Smithells и соавт. [27, 28] провели исследование с использованием диеты, обогащенной мультивитаминами (ФК 0,36 мг/сут) у женщин, ранее имевших детей с ДНТ. Контрольной группой явились беременные, которые не принимали витамины. Результаты этого многоцентрового исследования, опубликованные в 80-х годах XX века, показали снижение частоты ДНТ плодов у женщин, принимавших витамины, на 83—91% в сравнении с таковыми в контрольной группе [27—30]. Эти результаты впервые показали, что употребление витаминов или ФК может играть важную роль в эмбриогенезе и снизить частоту ДНТ у плода при повторной беременности. Позднее, в 1991 г. после рандомизированного контролируемого исследования (РКИ), проведенного в 33 центрах в 7 странах, Британский совет медицинских исследований (British Medical Research Council) заявил, что у женщин с ДНТ плода в анамнезе суточное потребление ФК в дозе 400 мкг является эффективным методом снижения частоты развития ДНТ при повторной беременности на 70% [31]. Это было позже подтверждено результатами РКИ, проведенного в Венгрии в 1992 г.: употребление ФК в дозе 0,8 мг/сут в периконцепционный период привело к значительному снижению частоты развития первичных ДНТ [32]. В 1991 г. CDC рекомендовал прием ФК в дозе 4000 мкг/сут до беременности и в течение нее для женщин с ДНТ плода при предыдущей беременности [33]. В 2000 г. медико-генетической службой Московского областного научно-исследовательского института акушерства и гинекологии была разработана и внедрена в практическое здравоохранение Московской области программа первичной массовой профилактики фолат-зависимых пороков развития.
К 2005 г. 75% беременных региона принимали ФК периконцепционно с ежедневной дозой 0,8 мг. За период с 2000 по 2005 г. в Московской области, по данным регионального регистра врожденных пороков у детей, доля фолат-зависимых врожденных пороков развития: ДНТ (анэнцефалия, спинномозговые грыжи) снизилась с 6,44 в 2000 г. до 1,91 на 10 000 рождений в 2005 г., как свидетельство эффекта проводимых первичных профилактических мероприятий.
В настоящее время фолатная профилактика имеет широкое распространение в Российской Федерации, а ФК входит в перечень рекомендуемых лекарственных препаратов для беременных на период планирования и I триместра беременности [34, 35].
В 2007 г. в Канаде было предложено включить в факторы риска ожирение (ИМТ более 35) и рекомендовать стратегию приема ФК в более высоких дозах (5 мг) для пациенток с низкой комплаентностью при приеме лекарственных средств в анамнезе и дополнительными факторами образа жизни (употребление алкоголя, курение, прием лекарственных средств без рецепта). Для профилактики ДНТ плода при наличии у матери эпилепсии и сахарного диабета рекомендуется прием ФК в дозе 4—5 мг/сут [36, 37].
Для понимания влияния дефицита фолатов на увеличение риска возникновения пороков развития необходимо вспомнить особенности метаболизма фолатов. ФК необходима для одноуглеродного метаболизма, играющего важную роль в различных клеточных реакциях. Трансмембранный перенос и транспортировка фолата осуществляются за счет рецепторов и специфических переносчиков [38]. При нормальных условиях фолат, содержащийся в пище, всасывается в кишечнике, поступает в печень и вначале превращается в тетрагидрофолат, а затем метаболизируется до 5-метил-тетрагидрофолата (5-метил-ТГФ). ФК, содержащаяся в обогащенных продуктах и пищевых добавках, первично метаболизируется до дигидрофолата ферментом дигидрофолатредуктаза в печени, а затем трансформируется в тетрагидрофолат (ТГФ), являющийся субстратом для полиглутаматсинтетазы. Полиглутаматная форма ТГФ, образованная в результате потребления ФК или фолата с пищей, служит основной молекулой-акцептором фолата в одноуглеродном цикле. Далее ТГФ конвертируется в 5,10-метилен-ТГФ пиридоксинзависимой серингидроксиметилтрансферазой, а затем необратимо метаболизируется до 5-метил-ТГФ ферментом MTHFR (метилентетрагидрофолатредуктаза). 5-метил-ТГФ выступает в роли первичного донора метильных групп для реметилирования гомоцистеина в метионин. Метионин является основным субстратом для синтеза SAM (S-Adenosylmethionine, S-аденозилметионина), играющим важную роль в реакциях метилирования, катализируемых ДНК-метилтрансферазами с образованием 5-метилцитозина [39—41]. Таким образом, весь метаболизм ФК модулируется несколькими фолатными коэнзимами. Основная функция такого коэнзима — модулирование метаболического пути за счет приема или отдачи одноуглеродной группы [41]. Ключевыми ферментами этого метаболического пути, участвующими в процессе переноса метильной группы к молекуле гомоцистеина и наиболее хорошо изученными, являются MTHFR, метионинсинтаза-редуктаза (MTRR), редуцированный переносчик фолата (RFC), а также кобаламинзависимая метионинсинтаза (MTR) [43]. Этиология ДНТ долгое время считалась связанной с нарушением регуляции генов основного метаболического пути фолата или метионинсинтазы, а также с однонуклеотидным полиморфизмом, таким как 677С>Т в гене MTHFR
[44]. Таким образом, будущие исследования ФК-индуцированного метилирования и подробный анализ метаболического пути фолата и его роли в закрытии нервной трубки могут открыть для нас новую информацию.
Применение пищевых добавок, например ФК, и их влияние на геном могут оказывать долговременный эффект на здоровье человека без первопричинных генетических изменений. Доступность множества пищевых компонентов, участвующих в одноуглеродном метаболизме, включая витамин В6, холин, бетаин, метионин, витамин В12 и фолат, может привести к изменениям в метилировании ДНК и модификации гистонов. Модулирование схемы метилирования зависит от содержания двух метаболитов одноуглеродного метаболизма: SAM (донор метильных групп) и SAH (S-Adenosyl-Homocysteine ― S-аденозилгомоцистеин, ингибитор метилтрансфераз) [45—47]. Таким образом, нутритивные эпигенетические факторы, такие как ФК (кофактор в одноуглеродном метаболизме в период беременности), могут повлиять на программирование плода, модулировать схемы метилирования ДНК во всем геноме и вызывать дисрегуляцию экспрессии генов [48]. Исследование у детей младшего возраста, матери которых принимали ФК в периконцепционный период в дозе 400 мкг, показало улучшение процесса метилирования импринтингового гена инсулиноподобного фактора роста II в сравнении с таковым у женщин, не принимавших ФК в периконцепционный период [49]. Кроме того, несколько эпидемиологических и молекулярных исследований также связывают употребление фолата с эпигенетическим изменением за счет метилирования ДНК с развитием нервной трубки, включая активацию рецепторов фолата (Folr1) и регенерацию спинного мозга [50, 51]. С целью понимания ФК-индуцированного эпигенетического механизма регуляции закрытия нервной трубки было проведено исследование на эмбрионах Splotch (Sp–/–), показавшее, что употребление матерью фолата в периконцепционный период снижает количество маркеров метилирования H3K27 и ремоделирует хроматин в промоторах Hes1
и
Neurog2
— генах, необходимых для развития нервной трубки [52].
В литературе [27] встречаются данные, свидетельствующие о том, что прием ФК изменяет экспрессию некоторых генов, включая FMR1
в клетках лимфобластомы. Кроме того, в исследовании на модели мыши выявлено изменение схемы метилирования эпигенома мозга у потомства в случаях, когда в организм матери поступало большое количество ФК в период беременности [53]. Изменения процесса метилирования отмечались как в CpG-, так и в не-CpG-участках, что привело к различиям в экспрессии нескольких ключевых генов развития и импринтинговых генов, а метилирование и экспрессия некоторых генов изменялись в зависимости от пола. Полученные в ходе исследований результаты свидетельствуют, что фолат играет ключевую роль в эпигенетической регуляции программирования развития плода. Cледовательно, будущие исследования роли дефицита и потребления фолата в эпигенетических изменениях помогут выявить причинно-следственную связь между содержанием ФК и метилированием ДНК при различных заболеваниях.
Питание считается полноценным, если оно обеспечивает нормальный рост, развитие, профилактику заболеваний и устойчивость к воздействию неблагоприятных факторов внешней среды. При этом полноценное питание определяется как энергетической ценностью пищи, так и сбалансированностью рациона по белкам, жирам, углеводам, а также обеспеченностью витаминами и микроэлементами.
Различные состояния организма — нарушение всасывания биологически активных веществ в желудочно-кишечном тракте — ЖКТ (заболевания ЖКТ, анорексия различного генеза), изменения метаболизма витаминов (при ферментопатиях), несоответствие между потребностью в витаминах и поступлением их с пищей способствуют развитию гиповитаминоза.
Остается важным вопрос о потенциальном воздействии на здоровье различных обогащенных продуктов, пищевых добавок, включая витамины для беременных, отпускаемые без рецепта, а также энергетических напитков, обогащенных различными витаминами [54, 55].
По данным зарубежной литературы [56], в ходе проведенного исследования на мышах показано, что увеличение потребления ФК матерью во время беременности в 10 раз изменяло экспрессию нескольких генов в лобной коре головного мозга однодневных детенышей. Продолжение потребления ФК в такой высокой дозе после отмены привело к изменениям поведения в сравнении с таковым у детенышей матерей, потреблявших ФК в более низких дозах. Такие изменения поведения могли быть вызваны изменениями экспрессии генов из-за аберрантного метилирования.
В разных исследованиях показано, что потребление фолата может индуцировать аберрантные схемы метилирования ДНК и играть двойную роль в канцерогенезе. Потребление Ф.К. может предотвратить появление новообразований на ранней стадии или потенциально навредить за счет стимуляции прогрессирования имеющихся пренеопластических образований [57]. Исследование у детей, участвующих в исследовании детской лейкемии Северной Каролины, выявило отсутствие значимой связи между содержанием фолата при рождении и детской острой миелоидной лейкемией. Результаты РКИ и метаанализ показали, что прием пренатальных витаминов, содержащих ФК, связан со значимым защитным действием при детских онкологических заболеваниях: лейкемии, опухоли мозга, нейробластоме [58]. Недавние экологические исследования выявили снижение частоты развития нефробластомы, нейробластомы, примитивных нейроэктодермальных опухолей и эпендимомы после обогащения пищевых продуктов ФК в США и Канаде [59, 60].
Употребление ФК во время беременности и далее играет важную роль в модулировании экспрессии генов и исходах, связанных с заболеваниями. Благодаря участию ФК в нескольких клеточных процессах, включая эпигенетическое модулирование и снижение частоты ДНТ, доза, схема приема (преконцепционный прием/периконцепционный/в период беременности) и источник фолата во время беременности и в течение жизни могут быть критически важными. Будущие клинические и базовые исследования по установлению связи между избыточным потреблением фолата и нормальным развитием помогут объяснить дискордантность между преимуществом и возможным ущербом.
По данным литературы [61—68], результаты нескольких когортных исследований, проведенных в США, Канаде, Чили, Австралии, нескольких странах Европы и Азии, выявили клиническую значимость приема ФК, хотя благоприятный эффект был достигнут не во всех случаях.
Несколько стран ввели обязательное обогащение продуктов питания ФК, и, несмотря на эффективность этого решения, на основании опубликованных на настоящий момент данных нельзя прийти к окончательному выводу — вопрос о дозировании и потенциальных побочных эффектах остается дискуссионным [70]. Ввиду того, что прием будущей матерью ФК может индуцировать потенциальное эпигенетическое действие на геном ребенка, причем метаболическая активность варьирует индивидуально в зависимости от расовой принадлежности, пола, региона проживания и взаимодействия с другими нутриентами, одной из возможных причин расхождений между исследованиями могут являться различия в дизайне исследования. Необходимо дальнейшее международное сотрудничество с целью накопления научных клинических доказательств, а также интерпретации результатов интервенционных исследований и потенциального действия в больших когортах.
По данным разных авторов [71], прием ФК матерью может привести к эпигенетическому модулированию мозга ребенка с общими или местно-специфическими изменениями метилирования геномной ДНК, некодирующей РНК и модификации гистонов. Эти эффекты могут изменить экспрессию некоторых импринтинговых генов, генов возможной предрасположенности к аутизму и основных генов, отвечающих за развитие.
За последние 20—25 лет клиническое применение пищевых добавок с ФК для профилактики ДНТ наблюдалось многократно. Однако, учитывая озабоченность по поводу содержания фолата в сыворотке крови после введения пищевых продуктов с обязательным обогащением ФК, возникает необходимость изучения влияния приема ФК на другие нормальные биологические процессы, например, развитие мозга. Определение уровня и распределения профиля метилирования эпигенома мозга может выявить механизм и нисходящую последовательность различных нейропсихиатрических и импринтинговых заболеваний, включая аутизм. Более того, поскольку содержание фолата в крови может влиять на процесс метилирования, необходимо проведение дальнейших исследований для изучения системных различий профиля метилирования ДНК относительно времени приема и дозирования ФК у пациенток, различающихся по популяционным и гендерным признакам.
Дефицит витаминов и микроэлементов может иметь негативные последствия в виде репродуктивных потерь, нарушений нормального физического и психического развития плода. Сбалансированный рацион женщины в периконцептуальный период полностью не обеспечивает потребности организма, так как во время беременности в связи с ростом и развитием плода значительно увеличивается потребность организма в витаминах и микроэлементах. Если развиваются различные осложнения (тошнота и токсическая рвота беременных), происходит ограничение потребления пищевых продуктов и снижение поступления в организм необходимых нутриентов. В настоящее время с целью профилактики дефицита ФК и других витаминов и минералов активно применяется препарат Элевит Пронаталь («Байер»), содержащего 12 витаминов, 4 минерала и 3 микроэлемента. Этот витаминно-минеральный комплекс содержит витамины в оптимальном для беременных количестве: фолиевую кислоту 0,8 мг, А — 1,2 мг, В1 — 1,6 мг, В2 — 1,8 мг, В6 — 2,6 мг, В12 — 4 мкг, С — 100 мг, D3 — 12,5 мкг, Е — 15 мг, биотин — 0,2 мг, пантотенат кальция — 10 мг, никотинамид — 19 мг. Препарат принимается внутрь после еды по 1 таблетке в сутки за 3 мес до беременности, в период беременности, после родов и в период грудного вскармливания. Элевит Пронаталь рекомендован для профилактики дефицита ФК. В Венгрии на фоне осуществления программы помощи женщинам в период зачатия с использованием Элевит Пронаталь не наблюдались повторные случаи ДНТ у 38 беременных женщин, у которых раньше рождались дети с пороками.
Эффективность препарата Элевит Пронаталь доказана в двойном слепом плацебо-контролируемом клиническом испытании, проведенным с 1984 по 1991 г. с участием 5500 беременных женщин. Безопасность препарата подтверждена 15-летним опытом его применения более чем у миллиона беременных во всем мире. Элевит Пронаталь единственный витаминно-минеральный комплекс с клинически доказанной эффективностью в профилактике врожденных ДНТ. При исследовании 5500 беременных частота всех разновидностей врожденных пороков в группе принимавших препарат составила 20,6 на 1000 беременностей, а в контрольной — 40,6 на 1000 [33].
Элевит Пронаталь может использоваться для профилактики врожденной патологии в рамках комлексной программы, включающей медико-генетическое обследовaние (кариотипирование супругов, определение носительства мутаций фенилкетонурии и муковисцидоза, молекулярное тестирование таких генов предрасположенности, как ген метилен-ТГФ-редуктазы, определение уровня гомоцистеина в плазме крови).
Для профилактики врожденной патологии очень важны оценка состояния здоровья, коррекции отклонений в состоянии здоровья и нутритивная поддержка до зачатия у обоих супругов. Использование витаминно-минеральных комплексов обеспечивает улучшение здоровья женщин, что способствует нормальному течению беременности и рождению здоровых новорожденных.
Микроцефалия
Микроцефалия — это сложнейшая патология головного мозга, выраженная в уменьшении размеров органа у плода. Причиной недоразвития головного мозга служит нарушение деления нервных клеток на стадии формирования нервной трубки эмбриона.
Патология провоцируется несколькими факторами: в 40% она развивается на фоне цитомегаловируса у матери, также существует наследственная форма болезни Джакомини-Пенроуза-Бека.
Микроцефалия встречается редко: 1 случай на 5 000, и часто сопровождается другими нарушениями ЦНС Ч лисэнцефалией (нарушением формирования коры головного мозга), микрогирией (малыми размерами мозговых извилин), аномалией мозжечка, недоразвитостью спинного мозга.
В плане диагностики микроцефалия — самый сложный порок. За основу УЗИ-исследования взят критерий соотношения длины бедренной кости и окружности головы плода, который не должен быть меньше 2,5. Однако интерпретация затрудняется тем, что не всегда известен точный срок беременности. Ложноположительный и ложноотрицательный результат может быть из-за небольших размеров плода или нарушения роста костей при других патологиях.
Точность УЗИ-диагностики при микроцефалии составляет 67,4%, причём в 85% случаев диагноз ставится позже 22 недель беременности. Начиная с 2 недели на УЗИ легко прослеживается строение черепа. При микроцефалии он имеет неправильную форму, лоб скошен, ушные раковины расположены низко, челюсти недоразвиты. Также имеется расширение мозговых желудочков.
Дополнительно в 60% у плода диагностируются другие нарушения ЦНС, болезни почек, сердца и других внутренних органов.
Диагностика микроцефалии всегда комплексная. При подозрении на патологию у женщины берут анализ амниотической жидкости, проводят кариотипирование плода. Только после тщательного обследования женщине говорят о диагнозе, и она сама решает, что делать дальше.
Что такое нервная трубка?
Нервной трубкой называют основу будущей нервной системы, формирующейся у плода, которая развивается из наружного клеточного слоя (зародышевого листка — эктодермы) наряду с кожей, в то время как из энтодермы формируется пищеварительная система.
Закладка нервной трубки плода начинается на третьей неделе его развития. Сначала появляется нервная пластинка, затем на ее краях формируются небольшие возвышения, называемые нервными валиками, по центру которых возникает желоб. Он в дальнейшем послужит полостью для органа. Примерно на 24 день пластинка начинает скручиваться и валики смыкаются, образуется форма трубки.
Спереди она расширяется, формируя мозговые пузыри, а остальная часть станет в дальнейшем спинным мозгом. От валиков постепенно отделяются частички ганглиозной пластинки, из которых потом сформируются узлы спинного мозга и ответвления вегетативной части нервной системы. Увидеть появление спинномозговых ганглий у зародыша можно уже через 1,5-2 месяца.
Клетки, образующиеся в ганглиозной пластинке, постепенно перемещаются к ганглиям в симпатическом стволе, мозговому слою надпочечников и стенкам будущего кишечника.
Окончательная сформированность трубки возникает на сроке в 5-8 недель, когда закладывается развитие всех органов плода. В этот момент у младенца формируются сердце, легкие, органы чувств, конечности и прочие системы. Усложняется и сама трубка.
Энцефалоцеле
Энцефалоцеле — это разновидность мозговой грыжи, при которой мозговые оболочки выходят за пределы черепа через черепные дефекты. Патология возникает из-за неразделения конца нервной трубки на 4-й неделе беременности. В результате у плода образуется полиповидная масса: в 75% случаев она локализуется на затылке или своде черепа, а в 25% выступает через лицевую область.
На УЗИ энцефалоцеле диагностируется на 11-12-й неделе беременности, когда происходит окостенение костей черепа. На экране монитора видно низкоэхогенное образование за пределами свода черепа. Оно состоит из мозгового вещества, а при менингоцеле виден ещё и ликвор.
В некоторых случаях (при энцефалоцистоменингоцеле) внутри грыжи визуализируется часть мозгового желудочка. Помимо этого, у плода имеются микроцефалия, гидроцефалия и другие внутриутробные пороки. Обычно при энцефалоцеле у женщины наблюдается маловодие, затрудняющее диагностику.
К другим признакам энцефалоцеле у плода относятся:
- широкая переносица;
- ассиметрично расположенные глазницы;
- деформация черепа.
На ранних сроках беременности наблюдается повышение альфа- фетопротеина.
Ультразвуковая диагностика на сроке до 24-х недели беременности имеет эффективность 87%, однако при базальной форме патологии постановка диагноза будет затруднена. В большинстве случаев женщине рекомендуют прервать беременность в связи с тяжёлыми пороками у ребёнка и невозможностью его реабилитации в будущем.
Среди причин, вызывающих мозговую грыжу, можно выделить:
- токсическое воздействие на плод (курение, алкоголь, наркотики);
- приём сильнодействующих лекарственных препаратов;
- инфекции, в основном скрытые;
- вирусы (грипп, краснуха, гепатит) у матери;
- работа на тяжёлом производстве;
- генетический фактор.
В некоторых случаях при небольшом размере грыжи малышу в течение первых 3-х лет жизни делают операцию. Но даже при благоприятном исходе он будет несколько отставать в психо-эмоциональном развитии от своих сверстников. Если полипообразный нарост не удалять, он будет притягивать инфекции и вызывать дискомфорт. Малыш в таком случае погибает в течении 1 года жизни.
Дробь в квадрате
Деление оплодотворённой яйцеклетки называется дроблением. Это процесс, при котором растёт количество клеток, но их объём остаётся прежним, то есть с каждым следующим этапом они уплотняются и становятся мельче. Причём, это происходит достаточно быстро (одно деление в 12-20 часов), и уже к третьим суткам количество клеток в «комке» или так называемом концептусе может достигать 16. К этому моменту он уже «подплывает» к концу маточной трубы, в которой находился до этого (и где, собственно, произошло оплодотворение) и готов выйти в полость матки.
Интересно, что само дробление происходит неравномерно, и если под микроскопом посмотреть на концептус к концу второго дня, то вы увидите, что он похож на конгломерат из разного размера плотно спаянных шариков.
Внимание, дальше вас ждёт череда новых и необычных терминов, но не пугайтесь — мы всё будем пояснять.
Выход будущего эмбриона в полость матки ознаменовывает собой новый этап его развития – стадию морулы (ассоциация: для него полость – это «море»). Морула отличается от предшественника чуть большим количеством клеток, а также их организацией: внутри клетки связаны свободными щелевыми контактами, а снаружи формируют плотную оболочку – барьер, который обособляет внутреннюю среду. И делается это не случайно, ведь ещё через день (на 4-е сутки) в центре появляется заполненная жидкостью полость – бластоцель.
Морула и бластоциста на ранних этапах развития
Клеточная масса отчётливо разделяется на два слоя: внешний – трофобласт (та самая плотная оболочка), и внутренний – эмбриобласт, та клеточная масса, из которой начнут развиваться органы.
На 6-7 день будущий эмбрион «устаёт» скитаться в «бескрайнем» пространстве маточной полости и находит «пристанище» на одной из стенок, куда с помощью ферментов, лизирующих (расщепляющих) ткани внедряется трофобласт и «ставит» зародыша «на якорь». Теперь он готов развиваться дальше.
Профилактика. Можно ли предотвратить развитие?
Оптимальный способом профилактики дефектов нервной трубки считается прием фолиевой кислоты, являющейся разновидностью витамина B. Принимается фолиевая кислота в виде пищевых добавок или мультивитаминных комплексов. Также она содержится в некоторых обогащенных продуктах, таких как крупы, хлеб, макароны, рис и каши. Специалисты здравоохранения рекомендуют всем беременным или планирующим беременность женщинам принимать фолиевую кислоту. Суточная потребность организма составляет 0,4-0,8 мг.
Также врачи рекомендуют употреблять продукты, богатые фолатами. В частности, они содержатся в:
- темных зеленолистных овощах (шпинат)
- брокколи
- спарже
- бобовых
- горохе
- чечевице
- апельсинах и апельсиновом соке.
Причины и факторы риска
Причины развития дефектов нервной трубки не вполне ясны. Они формируются в первые месяцы беременности, когда далеко не все женщины знают о своем положении.
Риск развития у ребенка дефектов нервной трубки выше, если:
- в вашей семье были случаи дефектов нервной трубки
- вы страдаете ожирением
- у вас диабет
- вы принимаете определенные противосудорожные препараты
- вы принадлежите к определенной расе. Больше всего случаев дефектов нервной трубки зафиксировано среди латиноамериканцев.
К прочим факторам риска относятся генетика и воздействие окружающей среды.
Функции
Нервная ткань обеспечивает нормальное функционирование всех органов и систем. Состоит их клеток 2 типов:
- нейроны – главный структурный элемент, участвуют в приеме, переработке и передаче внешних и внутренних импульсов;
- нейроглии – обеспечивают питание и защиту нейронов, разграничивают группы нейронов с разными функциями.
Нервная ткань принимает участие в формировании основных структрур мозга – центральной и периферической.
Размножение
Ланцетник — раздельнополое животное. Выделение зрелых икринок и спермиев происходит сразу после захода солнца, оплодотворение внешнее (в воде). Личинки около трёх месяцев живут в толще воды, питаясь планктонными животными, а затем опускаются на дно. Ланцетник достигает половой зрелости на втором (третьем) году жизни.
Особенности эмбрионального развития и строения ланцетника исследовал русский зоолог-эволюционист Александр Онуфриевич Ковалевский (1840-1901), установивший близость этих животных к древнейшему предку позвоночных.